食用油脂中挥发性卤代烃的H S-S P M E-G C联用分析
赵鸿雁,郭莹莹,李 磊,*,乙小娟,孙建刚,陈君义
(1.南京医科大学公共卫生学院,江苏 南京 210029;2.张家港出入境检验检疫局,江苏 张家港 215600)
食用油脂中挥发性卤代烃的H S-S P M E-G C联用分析
赵鸿雁1,郭莹莹1,李 磊1,*,乙小娟2,孙建刚2,陈君义2
(1.南京医科大学公共卫生学院,江苏 南京 210029;2.张家港出入境检验检疫局,江苏 张家港 215600)
目的:建立进出口油脂中挥发性卤代烃(VHHs)的顶空-固相微萃取-气相色谱(HS-SPME-GC)联用分析方法。方法:采用Supelco公司5种SPME纤维头对食用油脂进行顶空萃取,比较不同萃取纤维的萃取效率,分别考察萃取温度、时间、顶空体积等对萃取效果的影响。用毛细管色谱柱分离萃取成分、气相色谱-电子捕获检测器(GCECD)进行检测。结果:优选的SPME纤维头为75μm碳分子筛-聚二甲基硅氧烷(CAR/PDMS)。于15mL顶空萃取瓶中加入9mL食用油,在60℃恒温水浴中萃取30min后,290℃解吸3min进行GC分析。方法检测限为0.02~1.4ng/mL,回收率在89%~105%之间,相对标准偏差(RSD)小于8.5%(n=5)。结论:该方法具有操作简便、快捷、灵敏度高、检测限低、不使用有机溶剂等特点,适合于食用油脂中挥发性卤代烃的检测。
食用油脂;顶空-固相微萃取-气相色谱(HS-SPME-GC);挥发性卤代烃;气相色谱;联用技术
食用油脂作为人们餐桌上必不可少的一种食物,其安全性被人们广为重视。随着我国食用油需求量的增长,进出口油脂也成了油脂消费市场的一部分。食用油脂尤其是植物油多采用压榨和浸出两种方法提炼而成。压榨法虽然安全但出油量低,浸出法则因能有效提高出油率而被企业广为采用。但由于浸出法采用有机溶剂提取,易造成溶剂残留。另外,油料加工过程中烘烤等工艺的处理、生产和长途航运过程中环境污染物的浸入、包装容器中有机物的迁移等因素,也会导致油脂中可能存在较多的有机污染物,这些有机物不仅影响产品的品质和稳定,而且威胁人类健康。其中,挥发性卤代烃是油脂中重要且较常见的有机污染物。
二氯甲烷、四氯化碳、三氯乙烯、三氯乙烷和四氯乙烯是挥发性卤代烃中比较有代表性的几种化合物,国内外多采用顶空法[1-3]、固相微萃取[4-7]、吹扫-捕集[8]、液-液萃取[9]等方法进行样品处理,也有采用傅里叶红外变换光谱法[10]以及光导管传感器[11]等方法进行检测。但这些方法各有缺点:或前处理费时费力,或需消耗大量有机溶剂,或灵敏度不能达到检测要求,或仪器昂贵不容易普及等。
顶空-固相微萃取(HS-SPME)是近年来发展起来的一项样品前处理技术[12-15]。由于它具有操作方便、快速且减少有机溶剂的使用等特点,并且集提取、富集、净化等功能于一体,在痕量物质的检测方面,尤其是针对复杂基质中有关物质的检测方面具有很大的应用优势[14]。目前,国内外学者已经对饮用水[2,9-10]、饮料及酒[1,5,14]、奶制品[3]、添加剂[7]、生物样品[12]以及空气[16]中挥发卤代烃的检测方法进行了研究。由于食用油脂本身呈香物质较多,挥发性基本较复杂,虽然有文献[6,13]进行油脂中挥发性醛类和溶剂残留检测,但食用油脂中挥发性卤代烃的检测和研究鲜见报道。本研究采用HS-SPME-GC联用技术,针对食用油脂中几种挥发性卤代烃化合物进行检测条件的优化,为动植物油脂中挥发性有机污染物的检测和卫生监督提供技术支撑。
1 材料与方法
1.1 材料及试剂
15mL顶空萃取瓶 德国CNW Technologies Gmbh;四氯化碳(99.5%,AR级) 杭州化学试剂有限公司;二氯甲烷(99.8%)、三氯乙烯(99.5%)、1,1,2-三氯乙烷(99.5%)、四氯乙烯(99.5%) 德国Dr. Ehrenstorfer GmbH公司。实验用油为张家港出入境检验检疫局提供。实验中所用所有玻璃器皿均经过硅烷化处理后烘干使用。
1.2 仪器及其工作条件
CP-3800气相色谱仪(美国Varian公司),配备电子捕获检测器(ECD)。毛细管色谱柱:SPBTM-5(30m×0.25mm×0.25μm)。进样口温度:290℃;柱温:初始温度35℃保持5min,以10℃/min升至80℃,再以30℃/min升至230℃,保持2min;检测器温度:300℃;不分流进样(3min后分流,分流比1:50)。
AUY220型电子天平 日本Shimadzu公司;RH basic 2磁力加热搅拌装置 德国IKA公司;SPME手动进样手柄及100μm聚二甲基硅氧烷(PDMS)、65μm聚二甲基硅氧烷-二乙烯苯(PDMS/DVB)、85μm聚丙烯酸酯(PA)、75μm碳分子筛-聚二甲基硅氧烷(CAR/PDMS)、70μm 聚乙二醇-二乙烯苯(CW/DVB)萃取纤维 美国Supelco公司。
1.3 方法
1.3.1 标准溶液的配制
二氯甲烷、四氯化碳、三氯乙烯、1,1,2-三氯乙烷、四氯乙烯用本底油配成混合标准储备液,质量浓度分别为127.7、117.0、137.1、141.5、153.5mg/mL。临用前将此储备液分两步稀释500倍配成标准中间液。按表1进一步稀释得到混合标准物质的7个质量浓度系列的标准应用液。
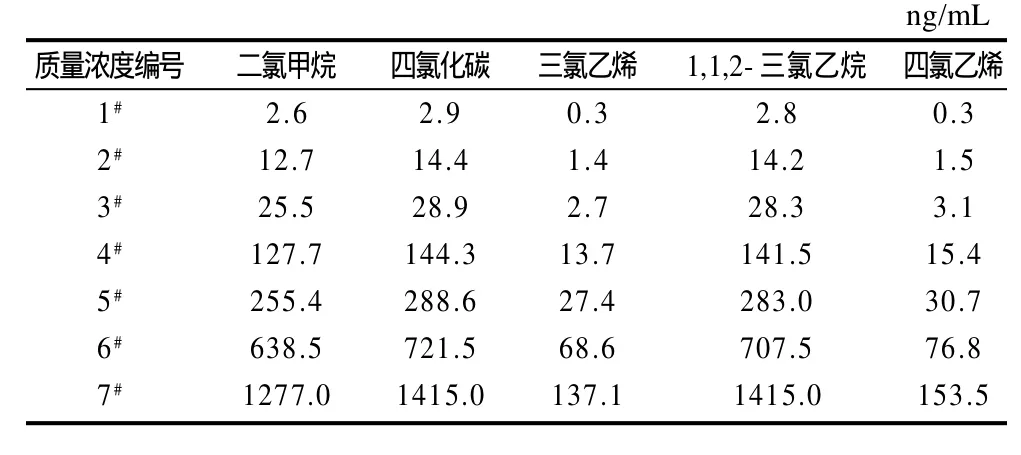
表1 混合标准系列溶液的配制Table 1 Composition of mixed standard working solutions
1.3.2 固相微萃取操作
移取9mL标准溶液(或样品溶液)连同一粒搅拌子放入顶空瓶中,将顶空瓶放入60℃的恒温水浴中保温。将固相微萃取装置穿过包有聚四氟乙烯薄膜的硅橡胶垫恒温搅拌萃取30min后,立即插入气相色谱进样口内290℃解吸3min,进行GC-ECD分析。
2 结果与分析
2.1 HS-SPME条件的优化
采用单因素试验,从萃取纤维、萃取温度和时间、萃取体积、解吸温度和时间以及搅拌速度等几个方面考察各因素对待测物响应值(峰面积)的影响。优化的初始条件为:移取质量浓度5#溶液(表1)5mL于顶空萃取瓶中,将萃取瓶放于80℃恒温水浴中萃取30min后,立即于290℃进样口解吸3min。
2.1.1 溶剂及本底油选择
选择考察了常用的N,N-二甲基乙酰胺和油脂,发现N,N-二甲基乙酰胺配制的标准溶液进行样品加标时,出现很大的溶剂峰,与直接用本底油配制的标准溶液相比,待测物的灵敏度降低。因此选择用本底油作为溶剂进行标准溶液的配制。本底油的选择,考察花生油、玉米油、葵花籽油和精炼大豆油等,将4种食用油各移取5mL于顶空萃取瓶中,选用100μm PDMS萃取纤维在80℃恒温水浴中顶空萃取30min后,按上述升温程序于进样口290℃解吸3min,比较同样条件下的分析图谱,发现大豆油干扰最小,且在待测物出峰时间内均无信号干扰。因此,本研究选择精炼大豆油作为后续实验用本底油。
2.1.2 萃取纤维类型选择

图1 固相微萃取条件对待测成分萃取效率的影响Fig.1 Effect of SPME condition on extraction efficiency
用选择的精炼大豆油配制质量浓度5#溶液(表1)进行萃取纤维的选择。精确移取工作标准液5mL,在80℃恒温水浴中以一定速度进行搅拌,顶空萃取30min,于290℃进样口解吸3min。比较100 μ m PDMS、65 μ m PDMS/DVB、85μm PA、75μm CAR/PDMS、70μm CW/DVB5种萃取纤维在同样条件下对混标的萃取效果(以色谱峰面积表示萃取效率)。由图1a可明显看出,75μm CAR/PDMS萃取纤维所得色谱响应最大,因此选择CAR/PDMS萃取纤维。
2.1.3 萃取温度
萃取温度对SPME具有重要的影响。合适的萃取温度可以加速挥发性物质的平衡过程,提高挥发性有机物的顶空质量浓度,从而提高分析灵敏度;但过高的温度会使分析物在涂层与基质中的分配系数降低,减小涂层对分析物的吸附量。固定萃取体积5mL,以选定的CAR/PDMS萃取纤维在一定的搅拌速度条件下萃取30min,于290℃进样口解吸3min,比较在此条件下,不同的萃取温度对5种待测物的影响。由图1b可知,对于三氯乙烯、1,1,2-三氯乙烷和四氯乙烯,在60℃之前随着萃取温度的升高,萃取量跟着增大,60℃之后萃取量进入平台期。四氯化碳虽然在60℃之后仍然有增大的趋势,但趋势平缓。二氯甲烷由于沸点较低,在较低温度时萃取量较大。综合考虑5种待测物,后续实验采用60℃为最优萃取温度。
2.1.4 萃取时间
萃取时间与待测物的分配系数、物质的扩散速率、样品体积、萃取纤维厚度等有关。因此,在确定萃取温度时,要尽量保证其他条件保持一致。选择萃取体积5mL,萃取温度60℃和75μm CAR/PDMS萃取纤维,及同样的搅拌速度进行萃取,于2 9 0℃进样口解吸3min,绘制5种待测物的时间-峰面积曲线。由结果(图1c)可知,5种待测物基本在30min处达到最佳萃取时间点。
2.1.5 顶空体积
顶空体积可以控制顶空气相中待测物的质量浓度,对方法的灵敏度也是重要的影响条件。本实验中所用的顶空萃取瓶最大盛装体积为15mL,考虑到萃取纤维的浸入深度,在摸索顶空体积时我们选择盛装体积为3、5、7、9mL 4个点进行比较。其他实验条件按照前述的确定参数。5种待测物的顶空体积-峰面积图见图1d。分析可知,随着盛装体积的增加,顶空气相中待测物的浓度也随之增大,如果体积继续增大,顶部空间继续缩小导致无法容纳萃取头长度,故选择盛装体积9mL为最优条件参数。
2.1.6 解吸温度和解吸时间
合适的解吸温度和解吸时间能够保证萃取纤维上的待测物完全解吸,防止纤维涂层上残留造成杂峰的出现,同时还要保证峰形对称、不拖尾等。在其他条件不变的情况下,采用180、210、240、290℃四个解吸温度进行解吸性能实验,210℃以下时均有拖尾峰现象发生。比较240℃和290℃下的图谱,290℃峰形更对称尖锐,解吸也更完全,因此选择290℃为解吸温度。同时考察解吸时间的影响,从1min到5min,经比较,在290℃解吸条件下,时间对峰面积影响很小。为保证解吸完全,本研究选择3min作为解吸时间。
2.1.7 搅拌速度和离子强度
食用油脂有一定的黏稠度,搅拌操作对加快待测物在基质和气相中的分配有一定的帮助。本研究利用磁力加热搅拌装置比较不同搅拌档位(速度)时各待测物的峰面积。结果表明,当油脂盛装体积为9mL时,置第5搅拌档位(速度约为1500r/min)为最理想速度。此时萃取瓶中的油脂能恰当充分的被搅拌均匀。小于此速度时,不能充分搅拌,而大于此速度时,由于搅拌过于剧烈,萃取瓶不能保持稳立状态,不利于顶空萃取的进行。因此,本研究选择该装置的5档进行搅拌。
在研究顶空-固相微萃取时,一般会考虑无机盐离子和pH值对萃取效果的影响[8-9]。相对于水质基体来讲,无机盐离子和溶液pH值能改变物质在水溶液中的溶解度,对萃取效率有一定的影响。但对于油脂基体,用无机盐进行调整时溶解量甚微,而调节pH值又会对油脂的基体造成破坏,因此,本研究没有对离子浓度和pH值与萃取效率的关系进行探讨。
综上所述,油脂中挥发性有机污染物的顶空-固相微萃取优化参数为:萃取体积9mL,以75μm CAR/PDMS在60℃恒温水浴中,IKA RH basic 2装置5档搅拌萃取30min,于290℃解吸3min,进行GC-ECD图谱分析。空白油脂和标准品在选定条件下进样的色谱图见图2。

图2 空白油脂及标准品的GC-ECD色谱图Fig.2 GC-ECD chromatograms of blank oil and standard reference materials
2.2 线性范围
在优化的实验条件下,将标准中间液按表1逐步稀释后进行萃取,同时进行空白操作。以峰面积为纵坐标、相对应的待测物质量浓度为横坐标,计算回归方程和相关系数,以信噪比(RSN)=3计算待测物的检出限,结果列于表2。
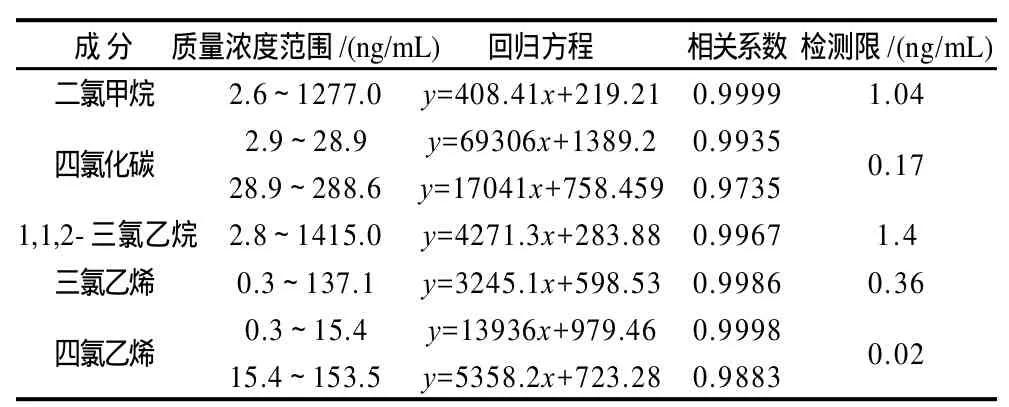
表2 挥发性卤代烃工作曲线范围及回归方程Table 2 Working curve ranges and regression equations of five VHHs
2.3 方法的精密度与加标回收率

表3 挥发性卤代烃峰面积和保留时间的重现性(n=7)Table 3 Repeatability of peak area and retention time of VHHs (n=7)

表4 5种待分析物的加标回收率Table 4 Recovery rates of five analytes
平行配制7份质量浓度4#混合标准液,在优化条件下进行萃取,计算挥发性卤代烃的峰面积和保留时间精密度,结果见表3。同时选择工作曲线低(质量浓度3#)、中(质量浓度5#)、高(质量浓度7#)3个质量浓度进行加标,计算加标回收率,结果列于表4。
2.4 实际样品测定
将所建立的方法应用于4份植物油样品中挥发性卤代烃的测定,将样品用空白油稀释10倍后进行固相微萃取并进样测定。结果发现,样品中有微量的四氯化碳、三氯乙烯和四氯乙烯成分,含量分别为四氯化碳50.8ng/mL、三氯乙烯681.3ng/mL、四氯乙烯419.2ng/mL。但没有检出二氯甲烷和1,1,2-三氯乙烷(图3)。

图3 稀释10倍后食用油脂样品中挥发性卤代烃的GC-ECD色谱图Fig.3 GC-ECD chromatograms of VHHs in edible oil after 10-fold dilution
文献[14]对食用油脂和药物制备中溶剂残留的研究表明,四氯化碳、三氯乙烷、三氯乙烯和四氯乙烯残留检测限分别为0.2、3.0、0.6ng/mL和0.6ng/mL。与之相比较,本研究进一步发展优化了样品处理及联用分析条件,操作更简单,灵敏度更高和检测限更低。由于二氯甲烷、四氯化碳、三氯乙烯、三氯乙烷和四氯乙烯都属于电负性物质,非常适用于GC-ECD检测。另外,相对于GC-MS方法,本方法对仪器要求较低,且灵敏度较好。实际样品的测定结果进一步验证了方法的可行性。
3 结 论
通过实验确立了顶空-固相微萃取-气相色谱(HSSPME-GC)测定进出口油脂中二氯甲烷、四氯化碳、三氯乙烯、三氯乙烷和四氯乙烯等卤代烃的方法,优化了检测条件。与GC-MS分析技术相比,本方法操作更简单,具有高灵敏和更低的检测限。适合于一般检测机构对油脂中含量极低的挥发性有机污染物的检测。本研究为进出口检验机构对油指中挥发性污染物的检测和卫生监督提供了技术支撑。
[1] 周围, 陈艳彬, 韩舜愈. 顶空-气相色谱法测定饮料中14种卤代烃残留量[J].食品科技, 2009, 34(9): 297-300.
[2] 陈建丽, 孙仕萍. 顶空气相色谱法测定饮用水中卤代烃的研究[J]. 中国卫生检验杂志, 2008, 18(9): 1782-1801.
[3] CICCIOLI P, BRANCALEONI E, FRATTONI M, et al. Quantitative determination of volatile organic compounds (VOC) in milk by multiple dynamic headspace extraction and GC-MS[J]. Ann Chim, 2004, 94(9/10): 669-678.
[4] RISTICEVIC S, NIRI V H. Recent developments in solid-phase microextraction[J]. Anal Bioanal Chem, 2009, 393(3): 781-795.
[5] 王波, 周围. 固相微萃取-气相色谱联用测定饮料中残留的10种可挥发性卤代烃[J]. 分析试验室, 2009, 28(7): 87-90.
[6] ARATO S, ITO H, MIYASHITA K, et al. A facile method for the detection of aldehydes in oxidized lipids using solid-phase microextraction fiber and gas chromatograph equipped with a septum-free injector[J]. J Oleo Sci, 2009, 58(1): 17-22.
[7] 刘绍从, 吕刚, 赵好力宝, 等. 固相微萃取-气相色谱法测定食品添加剂中有害有机挥发杂质[J]. 分析试验室, 2006, 25(3): 17-20.
[8] LIU H W, LIU Y T, WU B Z, et al. Process sampling module coupled with purge and trap-GC-FID for in situ auto-monitoring of volatile organic compounds in wastewater[J]. Talanta, 2009, 80(2): 903-908.
[9] GOLFINOPOULOS S K, LEKKAS T D, NIKOLAOU A D. Comparison of methods for determination of volatile organic compounds in drinking water[J]. Chemosphere, 2001, 45(3): 275-284.
[10] LIN W, LI Zhuangjie. Detection and quantification of trace organic contaminants in water using the FT-IR-attenuated total reflectance technique[J]. Anal Chem, 2010, 82(2): 505-515.
[11] ABDURAHMANA R, YIMIT A. Optical waveguide sensor of volatile organic compounds based on PTA thin film[J]. Analytica Chimica Acta,2010, 658(1): 63-67.
[12] AGIUS R, NADULSKI T. Validation of a headspace solid-phase microextraction-GC-MS/MS for the determination of ethyl glucuronide in hair according to forensic guidelines[J]. Forensic Sci Int, 2010, 196(1/2/3): 3-9.
[13] MICHULEC M, WARDENCKI W. Development of headspace solidphase microextraction-gas chromatography method for the determination of solvent residues in edible oils and pharmaceuticals[J]. J Chromatogr A, 2005, 1071(1/2): 119-124.
[14] ZHANG Jian, LI Li, GAO Nianfa, et al. Feature extraction and selection from volatile compounds for analytical classification of Chinese red wines from different varieties[J]. Anal Chim Acta, 2010, 662(2): 137-142.
[15] 李国栋, 孙宗保. 利用响应面法优化HS-SPME镇江香醋香气成分的条件[J]. 中国酿造, 2009(8): 45-48.
[16] LY-VERDU S, ESTEVE-TURRILLAS F A, PASTOR A, et al. Determination of volatile organic compounds in contaminated air using semipermeable membrane devices[J]. Talanta, 2010, 80(5): 2041-2048.
Determination of VHHs in Edible Oils by HS-SPME followed by GC-ECD
ZHAO Hong-yan1,GUO Ying-ying1,LI Lei1,*,YI Xiao-juan2,SUN Jian-gang2,CHEN Jun-yi2
(1. School of Public Health, Nanjing Medical University, Nanjing 210029, China;2. Zhangjiagang Entry-exit Inspection and Quarantine Bureau, Zhangjiagang 215600, China)
Objective: To establish a method for the extraction and determination of five volatile halogenerated hydrocarbons(VHHs) in edible oil by headspace solid-phase microextraction (HS-SPME) and gas chromatography-electron capture detector (GCECD). Methods: Samples were subjected to headspace extraction with 5 types of fiber (Supelco Inc.). Extraction efficiencies of different fibers were compared, and the effects of extraction temperature, extraction time, and solvent volume were investigated. The chromatographic separation was carried out on a capillary column equipped to a gas chromatography system with electron capture detector. Results: CAR/PDMS fiber of 75μm was the selected fiber. After pouring 9 mL of edible oil in a 15 mL vial, the extraction was conducted at the equilibrium temperature of 60 ℃ and extraction time of 30 min. The desorption of fiber was performed at 290℃ for 3 min. The detection limit of the established method ranged from 0.02 (tetrachloroethylene) to 1.4 ng/mL (trichloro ethane).The average recovery rate was in the range of 89%-105% with a relative standard derivation (RSD) of less than 8.5%. Conclusion:This method is simple, practical, and sensitive, which is suitable for the determination of VHHs in edible oil.
edible oil;headspace solid-phase microextraction;volatile halogenerated hydrocarbons;gas chromatography;hyphenated technology
R155.5
A
1002-6630(2011)06-0242-05
2010-05-10
江苏出入境检验检疫局项目(2009KJ34)
赵鸿雁(1978—),女,讲师,硕士,主要从事固相微萃取技术研究。E-mail:redswaning@126.com
*通信作者:李磊(1968—),男,教授,博士,主要从事营养与食品安全研究。E-mail:lilei@njmu.edu.cn

