蛋清肽及肽钙配合物的制备
韩 樱,何 慧*,马芝丽,张文君,李江涛
(华中农业大学食品科学技术学院,湖北 武汉 430070)
蛋清肽及肽钙配合物的制备
韩 樱,何 慧*,马芝丽,张文君,李江涛
(华中农业大学食品科学技术学院,湖北 武汉 430070)
为获得高生物效价的补钙制剂及提高蛋清蛋白的附加值,首先对鸡蛋清进行酶法改性,筛选实验用酶,采用正交试验,分别对酶解条件及肽钙反应条件进行优化,并采用红外光谱法比较反应前后图谱的变化。结果表明:选择先碱性蛋白酶后中性蛋白酶进行双酶酶解,酶解条件为底物质量分数6%、碱性酶酶底比1:100、pH8.0、酶解时间3h;中性酶酶底比1:25、pH7.0、酶解时间3h。制备肽钙配合物最优反应条件为肽钙(CaCl2)质量比2.5:1、pH9.5、底物质量分数4%、温度55℃,在此条件下,可溶性钙含量为21.15mg/L,水解度为8.66%。制备蛋清肽时,使用双酶的水解效果优于单酶,蛋清肽与钙形成了双单齿配合物,其钙质量分数为8.75%。
蛋清肽;肽钙配合物;酶解;制备
我国是世界上最大的蛋品生产国,但目前的禽蛋加工水平较低,技术陈旧,由于我国的某些饮食习惯和一些行业的特殊需求,对蛋黄的需求量较大,如何利用蛋清,并提高其附加值,是值得研究的课题。成熟的蛋白酶酶解技术为蛋清深加工开启了一扇新大门[1]。目前,活性肽是国内外的研究热点,而人们对蛋清活性肽的研究与酪蛋白活性肽相比,还较少。
钙营养不足是当今全球性的健康问题,据有关报道,中国人普遍缺钙,虽然近几年国内补钙产品越来越多,销量也年年增加,可是国民缺钙的状况却没有得到根本的改善,究其原因在于钙的生物利用率不高。因为食物中的植酸、草酸和磷酸等成分在肠道中易与摄入的钙形成不溶性的植酸盐、草酸盐和磷酸盐,导致钙的生物利用率下降。而蛋白质经水解后得到的小肽,能与钙形成可溶性配合物,维持钙在小肠内的溶解状态,增加小肠对钙的吸收及其在体内的蓄积。有研究发现,氨基酸、肽等化合物能与钙形成可溶性配合物,可以阻止小肠内钙的沉淀,从而很好地促进钙吸收。如酪蛋白磷酸肽[2]和卵黄高磷蛋白磷酸肽[3],其肽链中的磷酸丝氨酸残基可以与钙结合形成可溶性复合物。此外,也有研究表明,不含磷酸基团的肽也能与钙结合形成可溶性复合物[4]。
目前关于蛋清肽的生物活性研究主要集中在降血压[5]、抗氧化、增强免疫[1]等方面,而对于肽钙配合物的研究多集中在水产品[6]、动物骨头[7]及卵黄[8]中,对于蛋清肽钙配合物的制备及其促进钙吸收的作用研究目前尚未见报道。本研究以鸡蛋清为原料,通过酶水解制备蛋清肽后再与钙进行络合,旨在制备钙结合率较高的可溶性配合物,为充分利用蛋清资源,并提高其附加值,开发出新的生物利用率高的补钙产品提供依据。
1 材料与方法
1.1 材料与试剂
鸡蛋 市购。
Neutrase中性蛋白酶、Alcalase碱性蛋白酶 丹麦诺维信公司;胃蛋白酶、胰蛋白酶 美国Amresco进口分装;木瓜蛋白酶 广西南宁庞博生物工程有限公司。
无水氯化钙、邻甲酚酞络合酮、8-羟基喹啉、硼酸、乙醇胺、N a O H、9 5%乙醇、溴化钾、乙二胺四乙酸二钠、钙紫红素(均为国产分析纯)。
1.2 仪器与设备
PB-10酸度计 德国赛多利斯股份公司;TDL-5A离心机 上海菲恰尔分析仪器有限公司;UV-2000分光光度计 尤尼科(上海)有限公司;Nexus 470 FT-IR型傅里叶红外光谱仪 美国Nicolet公司;ALPHA 1-4LD真空冷冻干燥机 德国Marin Christ公司。
1.3 方法
1.3.1 单酶法制备蛋清肽
将鸡蛋洗净,打蛋分离蛋清,冷冻干燥后研磨制得蛋清粉。加入不同的酶,在其各自适宜的条件下酶解4h,沸水浴灭酶10min,离心得到上清液。5组酶及其水解实验条件分别为中性蛋白酶(酶底比1:50、pH7.0、50℃水解4h)、碱性蛋白酶(酶底比1:100、pH8.0、55℃水解4h)、胃蛋白酶(酶底比1:50、pH2.0、40℃水解4h)、胰蛋白酶(酶底比1:50、pH7.5、45℃水解4h)、木瓜蛋白酶(酶底比1:50、pH7.0、45℃水解4h)。每组实验重复3次,结果为3次实验的平均值。
1.3.2 双酶法制备蛋清肽
根据单酶实验的结果,设计4组双酶水解实验。先加入一种酶,在其最适条件下水解2 h,沸水浴灭酶10min,再加入第二种酶,在最适条件下再水解2h,沸水浴灭酶10min,离心后制酶解物。每组实验重复3次,结果为3次实验的平均值。
1.3.3 钙结合实验
酶筛选是以可溶性钙结合量和水解度为测定指标,首先,对蛋清水解液进行钙结合实验,参考Sato等[9]的方法,并略做修改:在具塞试管中加入少量5mmol/L CaCl2和过量的20mmol/L磷酸盐缓冲液(pH7.8),再加入一定量的蛋清水解液,置于恒温加热磁力搅拌器中37℃温育2h,取出后8000r/min常温离心10min,采用邻甲酚酞络合酮比色法[10-11]测定上清液中的可溶性钙结合量。
1.3.4 水解度的测定
参见文献[12]。
1.3.5 双酶法制备蛋清肽的正交优化设计
选定底物浓度、第一种酶的酶底比及酶解时间、第二种酶的酶底比及酶解时间5个因素,每个因素确定4个水平,以可溶性钙结合量和水解度为指标,进行L16(45)正交试验,其因素水平表见表1。
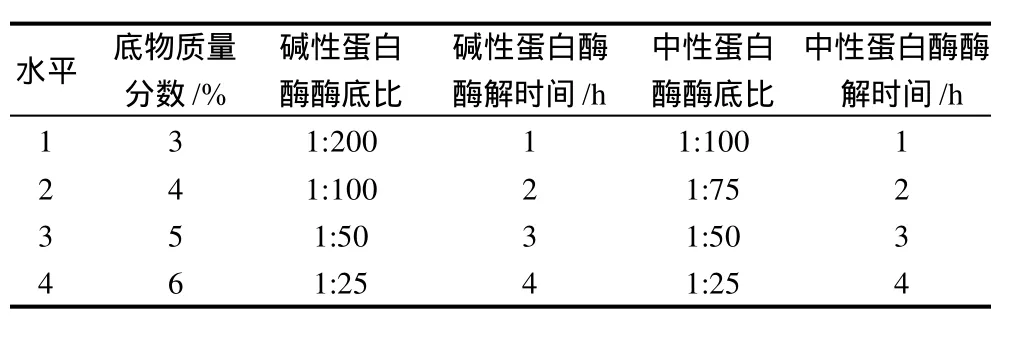
表1 双酶法正交试验设计Table 1 Factors and levels in orthogonal array design for optimizing enzymatic modification of egg white
1.3.6 蛋清肽钙配合物的制备
以上述蛋清水解液为原料,在一定温度下调节pH值,按一定比例加入CaCl2,搅拌反应一段时间后取出,加入乙醇使其体积分数达70%,离心沉淀,乙醇洗涤沉淀数次,55℃烘干或真空冷冻干燥,制得蛋清肽-Ca2+产品。
1.3.7 蛋清肽钙配合物制备的正交设计
选定肽钙质量比、pH值、温度、底物质量分数4个因素,以产物中钙元素的质量分数为测定指标,按L9(34)正交表安排四因素三水平试验(表2),反应时间均为20min。
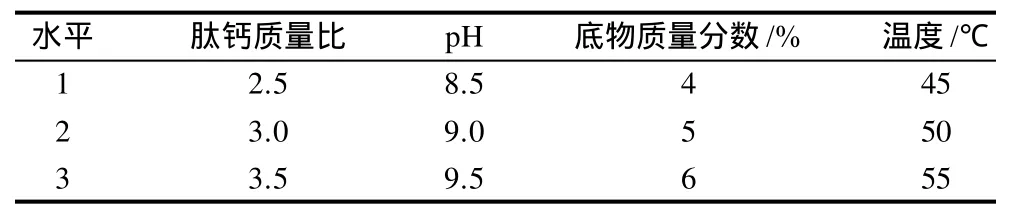
表2 蛋清肽钙配合物制备工艺正交试验因素水平表Table 2 Factors and levels in orthogonal array design for optimizing preparation of calcium-chelating egg white peptide
1.3.8 产物钙质量分数测定
一定质量的产物(已烘干)→溶解(可加酸和适当加热)→定容至25mL→取出一定量,加入掩蔽剂三乙醇胺,加入氢氧化钠调节pH值,用EDTA标液滴定(作3个平行),按下式计算钙质量分数(w)[13-14]:
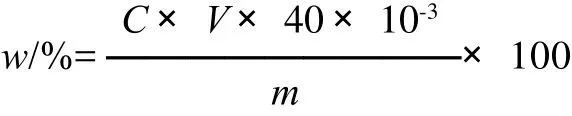
式中:C为标定得EDTA浓度/(mol/L);V为消耗的EDTA体积/mL;40为钙的相对摩尔质量/(g/mol);m为制得的复合物质量/g。
1.3.9 红外光谱法
取蛋清肽及蛋清肽钙配合物各2mg与200mg KBr混合,在红外光下磨成2.5μm的薄片,在30MPa条件下制成透明的KBr薄片。在500~4000cm-1条件下用傅里叶变换红外光谱仪进行定性分析,分别得到其红外光谱图。
2 结果与分析
2.1 5种单酶的酶解比较
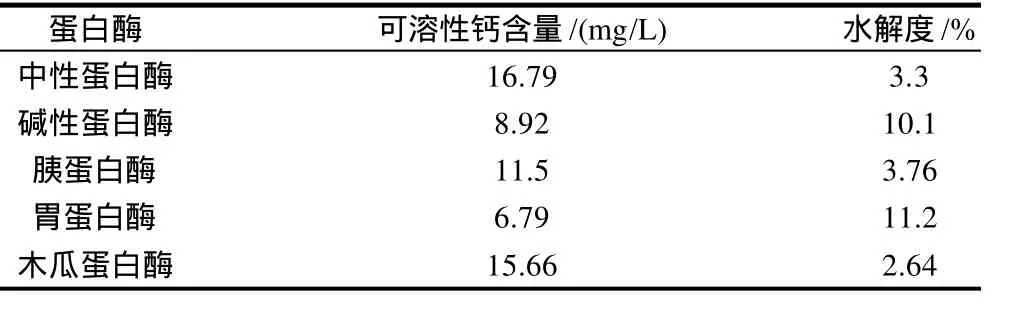
表3 5种单酶的酶解实验比较Table 3 Comparison of egg white hydrolyzed by five kinds of enzymes alone
由表3可知,可溶性钙结合量从高到低依次为中性蛋白酶、木瓜蛋白酶、胰蛋白酶酶解物;水解度由高到低依次为胃蛋白酶、碱性蛋白酶、胰蛋白酶酶解物,没有一种酶的酶解液中可溶性钙结合量和水解度两项指标同时较高,故考虑选择两种酶进行双酶酶解。可溶性钙结合量是优先考虑的指标,所以选择中性蛋白酶或木瓜蛋白酶进行酶解,以获得较高的可溶性钙结合量,但这两种酶的水解度均很低。这与它们的酶切位点相关,酶的专一性使得它们只能作用于特定的位点,不能充分打开蛋清蛋白的肽链,因而水解度很低,故可以考虑采用双酶复合水解的方法来改善。
2.2 4组双酶的酶解效果比较
从酶解肽需与钙离子结合的角度考虑,若肽段太长,即水解不充分,由于空间位阻效应会影响其与钙的结合,因此要提高蛋清肽的水解度;而经胃蛋白酶水解后较碱性蛋白酶的可溶性钙含量低,另一方面胃蛋白酶是动物性蛋白酶,较碱性蛋白酶要贵的多,所以将水解度较高的碱性蛋白酶分别与中性蛋白酶、木瓜蛋白酶(表3)进行两两组合的双酶实验(表4)。先碱性蛋白酶后木瓜蛋白酶处理,其效果与先碱性蛋白酶后中性蛋白酶处理差别不大,考虑到商业化酶制剂中中性蛋白酶及碱性蛋白酶具有较好的质量和稳定性,故选择先碱性蛋白酶,后中性蛋白酶的组合进行双酶水解。
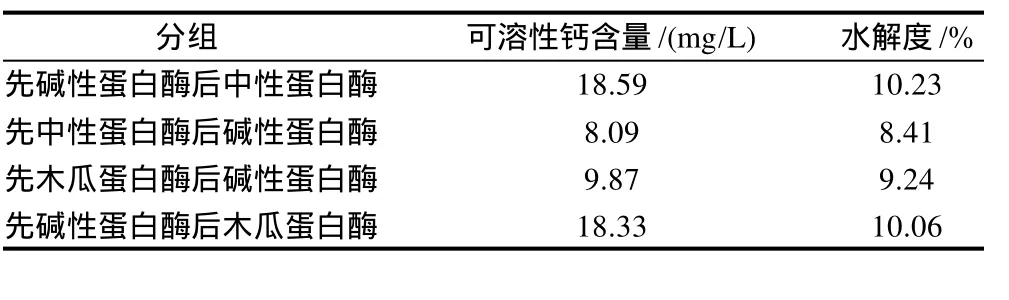
表4 4组双酶的酶解比较结果Table 4 Comparison of egg white hydrolyzed by four dual enzyme combination
2.3 双酶法(先碱性蛋白酶后中性蛋白酶)酶解的正交试验
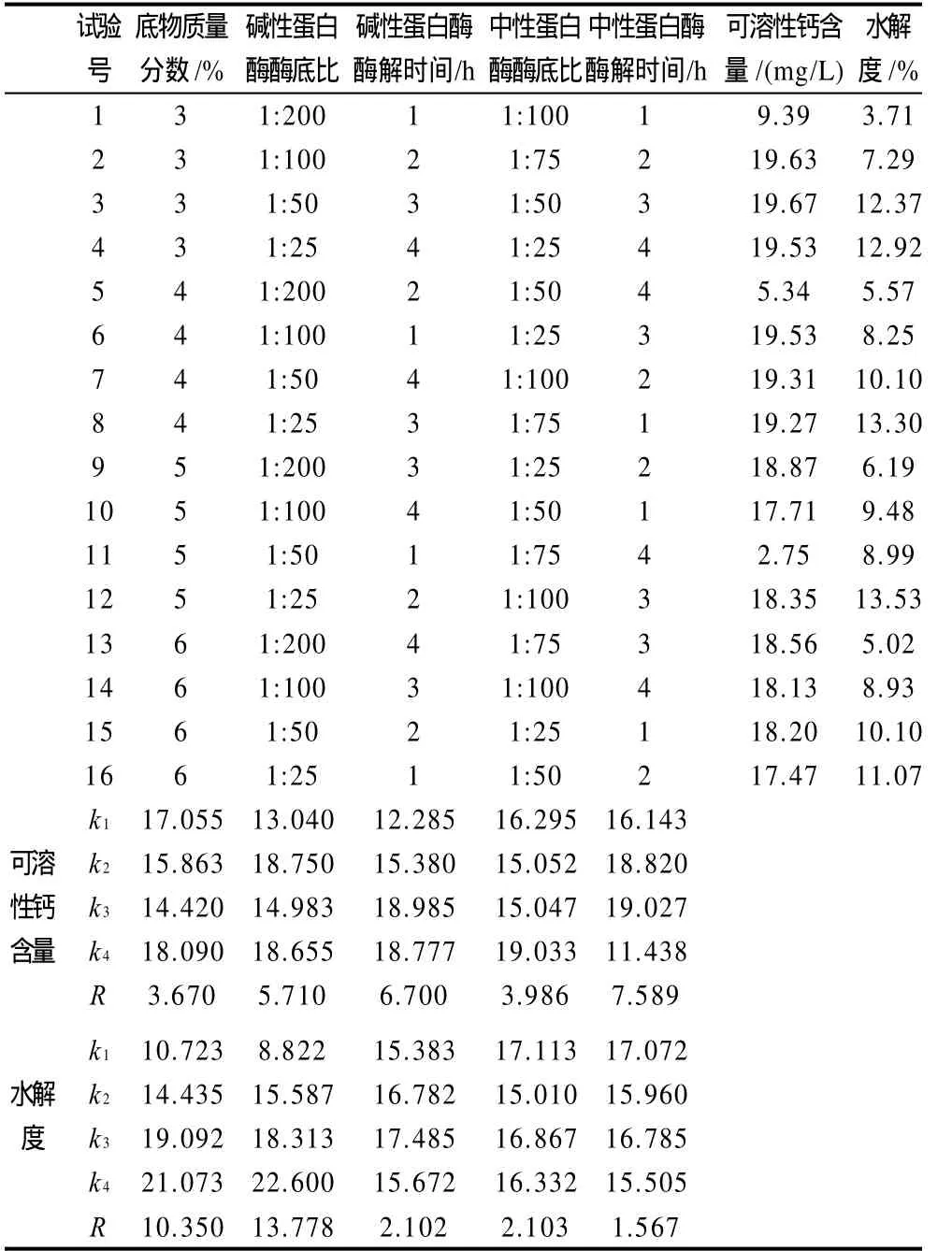
表5 双酶酶解正交试验设计结果Table 5 Scheme and experimental results of the first orthogonal array design
采用极差分析法[15]对正交结果进行分析,由表5可以看出,各因素对可溶性钙含量的影响大小顺序为中性酶酶解时间>碱性酶酶解时间>碱性蛋白酶[E]/[S]>中性蛋白酶[E]/[S]>底物质量分数,即影响可溶性钙含量的主要因素是两种酶的酶解时间,其次才是碱性蛋白酶的酶底比。由此得到的最佳酶解条件为底物质量分数6%、碱性蛋白酶酶底质量比1:100、温度55℃、pH8.0条件下水解时间3h;再以酶底质量比1:25加入中性蛋白酶,控制温度50℃、pH7.0水解时间3h。在此最佳酶解条件下制备蛋清肽,实验重复进行3次,测得其可溶性钙含量为21.15mg/L,水解度为8.66%;Jung等[16]用酶解法研究发现质量浓度250mg/L的鳕鱼骨肽溶液中可得28.78mg/L可溶性钙;本研究可溶性钙结合量与鳕鱼骨肽的此指标接近。
2.4 蛋清肽钙配合物制备的正交试验

表6 蛋清肽钙复合物制备的正交试验设计及结果Table 6 Scheme and experimental results of the second orthogonal array design
由表6可知,影响蛋清肽钙配合物制备的各因素的主次顺序为pH值>底物质量分数>温度>肽钙(CaCl2)质量比;其最优水平组合为pH9.5、底物质量分数4%、温度55℃、肽钙(CaCl2)质量比2.5:1。此最优组合未在正交组合内,经过3次验证实验,此条件下制得的肽钙配合物中的钙质量分数可以达到8.75%。而王飞等[8]采用原子吸收法对3种不同酶系组合制备的卵黄高磷蛋白磷酸肽钙样品进行测定,测得其钙质量分数分别为8.446%、10.35%与11.375%;郭艳[17]利用酸水解法处理米渣蛋白制备得到的氨基酸钙螯合物,其钙质量分数为8.83%,本研究获得的蛋清肽钙配合物的钙质量分数与之接近。
2.5 红外结构分析
比较图1、2的变化,可以发现,3421cm-1处的吸收峰变成了3402、3288cm-1的双峰,推测是肽链或侧链上的NH3+丢失1个质子后成为-NH2,所以出现双峰,-NH2可与Ca2+配位。比较反应前后的图谱发现,反应后在1543cm-1处新出现了一个较强吸收峰,且在1410cm-1处也有峰,这与羧酸成盐后的变化相一致,1543cm-1为羧酸根的反对称伸缩振动,1410cm-1为羧酸根的对称伸缩振动,羧酸根的负离子处的氧具有配位能力。根据文献[18]报道,没有与金属离子配位的羧酸根离子的Δv为160cm-1左右,若配合物中的Δv与游离时的Δv差不多,则认为是双单齿形式配位。在本实验中肽钙反应后图谱中羧酸根离子的反对称伸缩振动的峰和对称伸缩振动峰Δv=133cm-1,则可认为钙与羧基以双单齿形式配位。
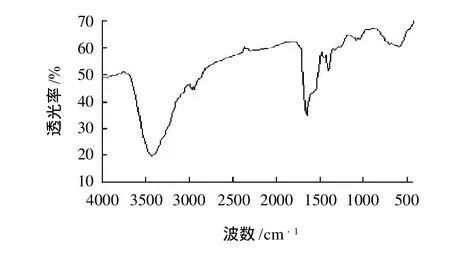
图1 蛋清肽的红外图谱Fig.1 IR spectrum of egg white peptide
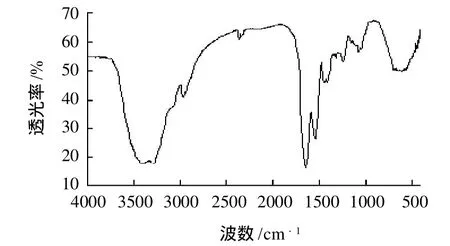
图2 蛋清肽钙配合物的红外图谱Fig.2 IR spectrum of calcium-chelating egg white peptide
3 结论与讨论
采用先碱性蛋白酶再用中性蛋白酶的双酶法水解制备有较高钙结合能力的蛋清肽,可以与钙生成可溶物,其可溶性钙结合量为21.15mg/L;该肽与钙的络合反应最佳条件为肽钙(CaCl2)质量比2.5:1、pH9.5、底物质量分数4%、水浴温度55℃搅拌反应20min,制得钙质量分数为8.75%的双单齿蛋清肽钙配合物。
制备蛋清肽时,主要从生物利用率的角度考虑,以可溶性钙结合量来优化制备条件。小肠中有一些磷酸根离子、草酸根离子等易与钙形成不溶物的阴离子,从而影响钙的吸收利用。这种方法基于先让钙与磷酸盐形成不溶物,再加入蛋清肽样品,将其中的钙夺取,使之生成可溶性的肽钙配合物,此时钙呈溶解状态,再用邻甲酚酞比色的方法来测这部分可溶性钙的含量,这反映了蛋清肽与钙的结合能力。肽钙配合物作为补钙剂的优点在于:Ca2+在小肠pH值条件下易生成不溶物,降低了补钙剂的生物可利用率,而络合钙的在肠道pH值条件下仍为可溶物,其生物可利用率提高;蛋清肽同时是营养全面且易吸收的营养补充剂;蛋清肽还具有抗氧化等诸多生理调节作用。
制备蛋清肽钙配合物时,肽与钙直接反应,制备时控制在碱性条件,使之络合钙量大大提高,与已报道的卵黄高磷蛋白的钙质量分数(8.446%)[8]相当。
[1] 田刚. 酶解鸡蛋清小(寡)肽混合物对小鼠免疫功能的影响及其机理研究[D]. 雅安: 四川农业大学, 2006.
[2] SATO R, NOGUCHI T, NAITO H. Casein phosphopeptide (CPP)enhances calcium absorption from the ligated segment of rat small intestine[J]. J Nutr Sci Vitaminol, 1986, 32(1): 67-76.
[3] JIANG Bo, MINE Y. Phosphopeptides derived from hen egg yolk phosvitin: effect of molecular size on calcium-binding properties[J].Biosci Biotechnol Biochem, 2001, 65(5): 1187-1190.
[4] DAENGPROK W, GARNJAGOONCHORN W, NAIVIKUL O.Chicken eggshell matrix proteins enhance calcium transport in the human intestinal epithelial cells Caco-2[J]. Agric Food Chem, 2003, 51(20): 6056-6061.
[5] MANSO M A, MIGUEL M, EVEN J, et al. Effect of the long-term intake of an egg white hydrolysate on the oxidative status and blood lipid profile of spontaneously hypertensive rats[J]. Food Chemistry, 2008,109(2): 361-367.
[6] 杨燊, 邓尚贵, 秦小明. 低值鱼蛋白多肽-钙螯合物的制备和抗氧化、抗菌活性研究[J]. 食品科学, 2008, 29(1): 202-206.
[7] 刘玉花, 马俪珍, 孔宝华, 等. 羊骨胶原钙螯合肽酶解工艺的研究[J].肉类研究, 2008, 110(4): 26-29.
[8] 王飞, 刘静波, 林松毅, 等. 卵黄高磷蛋白磷酸肽-钙对受试小鼠钙表观吸收率的影响[J]. 食品科学, 2008, 29(12): 654-657.
[9] SATO R, SHINDO M, GUNSHIN H, et al. Characterization of phosphopeptide derived from bovineβ-casein: an inhibitor to intraintestinal precipitation of calcium phosphate[J]. Biochim Biophys Acta,1991, 1077(3): 413-415.
[10] 郝俊, 赵瑞民, 陈雪莲, 等. 人奶、发、尿样中钙的分光光度测定法[J]. 营养学报, 1986, 8(1): 75-80.
[11] 傅启高, 各秋江. 用邻甲酚酞比色法测定饲料中钙含量的研究[J]. 动物营养学报, 1996, 8(3): 25-30.
[12] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994,15(11): 65-67.
[13] 林培生, 郭鹏凯. 络合法测定液体钙软胶囊钙含量[J]. 食品科学,2005, 15(2) : 35-36.
[14] GB/T 5009.92—2003 食品中钙的测定[S]. 北京: 中国标准出版社.
[15] 林维宣. 试验设计方法[M]. 大连: 大连海事大学出版社, 1995: 134-138.
[16] JUNG W K, KIM S K. Calcium-binding peptide derived from pepsinolytic hydrolysates of hoki (Johnius belengerii) frame[J]. Eur Food Res Technol, 2007, 224(6): 763-767.
[17] 郭艳. 水解米渣蛋白及制备氨基酸螯合钙的工艺研究[D]. 成都: 四川大学, 2006.
[18] 孙为银. 配位化学[M]. 北京: 化学工业出版社, 2004: 50.
Preparation of Calcium-chelating Egg White Peptide
HAN Ying,HE Hui*,MA Zhi-li,ZHANG Wen-jun,LI Jiang-tao
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In order to develop a kind of calcium supplement with high bioavailability, and improve added value of egg white protein, egg white was enzymatically modified and then chelated with calcium. Enzyme screening for the modification of egg white showed that the optimum hydrolysis mode for egg white was sequential hydrolysis with alcalase and neutrase. After this,process optimization for the enzymatic modification of egg white and chelating reaction between modified egg white and calcium was conducted using orthogonal array design. The optimal conditions for the stepwise double enzymatic hydrolysis of egg white were substrate concentration of 6%, alcalase/substrate ratio of 1:100, hydrolysis pH of 8.0 and hydrolysis time of 3 h; neutrase/substrate ratio of 1:25, hydrolysis pH of 7.0 and hydrolysis time of 3 h. In addition, the optimal preparation conditions for calcium-chelating egg white peptide were the ratio between peptide and CaCl2 (m/m) of 2.5:1, reaction pH of 9.5, substrate concentration of 4%, and reaction temperature of 55 ℃. Under the optimal conditions, the yield of soluble calcium and degree of hydrolysis were 21.15 mg/L and 8.66%, respectively. Therefore, sequential dual-enzyme hydrolysis method is better than single-enzyme hydrolysis method for the preparation of egg white peptide. The obtained egg white peptides can form a kind of bridging bidentate complex with calcium. The calcium content in the calcium-chelating egg white peptide was up to 8.75%.
egg white peptide;calcium-chelating egg white protein;enzymolysis;preparation
TS253.9
A
1002-6630(2011)06-0110-05
2010-06-11
韩樱(1986—),女,硕士研究生,研究方向为食品化学。E-mail:kekebeibeihy@126.com
*通信作者:何慧(1960—),女,教授,硕士,研究方向为食品科学。E-mail:hehui@mail.hzau.edu.cn

