加压低温条件下三元体系相平衡研究
罗 鹏,高长虹,曹吉林
(河北工业大学 化工学院,天津 300130)
0 引言
浓度高于80%的过氧化氢水溶液在电子、航天等领域极富应用前景且需求旺盛.蒽醌法[1-2]是目前生产过氧化氢的主要方法,该法生产出来的产品浓度规格一般为27.5%.高纯高浓过氧化氢的制取一般采用萃取、树脂吸附、膜分离、精馏、重结晶或几种方法的集成,从而最终得到高纯高浓产品.由于过氧化氢具有不稳定、易分解和易爆炸等特性,所以采用普通减压法蒸馏浓缩过氧化氢具有很大的危险性,且该方法过氧化氢分解损失量大,而采用上述其他方法则成本、物耗能耗高[3].因此,开发一种低温条件下安全高效节能的浓缩新型分离技术使H2O2-H2O体系中过氧化氢能够浓缩,对提纯过氧化氢具有实际意义.
以气体水合物为基础的分离技术,具有水合物的生成条件温和,能耗低,对环境无害等优点,该技术已经在天然气贮存和运输[4]、二氧化碳深海贮藏[5]、空调水合物蓄冷[6]、海水淡化[7]及生物工程和生物技术[8]等领域得到了应用研究.水合物形成的液固相平衡数据,是开发新型分离技术的基础.目前以相平衡为基础的水合物生成条件的预测模型文献比较多[9-10],但关于气体水合物的母液夹带量多少没有明确的报道.有鉴于此,本文以低浓度过氧化氢溶液的浓缩为背景,进行了加压低温条件下H2O2-H2O-C3H8体系的相平衡研究.
1 实验
1.1 使用试剂
实验所用30%双氧水、浓硫酸、高锰酸钾、表面活性剂十二烷基硫酸钠均为分析纯;丙烷的纯度是99%;实验所用水为去离子水.
1.2 实验装置
实验装置如图1所示,主要包括透明反应釜、低温恒温水浴、气瓶、加压泵、温度与压力测量仪表和液相采集系统等.透明反应釜是一石英玻璃制高压夹套反应器,最大工作压力1.6MPa,使用温度为 15~100℃.反应器内的温度由其夹套内循环恒温水浴的冷却介质控制,恒温水浴的工作温度范围为 20~150℃,乙二醇水溶液为水浴的循环冷却介质,以保证实验所需的低温环境.实验温度由安装在反应釜内的Pt100铂电阻温度器测量,反应釜中的压力由0.25级精密压力表测定,量程为1.0 MPa.透明反应釜的上部设有进气口、出气口和进料口,下部设有液体取样口.
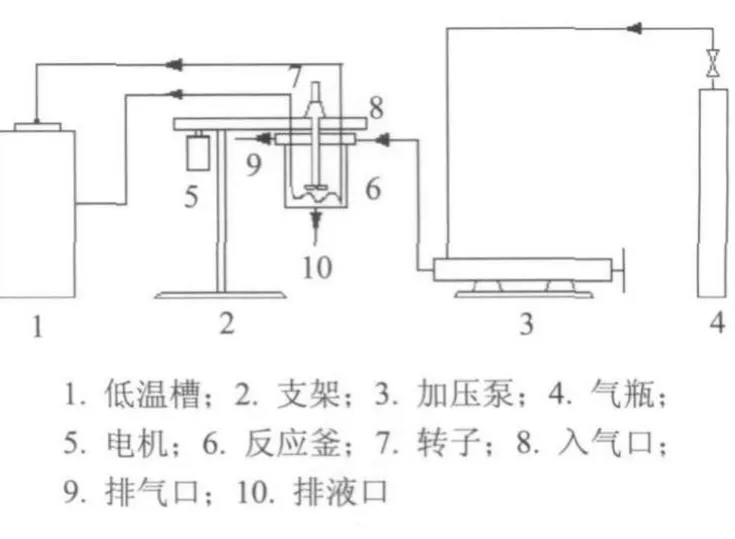
图1 实验装置Fig.1 Experimentalapparatus
1.3 实验方法
1.3.1 实验设备精度检测
表1为纯水-丙烷二元体系生成气体水合物平衡压力的实验数据与文献数据对比[9],可以看出测定值与文献值相接近,说明利用本实验装置测定相平衡数据精度是可行的.
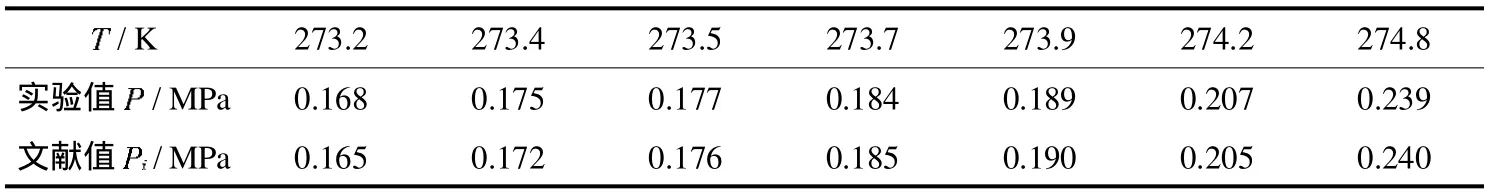
表1 C3H8气体水合物平衡温度-压力表Tab.1 The equilibrium temperature-pressureof C3H8 hydrate
1.3.2 测定相平衡压力
实验时,先配置好一定浓度的过氧化氢水溶液,其后将经过精确计量的该浓度过氧化氢水溶液倒入反应釜中,通过低温恒温槽控制体系温度达到实验温度,然后通入C3H8置换釜内气体后,关闭出气管道的阀门,进行密闭加压,并开动搅拌浆对入料进行持续搅拌.当大量水合物晶体生成后,保持系统压力不变,使体系稳定4~6h.若压力稳定4~6h后水合物晶体量没有发生变化,则此时体系压力即为该温度下水合物生成的平衡压力.本实验测定中,最小的压力调整幅度为0.005MPa.固定温度,改变进样时过氧化氢浓度,重复上述步骤,即可得不同过氧化氢浓度下水合物生成的平衡温度和压力数据.改变温度,重复上述步骤,即可得不同温度下的生成水合物的平衡压力.
1.3.3 测定相平衡组成
在平衡温度和压力条件下,当体系中形成水合物达到相平衡时,开启高压釜液相取样阀,一边取出液相一边用人工泵加压保持釜内压力不变,直到从釜内流不出液体为止,此时通过观察透明反应釜内全为湿固相,记录取出液相量,并进行化学分析.液相取样完成后,降低压力将釜内使湿固相全部分解为液相,然后全部取出进行化学分析.
1.3.4 含量测定
过氧化氢含量分析采用的是KMnO4标准溶液滴定法,水含量的测定采用的是差减法.
2 实验结果与讨论
2.1 体系相平衡液固相组成分析
表2为含表面活性剂的H2O-H2O2-C3H8三元体系相平衡数据.从表中可以看出液相中过氧化氢含量较进料中过氧化氢含量有所增加,而固相中过氧化氢含量减少;笼型化合物的平衡压力与形成的固相量无关;形成气体笼型化合物的平衡压力随温度升高而升高,随液相过氧化氢含量的增加而增加.从温度的角度进行考量,可以看出不同温度同一压力下,平衡条件下H2O2浓度随温度的升高而降低,而不同温度同一H2O2浓度下,平衡压力随温度的升高而升高.
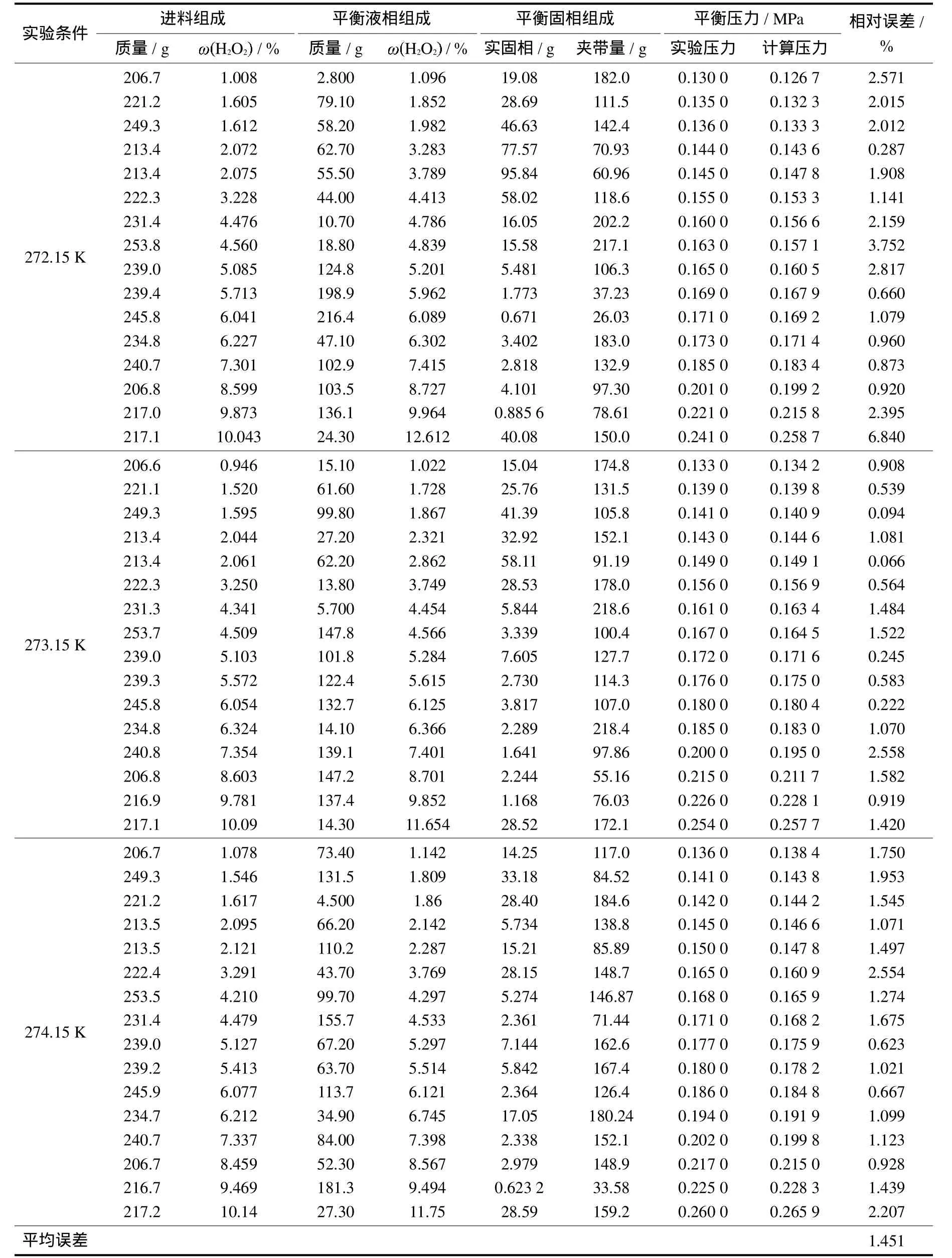
表2 H2O-H2O2-C3H8三元体系相平衡数据(含表面活性剂)Tab.2 The phase equilibrium dataof thequaternary system H2O-H2O2-C3H8(include surfacants)
2.2 H2O-H2O2-C3H8三元体系相平衡压力的关联计算
水合物形成条件预测的热力学模型主要有以经典统计热力学为基础的van derWaals和Platteeuw模型[12]以及其改进模型[13-14].Chen和Guo基于水合物生成机制而提出的新水合物模型[15],与其他基于等温吸附原理建立的水合物热力学模型相比,该模型计算精度较高,因此,本文依据该水合物模型对所研究体系进行相平衡压力进行计算.
利用Chen-Guo模型对H2O-H2O2-C3H8三元体系水合物生成条件进行计算时,本文做了以下两点假设:1)忽略了C3H8气体在水中的溶解;2)由于H2O、H2O2和尿素的蒸汽压在实验条件下很低,气相为纯C3H8气体.模型计算时水的活度采用UNIFAC方程计算,气相C3H8逸度采用SRK方程计算.
利用表2实验测定的平衡液相的组成、平衡温度和平衡压力,依据Chen-Guo模型,应用数学关联的方法,采用1stopt数学优化软件及matlab数值计算可以拟合得到Chen-Guo模型中.
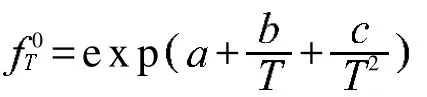
由表2中的数据可以算出,Chen-Guo模型计算的平衡压力平均误差为1.451%,与实验所测得平衡压力值非常接近,说明模型有较好的计算精度.
3 结论
1)对加压低温条件下质量分数在10%以下H2O-H2O2-C3H8三元体系形成气体笼型化合物进行了相平衡研究,得出形成气体笼型化合物的平衡压力随温度升高而升高,随液相过氧化氢含量的增加而增大.
2)Chen-Guo模型对H2O-H2O2-C3H8三元体系形成水合物的相平衡压力的计算值与实验值吻合良好,误差基本保持在5%以内.
[1]王胜年,王树东,吴迪镛.蒽醌法过氧化氢生产氢化催化剂研究进展 [J].工业催化,2000,8(2):11-14.
[2]丁彤.蒽醌法生产双氧水氢化催化剂的研究 [D].天津:天津大学,2002.
[3]陈四海,龙祺,张坤林,等.高纯过氧化氢的生产及应用 [J].化工进展,2003(10):1122-1125.
[4]孙志高,樊栓狮,郭开华,等.气体水合物储存天然气技术 [J].天然气工业,2002(5):87-90.
[5]Sun Chang-Yu.Experimentaland simulationofsingleequilibrium stageseparationof(methane+hydrogen)m ixturesvia form inghydrate[J].Fluid Phase Equilibria,2007,6:85-91.
[6]陈晶贵,樊栓狮,梁德青.气体水合物蓄冷技术研究进展 [J].化工进展,2003(9):942-945.
[7]Chatti,Imen Delahaye,Anthony Fournaison,etal.Benefits and drawbacksof clathrate hydrates:a review of their areasof interest[J].Energy Conversion and Management,2005,46(9-10):1333-1343.
[8]Nguyen H, Philips JB, John V T.Clathratehydrate formation in reversedm icellar solutions[J].JPhysChem,1989,93:8123-8126.
[9]Claudio P,Ribeiro Jr,Paulo L C Lage.Modelling of hydrate formation kinetics:state-of-the-artand future ditections[J].Chem ical Engineering Science,2008,63:2007-2034.
[10]Hiroshi Inomata,Norihiko Nakabayashi,Shozaburo Saito.Phaseequilibrium calculationw ith a local compositionmodelbased on Lennard-Jones potential[J].Fluid Phase Equilibria,1996,125:13-20.
[11]KubotaH,Shimizu K,Tanaka Y,etal.Thermodynam ic propertiesof of R13(CClF3),R23(CHF3),R152a(C2H4F2),and propanehydrates for desalination of seawater[J].JChem Eng Japan,1984,17:423-429.
[12]Van derWaals JH ,Platteeuw J.Clathrate solutions[J].Adv Chem Phys,1959, 2:1-57.
[13]ParrishW R,Prausnitz JM.Dissociation pressuresof gashydrates formed by gasm ixtures[J].Ind Eng Chem Des, 1972,11:26-35.
[14]John V T,HolderG.Langmuir constants for sphericaland linearmolecules in clathratehydrates.Validity of the cell theory[J]. JPhys Chem,1985,89:3279-3285.
[15]Guang-Jin Chen,Tian-M in Guo.Thermodynamicmodelingofhydrate formation based onnew concepts[J].Fluid Phase Equilibria,1996,122:43-65.
[16]Jeffery B K lauda,Stanley ISandler.Phasebehaviorof clathratehydrates:amodel for singleandmultiplegas componenthydrates[J].Chem ical Engineering Science,2003,58:27-41.

