208例手术切除的ⅢA-N2期非小细胞肺癌患者的生存分析*
林勇斌,梁 颖,李明毅,林 鹏,傅剑华,张兰军,龙 浩,王思愚,曾灿光,戎铁华
(1.中山大学肿瘤防治中心胸科,广州510060;2.中山大学肿瘤防治中心内科,广州510060;3.江门市中心医院肿瘤科,广东江门529000)
肺癌是最常见的恶性肿瘤之一,发病率和病死率在全球呈上升趋势[1]。根据国际抗癌联盟 UICC97分期[2],除了T3N1M0期之外,ⅢA期的特点是原发的非小细胞肺癌(nonsmall cell lung cancer,NSCLC)伴有同侧纵膈淋巴结转移,即N2。Mountain报告[3]的在 5 317例 NSCLC中,ⅢA期占全部NSCLC的7.5%,5年生存率为23%。中山大学肿瘤医院1 757例的手术肺癌病例中[4],ⅢA期患者有617例,占34.9%,5年生存率为14.7%。本研究回顾性地分析208例非小细胞肺癌根治术后病理分期为ⅢA期N2患者的临床特征、病理及治疗,分析各因素与生存的关系,以了解影响其预后的因素。
1 资料与方法
1.1 一般资料 2000年1月至2004年12月中山大学肿瘤防治中心收治的共208例ⅢA期-N2的NSCLC患者纳入本研究。病例入选标准:(1)按UICC 97年分期标准[2],分期为ⅢA期-N2的患者;(2)病理检查确诊NSCLC;(3)既往未患其他恶性肿瘤;(4)手术前接受胸部 CT扫描,脑 CT、磁共振成像(magnetic resonance imaging,MRI)、腹部CT或B超检查排除脑、肝、肾上腺转移,骨痛患者行发射型计算机断层(emission computerized tomography,ECT)检查排除骨转移;(5)术前未接受放疗、化疗等抗肿瘤治疗;(6)接受根治性手术及肺门纵膈淋巴结清扫,无肿瘤或淋巴结残留、胸膜播散、支气管残端镜下见癌、术中置银夹标记等;(7)术后随访至死亡或至少3年。本组将完全切除肿瘤所在肺叶并清扫肺门及纵隔淋巴结定义为根治性切除。根据肺癌纵隔淋巴结分布图[3],将纵隔淋巴结分为3区:(1)上纵隔区(1~4组);(2)主动脉区(5~6组);(3)下纵隔区(7~9组)。纵隔淋巴结转移的程度分为:单区域(L1)、2个区域(L2)及3个区域转移(L3)。
1.2 患者随访方法 术后患者常规每3个月复查1次胸片、腹部B超,每半年复查1次胸部CT,每年复查1次脑部M RI或者CT,有症状者立即予相关检查。生存时间按天计算,对死亡患者,生存时间为手术日期至患者死亡日期的天数;对生存患者,生存时间为手术日期至最后一次随访日期的天数。所有患者随诊截止时间为2009年12月31日。
1.3 统计学处理 采用SPSS15.0统计软件包进行数据处理。用寿命表和Kaplan-Meier法计算生存率、中位生存期,绘制生存曲线。比较检验应用Log Rank检验;用Cox比例风险模型进行多因素分析。P<0.05(双侧检验)为差异有统计学意义。生存患者和非肿瘤原因导致的死亡患者按删失值处理。
2 结 果
2.1 208例手术切除的ⅢA-N2期NSCLC患者随访结果208例手术切除的ⅢA-N2期NSCLC患者随访至2009年12月31日或死亡,随访期为 19~3 198 d,中位随访期为769 d。随访期间有52例患者仍然生存,失访19例,随访率为90.9%。全组患者的中位生存期为 769 d,1、2、3、4、5年的累计生存率分别为80.1%、55.2%、36.6%、29.2%和20.9%。
2.2 患者一般特征及其与预后的关系 见表1。
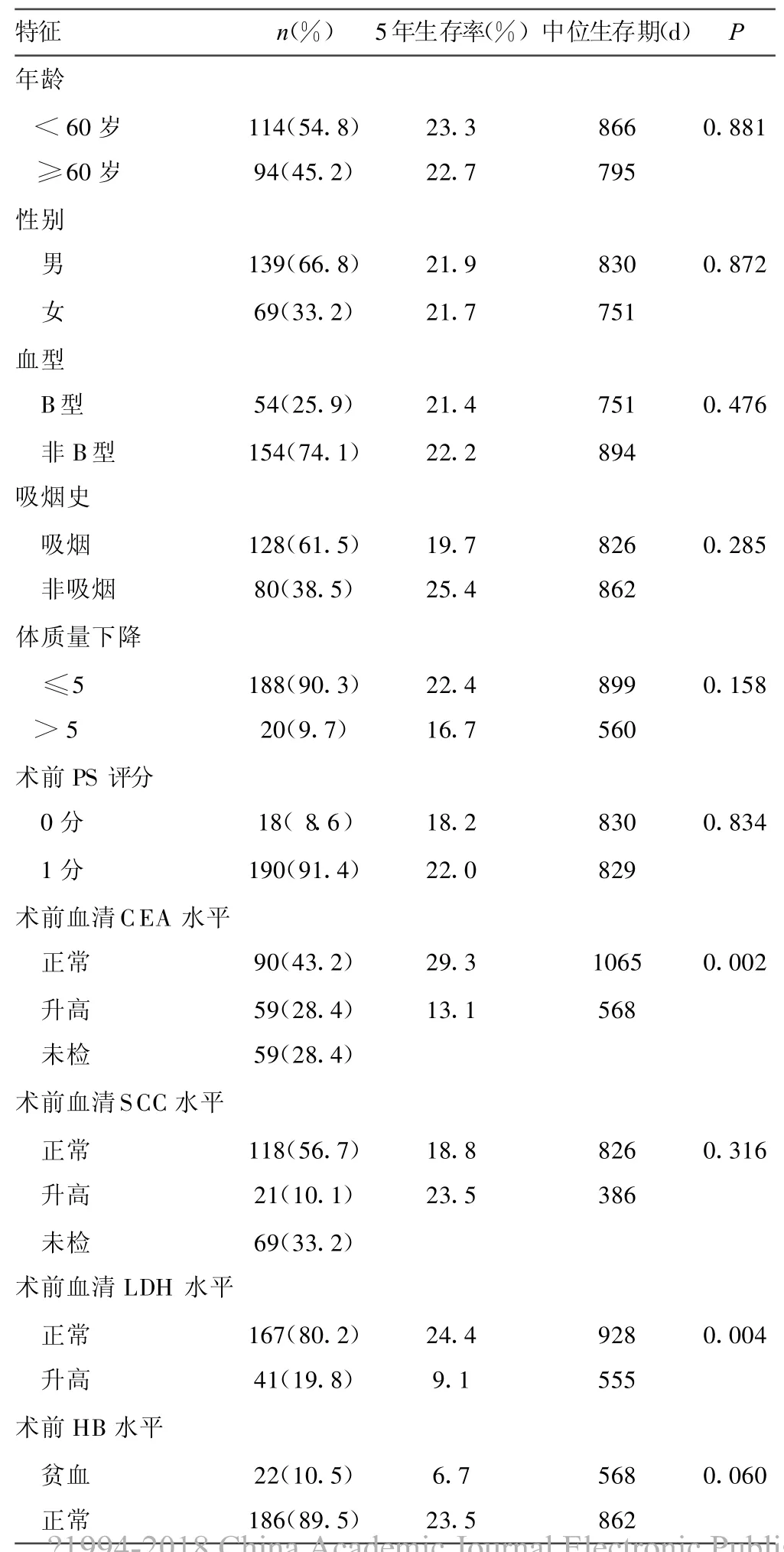
表1 208例患者的临床特征单因素生存分析
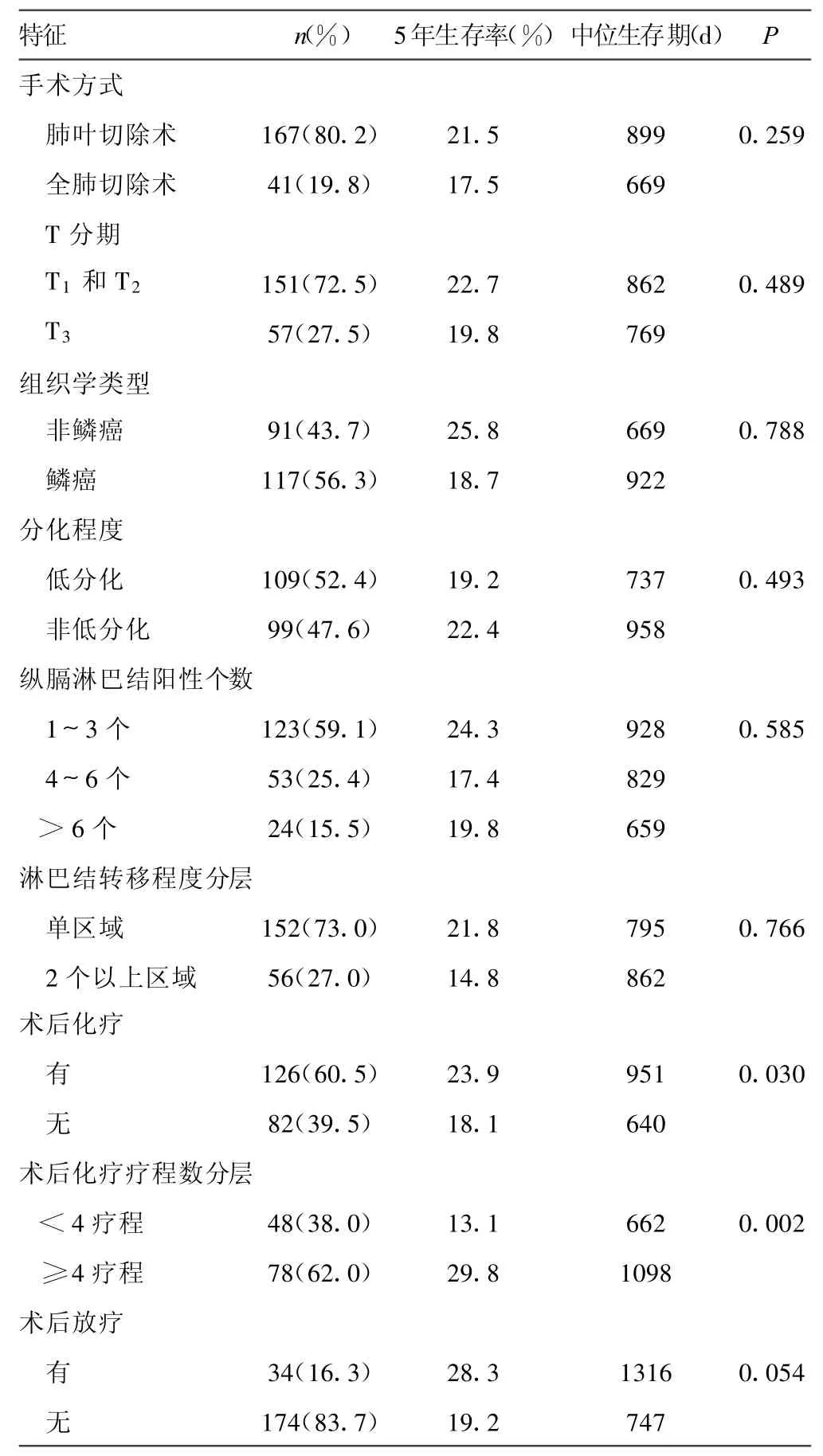
续表1 208例患者的临床特征单因素生存分析
2.3 Cox多因素分析影响全组患者预后的相关临床因素 进一步将以上单因素分析中发现的与预后相关的6个指标即:年龄、术前血清CEA、LDH,术前是否有贫血,术后是否行辅助放、化疗引入Cox预后多因素回归分析。本组发现术前血清CEA、LDH水平,术后是否行辅助放、化疗是影响预后的独立因素(见表2)。
3 讨 论
在本组资料中,全组患者的中位生存期为769 d,5年累计生存率为20.9%,与国外文献报道相近[3],反映了本组资料具有较好的抽样代表性。
在早期可切除的NSCLC的综合治疗上,很多学者尝试通过术后辅助化疗来提高可切除的 NSCLC患者的生存率。IALT研究[5]和 ANITA(the adjuvant navelbine international trialist association)研究[6]均证明辅助化疗显著提高ⅢA期术后患者的生存率。LACE(lung adjuvant cisplatin evaluation)荟萃分析共纳入4 584例NSCLC患者[7],显示含顺铂的术后化疗可以改善NSCLC患者的生存率,5年生存率绝对获益5.4%,Ⅱ、Ⅲ期NSCLC患者获益更多。以上临床研究确定了术后辅助化疗的地位,也与本研究得出术后辅助化疗可改善总生存率的结论相一致。临床上关于术后的化疗周期数一直存在不同的看法。Socinski等[8]研究显示,在 4个周期的基础上延长化疗周期并不能改善患者的生存期。Smith等[9]的一项308例患者参与的随机对照试验提示,MVP方案化疗6个周期的预后并不比3个周期更好。廖美琳等[10]研究显示术后辅助化疗不超过2周期者生存率明显低于3~4周期和超过4周期者。本研究发现,术后辅助化疗少于4疗程疗效会有影响,但延长术后辅助化疗周期数有可能会增加化疗毒性、影响生活质量。目前术后辅助化疗的周期数仍然推荐是4疗程。
ⅢA期NSCLC完全性切除后是否需要辅助放疗一直存在争议。在过去40年中,临床上开展了大量相关的临床Ⅲ期研究,有关这些临床研究的一项荟萃分析和一项系统文献综述,阐明了术后放疗的临床价值[10-12]:对于手术完全切除后、术后病理分期为Ⅰ~Ⅱ期者,术后放疗不但不能提高治疗效果,反而降低了患者的生存率;但对于术后病理为N2期患者,术后放疗能显著提高区域性肿瘤控制率,但对生存率提高不是非常显著。尽管以上两项分析综合了关于术后辅助放疗的多项Ⅲ期临床试验,但各试验的个体资料存在着较大差异性,且研究时间跨度大(40余年),这造成患者的入选标准(分期和病理类型)、手术方法及规范程度、随访状况和局部控制定义等存在差异性。另外术后放疗所使用放疗设备和技术水平不一,以往所用放疗设备多为60Co,放疗剂量也无客观剂量分布曲线等,这些将造成放疗相关性损伤增加,降低了这两项分析所得出结论的可信性。近年来一些临床资料支持手术完全切除后N2期NSCLC需要接受放疗。根据美国SEER(surveillance epidemiology,and end results database)数据库中 7 545例NSCLC病例,对于术后病理为N2者,术后放疗能使患者总生存率由20%提高到27%,有显著统计学意义。该研究尽管为回顾性分析,但大样本资料提示的术后放疗能提高N2患者生存率这一信息还是值得临床医生重视[13]。对ANITA临床资料回顾性分析发现按照术后淋巴结转移状态进行分层分析[14],发现对于术后病理为N2者,术后放疗能够明显提高生存率。在本研究中是否行术后辅助放疗是影响ⅢA期NSCLC术后生存的独立因素,但是本研究中行术后辅助放疗的患者较少,而且并非随机研究,术后放疗的价值需要通过前瞻性多中心随机对照临床研究进行评价和确认。
CEA属于非器官特异性肿瘤相关抗原,正常情况下,CEA经胃肠道代谢,而肿瘤状态时的CEA则进入血和淋巴循环,引起血清CEA异常增高。在肺癌方面,30%~70%患者有异常高水平的CEA,对可手术的NSCLC患者进行围手术期的血液CEA检测可能有助于手术前分期、判断预后及筛选高危患者[15]。在本研究中,术前血清CEA水平升高组患者的生存明显差于正常组的患者(P=0.002,HR=1.934,95%CI:1.253~2.897),与上述研究结果相符。
LDH是一种糖酵解乳酸脱氢酶,是糖代谢中的主要酶类,恶性细胞利用葡萄糖的能力较正常组织细胞高5~10倍。肿瘤患者血清中升高的LDH主要来源于肿瘤细胞,可作为代表全身肿瘤细胞负荷的一项重要指标[16-17]。在本研究中,术前血清LDH水平升高组患者的生存明显差于正常组的患者(P=0.002,HR=2.107,95%CI:1.291~3.371),进一步证明前述研究结果。
综上所述,术前血清CEA、LDH水平,术后是否行辅助放、化疗是影响ⅢA期NSCLC预后的独立因素。
[1] 杨玲,李连弟,陈育德,等.中国2000年及2005年恶性肿瘤发病死亡的估计与预测[J].中国卫生统计,2005,22(4):218-221.
[2] Sobin LH,Fleming ID.TNM Classification of Malignant Tumors,fifth edition(1997).Union Internationale Contre le Cancer and the American Joint Committee on Cancer[J].Cancer,1997,80(9):1803-1804.
[3] Mountain CF.Revisions in the international system for staging lung cancer[J].Chest,1997,111(6):1710-1717.
[4] 吴一龙,黄植蕃,戎铁华,等.基于97分期的非小细胞肺癌术后分期和生存研究[J].中华肿瘤杂志,1999,21(5):363-365.
[5] Arriagada R,Bergman B,Dunant A,et al.Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer[J].N Engl JMed,2004,350(4):351-360.
[6] Douillard JY,Rosell R,De Lena M,et al.Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer(adjuvant navelbineinternational trialist association[ANITA]):a randomised controlled trial[J].Lancet Oncol,2006,7(9):719-727.
[7] Pignon JP,Tribodet H,Scagliotti G,et al.Lung adjuvant cisplatin evaluation(LACE):a pooled analysis of five randomized clinical trials including 4584 patients[J].J Clin Oncol,2006,24(18S):7008.
[8] Socinski MA,Schell MJ,Peterman A,et al.Phase III trial comparing adefined duration of therapy versus continuous therapy followed by second-line therapy in advanced stage III B/IV non small-cell lung cancer[J].J Clin Oncol,2002,20(5):1335-1343.
[9] Smith LE,Obrien ME,Talbot DC,et al.Duration of chemotherapy in advanced non-small-cell lung cancer:a randomized trial of three versus six courses of mitomycin,vinblastine,and cisplatin[J].J Clin Oncol,2001,19(5):1336-1343.
[10]廖美琳,周允中,丁嘉安,等.围手术期化疗在非小细胞肺癌中的应用探讨[J].中华医学杂志,2003,83(11):962-966.
[11]PORT Meta-analysis Trialists Group.Postoperative radiotherapy in non-small-cell lung cancer:systematic review and meta-analysis of individual patient data from nine randomised controlled trials[J].Lancet,1998,352(9124):257-263.
[12]Okawara G,Ung YC,Markman BR,et al.Postoperative radiotherapy in stageⅡ orⅢA completely resected nonsmall cell lung cancer:a systematic review and practice guideline[J].Lung Cancer,2004,44(1):1-11.
[13]Lally BE,Zelterman D,Colasanto JM,et al.Postoperative radiotherapy for stageⅡorⅢnon-small-cell lung cancer using the surveillance,epidemiology,and end results database[J].J Clin Oncol,2006,24(19):2998-3006.
[14]Douillard JY,Rosell R,De Lena M,et al.Impact of postoperative radiation therapy on survival in patients with complete resection and stageⅠ ,Ⅱ,orⅢa non-small-cell lung cancer treated with adjuvant chemotherapy:the adjuvant navelbine international trialist association(anita)randomized trial[J].Int J Radiat Oncol Biol Phys,2008,72(3):695-701.
[15]Okada M,Nishio W,Sakamoto T,et al.Prognostic significance of perioperative serum carcinoembryonic antigen in non-small cell lung cancer:analysis of 1,000 consecutive resections for clinical stage I disease[J].Ann Thorac Surg,2004,78(1):216-221.
[16]Buccheri G,Ferrigno D.Serum biomarkers of non-neuronendocrine origin in small-cell lung cancer:a 16-year study on carcinoembryonic antigen,tissue poly-peptide antigen and lactate dehydrogenase.Lung Cancer 2000,30(1):37-49.
[17]Koukourakis MI,Giatromanolaki A,Sivridis E,et al.Lactate dehydrogenase-5(LDH-5)overexpression in nonsmall-cell lung cancer tissues is linked to tumour hypoxia,angiogenic factor production and poor prognosis[J].Br J Cancer,2003,89(5):877-885.

