牛γ干扰素的表达及其抗病毒活性测定
徐正中,陈祥,单锋丽,孟闯,孙林,黄金林,潘志明,耿士忠,焦新安
扬州大学 江苏省人兽共患病学重点实验室,扬州 225009
牛γ干扰素的表达及其抗病毒活性测定
徐正中*,陈祥*,单锋丽,孟闯,孙林,黄金林,潘志明,耿士忠,焦新安
扬州大学 江苏省人兽共患病学重点实验室,扬州 225009
通过RT-PCR从经ConA刺激诱导的奶牛脾脏淋巴细胞总RNA中扩增出牛γ干扰素 (BoIFN-γ) cDNA,克隆到真核载体 pVAX1中,测序结果显示 pVAX1中的插入序列 BoIFN-γ基因与已报道序列一致。用重组质粒pVAX1-BoIFN-γ转染COS-7细胞并进行间接免疫荧光试验鉴定,结果显示BoIFN-γ在COS-7细胞中得到成功表达。将BoIFN-γ基因克隆到原核表达质粒pET-30a(+)、pGEX-6p-1后,分别转化重组表达菌BL21(DE3)、BL21后,通过对表达条件的优化,SDS-PAGE分析表明两种重组蛋白均可实现可溶性表达,大小分别为23 kDa和43 kDa。将含信号肽BoIFN-γ基因克隆到转座载体 pFastBacTM1中并转化 DH10Bac,通过位点特异性转座将 BoIFN-γ基因整合到穿梭载体Bacmid中并通过脂质体转染Sf9昆虫细胞,产生重组杆状病毒rBac-BoIFN-γ,重组病毒传代扩增感染Sf9细胞后,通过间接免疫荧光试验证实 BoIFN-γ在杆状病毒系统中获得表达。使用 MDBK/VSV细胞系统测定 rHis-BoIFN-γ、rGST-BoIFN-γ以及 rBac-BoIFN-γ的抗病毒活性,其效价分别达到 8.389×107U/mg、6.554×105U/mg、4.096×104U/mL,3种具有较高的抗病毒活性重组牛γ干扰素的获得为其开发应用提供了重要的生物材料。同时使用单克隆抗体5G4和3E6,建立了BoIFN-γ的双抗夹心ELISA检测方法并绘制了标准曲线,可定量分析BoIFN-γ的抗病毒活性,为其临床应用及相关研究提供了重要的方法。
牛γ干扰素,大肠杆菌系统,杆状病毒系统,抗病毒活性,ELISA
Abstract:Bovine interferon-γ (BoIFN-γ) gene was amplified by reverse transcription polymerase chain reaction (RT-PCR) from total RNA of bovine spleen lymphocytes stimulated with ConA. The products of RT-PCR were cloned into pVAX1 vector, positive recombinant clone was identified by restriction enzyme digestion and sequencing. The recombinant plasmid pVAX1-BoIFN-γ was transfected into COS-7 cells mediated by lipofectine, indirect immunofluorescent assay analysis confirmed that rBoIFN-γ wasexpressed in COS-7 cells. BoIFN-γ gene (without signal peptide) was cloned into pET-30a(+) and pGEX-6p-1 vector, and transformed into the Escherichia coli cells. After optimizing the induction condition, SDS-PAGE analysis showed that the expression products were all found in soluble form and had a molecular weight of 23 kDa and 43 kDa respectively. BoIFN-γ precursor gene(with signal peptide) was cloned into transfer vector pFastBacTM1, and transformated into DH10Bac E. coli cells. By site-specific transposition, BoIFN-γ gene was integrated into shuttle vector Bacmid, and transfected into the Sf9 insect cells mediated by lipofectine to produce recombinant baculovirus. Indirect immunofluorescent assay analysis confirmed that rBac-BoIFN-γ was expressed successfully in Baculovirus vector system. The antiviral activities of rHis-BoIFN-γ, rGST-BoIFN-γ and rBac-BoIFN-γ were up to 8.389×107U/mg, 6.554×105U/mg and 4.096×104U/mL respectively, which were analyzed in MDBK/VSV system. A sandwich ELISA was established using monoclonal antibodies 3E6 and 5G4, which can detect BoIFN-γ in quantity and provide a useful method for the clinical practice and research of BoIFN-γ.
Keywords:bovine interferon-γ, Escherichia coli, baculovirus vector system, antiviral activity, ELISA
γ干扰素 (IFN-γ) 主要是由有丝分裂原或特异性抗原刺激而活化的CD4+Th1细胞、CD8+T细胞及 NK细胞等产生的细胞因子,具有广泛抗病毒、抗肿瘤活性以及免疫调节功能,如活化巨噬细胞、提高 MHCⅠ类和Ⅱ类分子的表达、促进抗原提呈等,是机体防御系统的重要组成部分[1]。研究表明外源性的 IFN-γ既可以作为药剂用于感染性疾病或肿瘤等的治疗,又可以作为免疫佐剂,增强疫苗的免疫效果,还能与一些病原微生物的保护性抗原基因共表达,从而加强和改善疫苗的免疫效果;内源性 IFN-γ水平的高低在很大程度上可以反映机体的细胞免疫状态,而抗原特异性的 IFN-γ反应则可以作为机体针对某种特定外来抗原的细胞免疫状态的指标。
利用传统的方法从牛血液中提取和纯化BoIFN-γ,过程繁琐且含量很低,无法满足实际使用的需求。1986年,自Cerretti等[2]克隆出牛IFN-γ基因后,利用基因工程技术生产重组牛 IFN-γ(rBoIFN-γ) 用于奶牛疾病的防治研究开始兴起,国内外学者已先后利用大肠杆菌[3]、酵母[4]、牛Ⅰ型疱疹病毒 (BHV-1)[5]、杆状病毒等系统[6]表达出重组牛IFN-γ,并对其免疫学和生物学活性进行了研究。但是目前常用的大肠杆菌系统表达的 BoIFN-γ蛋白多以包涵体形式存在,不能进行翻译后修饰等过程,因此其空间结构及生物活性与天然抗原有较大差别,另外内毒素也难以去除,因此在临床应用中受到一定程度的限制。干扰素生物学活性定量分析的研究从干扰素被发现以来就一直没有间断过。抗病毒分析方法 (Antiviral assay,AVA) 是第一个建立起来的检测IFN样品相对活性或效能的生物学方法。现有的干扰素生物学活性鉴定与定量分析方法普遍存在费时、繁琐、不够精确、特异性差等一系列缺陷,亟待改进。
本研究以伴刀豆蛋白 (ConA) 刺激诱导的奶牛脾脏淋巴细胞总 RNA为模板,通过 RT-PCR获得BoIFN-γ基因cDNA,并将其分别克隆至原核和真核表达载体,以实现重组 BoIFN-γ蛋白的高效可溶性表达。同时使用针对 BoIFN-γ的单克隆抗体[7]建立抗原特异性的双抗夹心ELISA方法,用于定量分析BoIFN-γ的抗病毒活性,为 BoIFN-γ的进一步研究奠定基础。
1 材料与方法
1.1 质粒、宿主细菌、细胞及病毒
质粒载体pGEX-6p-1购自Amersham Biosciences公司;pET-30a(+) 购自Novagen公司;pFastBacTM1购自 GIBCO 公司;大肠杆菌 DH5α、BL21、BL21(DE3) 菌株由本实验室保存;转座用大肠杆菌DH10Bac (含杆状病毒穿梭质粒Bacmid和辅助质粒Helper) 购自Invitrogen公司;草地贪夜蛾卵巢细胞系9 (Sf9细胞)、牛肾细胞系 (MDBK)、野生型杆状病毒 (wtAcNPV)、水泡性口炎病毒 (VSV) 由本室保存。
1.2 主要试剂
RPMI 1640培养基、昆虫细胞培养基Sf900Ⅱ购自GIBCO公司;FITC标记的羊抗鼠IgG、伴刀豆蛋白 A (ConA) 购自 Sigma公司;胎牛血清购自Hyclone公司;淋巴细胞分离液购自杭州灏洋生物工程公司;脂质体转染试剂购自Invitrogen公司;高保真DNA聚合酶、限制性核酸内切酶、T4 DNA连接酶、DNA回收试剂盒等购自 TaKaRa公司;抗BoIFN-γ高免血清、抗 BoIFN-γ单克隆抗体 (5G4和3E6) 由本室制备保存;其他常规试剂为国产分析纯试剂。
1.3 BoIFN-γ cDNA片段的克隆与鉴定
参照BoIFN-γ cDNA序列 (GenBank Accession No. M29867) 设计扩增PreBoIFN-γ cDNA的引物:(下划线部分为 BamHⅠ酶切位点),Pa1:5′-GTACTCGA(下划线部分为 XhoⅠ酶切位点),预计扩增片段长度为539 bp,由上海生工生物工程技术服务有限公司合成。按常规方法进行牛脾脏淋巴细胞的分离、刺激培养及总RNA的提取,两步法RT-PCR扩增BoIFN-γ cDNA基因。
1.4 重组质粒pVAX1-PreBoIFN-γ的构建及鉴定
将纯化回收的RT-PCR产物经BamHⅠ和XhoⅠ双酶切后,克隆入真核表达质粒pVAX1的相应位点之间,参照文献[8]介绍方法转化、筛选和鉴定,将鉴定正确的重组质粒命名为pVAX1-PreBoIFN-γ,并将阳性克隆送联合基因科技有限公司进行 DNA序列测定。
1.5 重组质粒pVAX1-PreBoIFN-γ转染COS-7细胞及间接免疫荧光鉴定
将重组质粒 pVAX1-PreBoIFN-γ转染 COS-7细胞,6% CO2、37 ℃孵育6 h后吸去转染混合物,6%CO2、37 ℃继续培养。转染后48 h,弃细胞上清,使用PBS将转染细胞洗涤3次,用−20 ℃的无水乙醇:丙酮 (2∶3) 混合液室温固定 5 min,以 1∶500稀释抗BoIFN-γ高免血清为一抗,以1∶500稀释的FITC标记的羊抗鼠IgG为二抗,PBST洗涤后荧光倒置显微镜下观察结果。
1.6 原核重组质粒pET-30a-BoIFN-γ、pGEX-6p-1-BoIFN-γ的构建及鉴定
以 pVAX1-PreBoIFN-γ为模板,以引物 Ps2:(下划线部分为BamHⅠ酶切位点),Pa2:5′-TTTGAATTC TTACGTTGATGCTCTCCG-3′ (下划线部分为 EcoRⅠ酶切位点) 扩增不含信号肽的450 bp成熟BoIFN-γ基因。将纯化回收的 BoIFN-γ扩增产物经 BamHⅠ和 EcoRⅠ双酶切后,分别克隆入原核表达载体pET-30a(+) 和pGEX-6P-1中,参照文献[8]介绍的方法转化、筛选和鉴定,将鉴定正确的重组质粒分别命名为 pET-30a-BoIFN-γ、pGEX-6p-1-BoIFN-γ。
1.7 重组菌 BL21(DE3)(pET-30a-BoIFN-γ)、BL21(pGEX-6p-1-BoIFN-γ) 的诱导表达及蛋白纯化
分 别 挑 取 BL21(DE3)(pET-30a-BoIFN-γ)、BL21(pGEX-6p-1-BoIFN-γ) 单个阳性重组菌落于3 mL含相应抗生素的LB液体培养基中,37 ℃振摇培养过夜。次日以 1∶100接种至含相应抗生素的LB液体培养基中,于37 ℃中振摇培养至OD值为0.4~0.6 (分别培养3~4 h和2.5~3.5 h) 时,加入IPTG使终浓度分别为0.01 mmol/L和0.05 mmol/L,并分别置于37 ℃和25 ℃诱导培养4~5 h,离心收集菌体,以灭菌PBS洗涤、悬浮。在冰浴中利用超声波破碎仪裂解菌体 (800 W超声10 s,间隔20 s)。依次 6 000 r/min 10 min,8 000 r/min 20 min,8 000 r/min 20 min,9 000 r/min 20 min离心裂解上清。将离心后收集的裂解上清分别使用 His-Bind Purification Kit和Sepharose 4B柱进行纯化,收集纯化融合蛋白rHis-BoIFN-γ和rGST-BoIFN-γ,分光光度计测量蛋白质浓度,并进行SDS-PAGE电泳鉴定。
1.8 重组转移质粒 pFast-BoIFN-γ和重组穿梭质粒Bacmid-BoIFN-γ的构建及鉴定
将pVAX1-PreBoIFN-γ经BamHⅠ和XhoⅠ双酶切后,克隆到转座载体pFastBacTM1中,参照文献[8]介绍的方法转化、筛选和鉴定,将鉴定正确的重组质粒命名为 pFast-BoIFN-γ;参照文献[9-10]介绍的方法将重组质粒 pFast-BoIFN-γ转化 DH10Bac,通过位点特异性转座将 BoIFN-γ基因整合到穿梭载体Bacmid中,将鉴定正确的重组质粒命名为Bacmid-BoIFN-γ。
1.9 重组穿梭质粒Bacmid-BoIFN-γ转染Sf9细胞及间接免疫荧光鉴定
将重组穿梭质粒Bacmid-BoIFN-γ按Bac-to-Bac系统的操作步骤转染对数分裂期的Sf9细胞,5 h后吸去转染混合物,27 ℃继续培养 72 h以上,直至Sf9细胞出现明显病变时为止。收集培养上清,避光保存于4 ℃,即为P1代病毒。P1代病毒在Sf9细胞上经2次传代扩增后,即为P3代病毒。将病毒保存液按1∶100体积比感染Sf9昆虫细胞,至细胞病变达90%时,弃细胞上清,使用PBS洗涤,吹干后用预冷甲醇固定15 min,同时设野生型杆状病毒感染细胞为阴性对照;以1∶100稀释的抗BoIFN-γ单抗 5G4为一抗,以 1∶500稀释 FITC标记的羊抗鼠IgG为二抗;PBST洗涤后荧光倒置显微镜下观察结果。
1.10 重组BoIFN-γ抗病毒活性测定
采用微量细胞病变抑制法,参照文献[11-12]测定原核 rHis-BoIFN-γ、rGST-BoIFN-γ和真核rBac-BoIFN-γ的抗病毒活性,以每mL (mg) 干扰素样品的最高稀释度仍能保护半数细胞 (50%) 免受病毒攻击的稀释度的倒数值定义为1个干扰素单位 (U)。
1.11 重组BoIFN-γ双单抗夹心ELISA检测方法的建立
1.11.1 ELISA操作程序的确定
使用包被液 (碳酸盐缓冲液,pH 9.6) 稀释包被单抗5G4,100 μL/孔,置于4 ℃过夜包被;按常规方法洗涤 (洗涤液:含0.05% Tween-20的PBS,pH 7.4) 和封闭 (封闭液:含1% BSA的洗涤液);用稀释液 (稀释液:含1% BSA、0.05% Tween-20的 PBS,pH 7.4) 稀释抗原,100 μL/孔,37 ℃孵育1.5 h;洗涤 3次,加入稀释液稀释的检测抗体Biotin-3E6,100 μL/孔,37 ℃孵育 1 h;洗涤 3 次,加入稀释液 1∶3 000稀释的 Streptavidin-HRP,100 μL/孔,37 ℃孵育1 h;洗涤3次,加入现配的OPD 100 μL/孔,避光反应15 min后,加入终止液(2 mol/L H2SO4) 50 μL/孔,读取吸光值 (OD492)。
1.11.2 ELISA最佳反应条件的确定
使用包被液将包被抗体稀释至5、10、20和40 μg/mL,用稀释液将检测抗体作 1∶500、1∶1 000、1∶2 000和1∶4 000稀释,对重组BoIFN-γ进行检测,以确定包被抗体和检测抗体的最佳使用浓度,其他步骤均按照1.11.1中ELISA操作程序。
1.11.3 重组BoIFN-γ的定量分析
使用包被液将包被抗体稀释至10 μg/mL,将重组 BoIFN-γ用稀释液作倍比稀释后,每个稀释度做2个复孔平行加入ELISA板中,以1∶2 000稀释的生物素标记抗体为检测抗体,按相同方法进行ELISA分析,测定 OD492值,以抗病毒活性单位为横坐标,OD492值为纵坐标,绘制标准曲线。
1.12 真核rBac-BoIFN-γ表达条件的优化
将重组杆状病毒保存液依次进行 1∶100、1∶500和1∶1 000体积比稀释后感染Sf9昆虫细胞,并分别于感染后 0、24、48、72、96、120、144、168、192 h吸取上清,通过建立的双单抗夹心ELISA方法测定干扰素的抗病毒效价,确定不同病毒接种量及不同感染时间对蛋白表达的影响,从而选择最佳的条件进行重组蛋白的大量表达。
2 结果
2.1 pVAX1-PreBoIFN-γ转染COS-7细胞结果
通过间接免疫荧光试验检测 PreBovIFN-γ基因的表达,结果显示,pVAX1-PreBovIFN-γ转染的COS-7细胞可见强烈的绿色荧光 (图 1A),而空载体质粒pVAX1转染和处理后未见荧光 (图1B)。
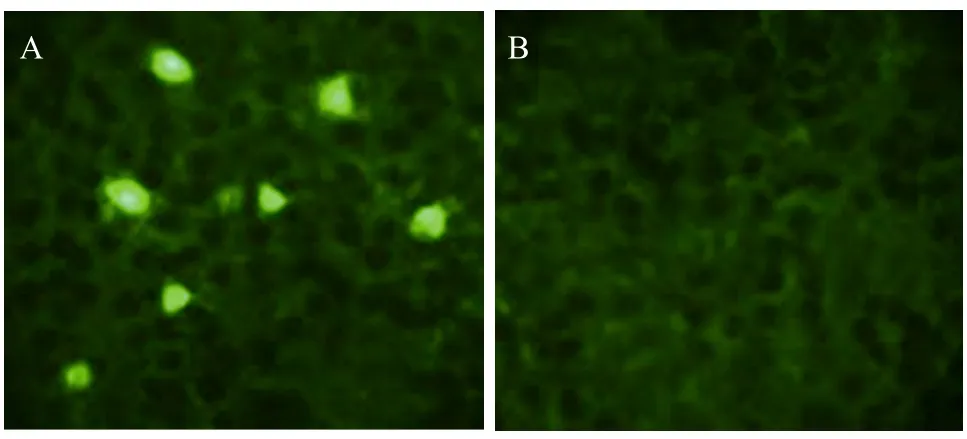
图1 COS-7细胞转染试验结果Fig. 1 Immunoflurescence analysis of transfected COS-7 cells.(A) COS-7 cells transfected with recombinant plasmid pVAX1-PreBovIFN-γ. (B) COS-7 cells transfected with plasmid pVAX1.
2.2 重 组 菌 BL21(DE3)(pET-30a-BovIFN-γ)、BL21(pGEX-6p-1-BoIFN-γ) 表达产物及其纯化产物的SDS-PAGE分析
取 重 组 菌 BL21(DE3)(pET-30a-BoIFN-γ) 、BL21(pGEX-6p-1-BoIFN-γ) 未诱导和诱导后的全菌裂解上清、纯化蛋白进行 SDS-PAGE电泳 (图 2、3)。电泳结果表明 BoIFN-γ基因在重组菌中获得成功表达,分别于分子量为23、43 kDa处有一明显的增量蛋白带,与预期融合蛋白的分子量和纯化产物大小一致,而未诱导菌在相应分子量处未见此条带。
2.3 间接免疫荧光检测rBac-BoIFN-γ表达
以抗BoIFN-γ单抗5G4为一抗分别检测野生型杆状病毒感染 Sf9细胞、重组杆状病毒感染Sf9细胞,结果显示,感染重组杆状病毒的sf9细胞出现明显绿色荧光 (图4A),而感染野生型杆状病毒的Sf9细胞未见荧光 (图 4B),可见 rBac-BoIFN-γ在杆状病毒系统中得到成功表达。
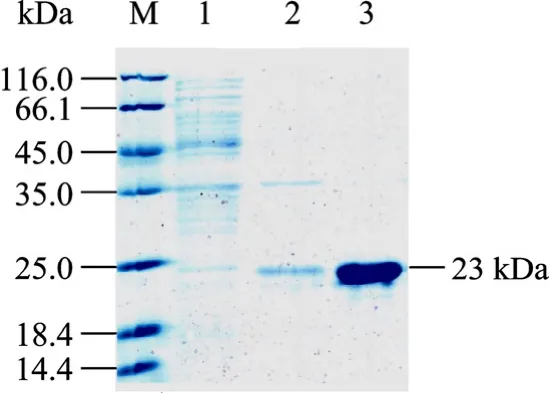
图2 rHis-BoIFN-γ的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of rHis-BoIFN-γ. M: protein marker; 1: supernatants of lysate of BL21(DE3)(pET-BoIFN-γ)without induced by IPTG; 2: supernatants of lysate of BL21(DE3)(pET-BoIFN-γ) induced by IPTG; 3: purified rHis-BoIFN-γ protein.
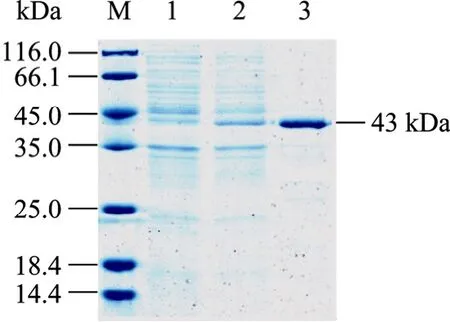
图3 rGST-BoIFN-γ的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of rGST-BoIFN-γ. M: protein marker;1: supernatants of lysate of BL21(pGEX-6P-1-BoIFN-γ) without induced by IPTG; 2: supernatants of lysate of BL21(pGEX-6P-1-BoIFN-γ) induced by IPTG; 3: purified rGST-BoIFN-γ protein.

图4 间接免疫荧光检测 rBac-BoIFN-γ在昆虫细胞中的表达Fig. 4 IFA detecting expression of rBac-BoIFN-γ in Sf9 cells.(A) Sf9 cells transfected with recombinant plasmid Bacmid-BoIFN-γ. (B) Sf9 cells transfected with plasmid Bacmid.
2.4 重组BoIFN-γ抗病毒活性测定
利用VSV-MDBK细胞系统测定rBoIFN-γ抗病毒活性,大肠杆菌系统表达的 rHis-BoIFN-γ和rGST-BoIFN-γ蛋白活性分别为 8.389×107U/mg和6.554×105U/mg,杆状病毒系统表达的细胞上清中rBac-BoIFN-γ活性为4.096×104U/mL。结果显示,原核及真核系统表达的rBoIFN-γ均具有较高的抗病毒活性 (图5)。
2.5 重组BoIFN-γ的双单抗夹心ELISA检测方法的建立及应用
2.5.1 ELISA最佳反应条件的确定
根据方阵实验结果,确定包被抗体5G4最佳使用浓度为10 μg/mL,检测抗体Biotin-3E6最佳稀释倍数为1∶2 000。
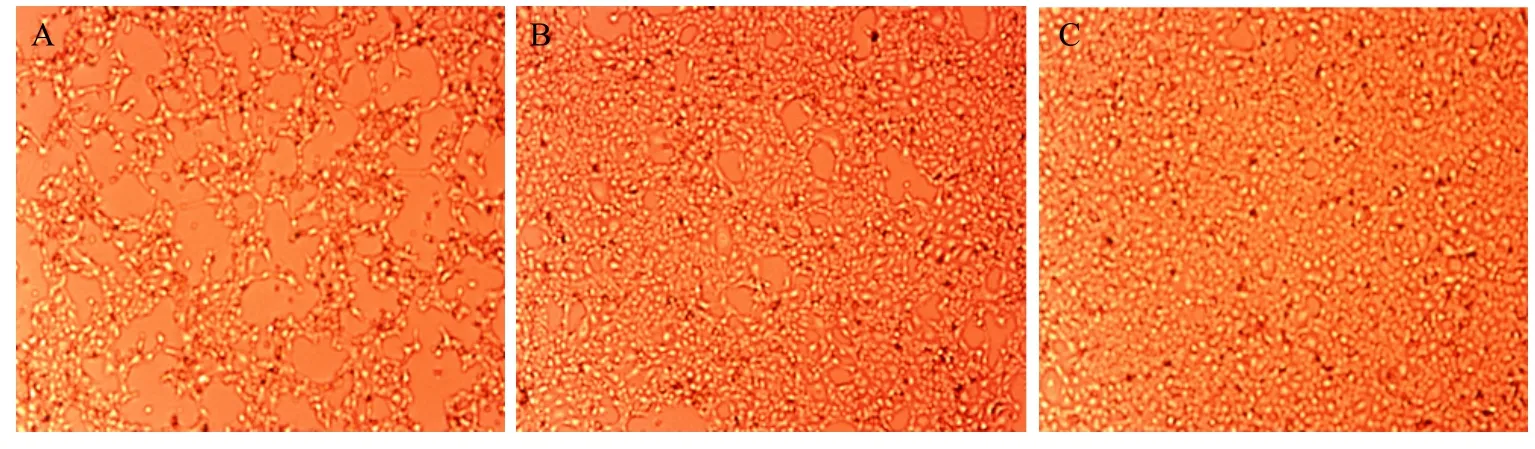
图5 重组BoIFN-γ抗病毒活性测定结果Fig. 5 Antiviral activities analysis of recombinant BoIFN-γ. (A) MDBK cells with VSV. (B) MDBK cells with VSV and recombinant BoIFN-γ. (C) MDBK cells.
2.5.2 重组BoIFN-γ的定量分析
采用双夹心ELISA的方法分别测定rHis-BoIFN-γ和 rBac-BoIFN-γ,通过倍比稀释的方法,取抗病毒活性值的对数和 OD值建立标准曲线,通过对数回归建立标准曲线方程 (图6)。根据ELISA的OD值(Y值) 利用建立的方程计算重组BoIFN-γ样品的抗病毒活性值。

图6 双单抗夹心ELISA检测BoIFN-γ标准曲线的绘制Fig. 6 Standard cruve of rBoIFN-γ detection by ELISA. (A)rHis-BoIFN-γ. (B) rBac-BoIFN-γ.
2.6 真核rBac-BoIFN-γ表达水平的优化
由结果可见,不同病毒接种量对重组蛋白表达量的影响不大,但是对于蛋白表达高峰的出现时间有影响,随着病毒接种量的降低,表达高峰出现时间逐渐往后推移 (图 7)。由于细胞会逐渐裂解,为防止昆虫细胞蛋白组分对蛋白产物的污染,以及蛋白产物发生降解,病毒接种量不应太低,蛋白收获时间不应超过120 h。
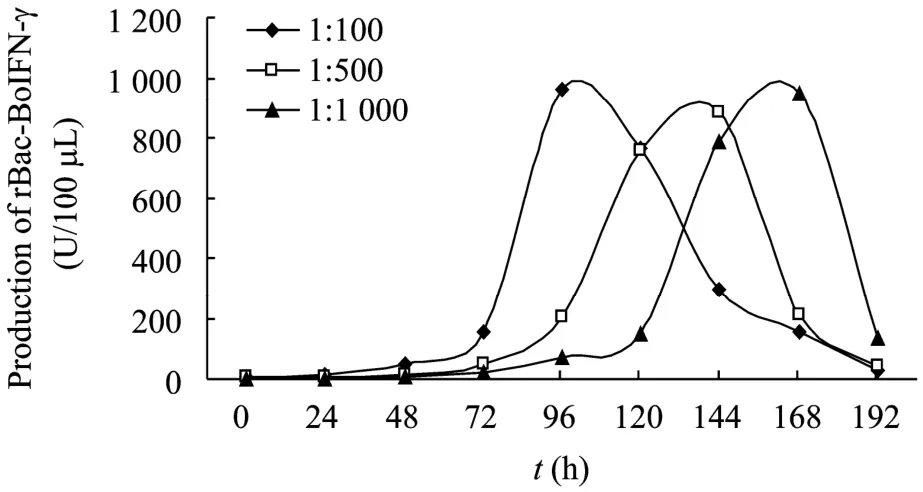
图7 不同接种量和时间对蛋白表达的影响Fig. 7 Influence of vaccination quantity and time point on the production of rBac-BoIFN-γ.
3 讨论
干扰素是一类多功能细胞因子,具有抵抗病毒感染、抑制肿瘤细胞生长与调节机体免疫功能的作用。干扰素分为 I型和Ⅱ型两类,I型干扰素包括IFN-α和 IFN-β,Ⅱ型干扰素 IFN-γ,又称免疫干扰素。目前在国内外奶牛养殖过程中,出现奶牛乳腺炎、口蹄疫、牛结核等多种疾病,严重影响奶牛的产奶产量和质量,还给畜牧场造成了巨大的经济损失。干扰素作为免疫应答的自然诱导物和调节物,在临床上具有良好的应用前景。
IFN-γ基因在正常情况下处于封闭状态,必须在各种特异性或非特异性刺激因子的刺激下才能表达,因此要获得高效价廉的IFN-γ,需通过基因工程技术大量制备和生产,使其在动物中的应用成为可能。大肠杆菌表达系统具有操作简单、生产成本低、产量高、易于工业化生产等优点,但是大肠杆菌表达的蛋白多以包涵体或部分可溶的形式存在,不能进行翻译后的修饰等过程,使其存在活性低、纯化复性步骤繁琐、内毒素难以去除等诸多缺陷,因此在临床应用中受到一定程度的限制。杆状病毒表达系统能够较好地对重组蛋白糖基化和剪切折叠,比原核表达系统更优越,表达产物比活性更高,更适合细胞因子的表达,而且杆状病毒具有高度的种属特异性,仅感染昆虫,对脊椎动物无感染性,其表达产物安全可靠,经过简单处理即可以直接应用于畜禽疾病的临床治疗。
本研究通过对表达条件的优化,实现了重组BoIFN-γ在大肠杆菌系统中的可溶性表达,及在杆状病毒系统中的分泌性表达,经抗病毒活性检测显示,3种重组蛋白 rHis-BoIFN-γ、rGST-BoIFN-γ和rBac-BoIFN-γ均具有较高生物学活性,为应用于病毒和肿瘤性疾病的治疗提供了材料,有望在牛感染性疾病的防治中发挥重要作用。本实验室通过建立的BoIFN-γ抗原捕获ELISA法检测奶牛临床血浆样品,并以商品化试剂盒作为平行对照,结果显示 2种方法检测符合率达到 83.9%[13]。同时,本研究还建立了BoIFN-γ的双单抗夹心ELISA检测方法,并绘制了标准曲线,可测定大肠杆菌和杆状病毒表达的 BoIFN-γ,定量分析其抗病毒活性,该方法与MDBK/VSV系统所测定结果符合,且比后者更为安全、便捷、准确,为 BoIFN-γ的生物学功能、作用机理的研究及临床应用提供了一种有效的手段。
REFERENCES
[1] Billiau A. Interferon: the pathways of discovery I.Molecular and cellular aspects. Cytokine Growth Factor Rev, 2006, 17(5): 381−409.
[2] Cerretti DP, Mckereghan K, Larsen A, et al. Cloning,sequence, and expression of bovine interferon-gamma. J Immunol, 1986, 136(12): 4561−4564.
[3] Kashima T, Morichita A, Iwata H, et al. Expression of bovine cytokines in Escherichia coli. J Vet Med Sci, 1999,61(2): 171−173.
[4] Wedlock DN, Doolin EE, Parlane WA, et al. Effects of yeast expressed recombinant interleukin-2 and interferon-γ on physiological changes in bovine mammary glands and on bactericidalactivity of neutrophils. J Dairy Res, 2000,67(2): 189−197.
[5] Raggo C, Habermehl M, Babiuk LA, et al. The in vivo effects of recombinant bovine herpesvirus-1 expressing bovine interferon-γ. J Gen Virol, 2000, 81(11): 2665−2673.
[6] Murakami K, Uchiyama A, Kokuho T, et al. Production of biologically active recombinant bovine interferon-γ by two different baculovirus gene expression systems using insect cells and silkworm larvae. Cytokine, 2001, 13(1):18−24.
[7] Zhang CQ, Chen X, Niu ZW, et al. Development of monoclonal antibodies against recombinant bovine interferon-gamma. Chin J Anim Infect Dis, 2009, 17(4):15−19.
张成全, 陈祥, 牛中伟, 等. 重组牛 γ-干扰素单克隆抗体的研制. 中国动物传染病学报, 2009, 17(4): 15−19.
[8] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3nd Ed. Beijing: Science Press, 2002.
[9] Xu JJ, Qin AJ, Jin WJ, et al. Expression of biologically active recombinant bovine interferon-γ in Sf9 cells. Chin J Vet Sci, 2006, 26(6): 626−630.
许金俊, 秦爱建, 金文杰, 等. 牛 γ-干扰素在昆虫细胞中的高效表达. 中国兽医学报, 2006, 26(6): 626−630.
[10] Dai H, Zheng JY, Chen JH, et al. Expression of recombinant chicken IFN-γ in baculovirus vector system.Lett Biotechnol, 2009, 20(6): 810−813.
戴华, 郑佳玉, 陈俊华, 等. 鸡 γ-干扰素在杆状病毒系统中的表达. 生物技术通讯, 2009, 20(6): 810−813.
[11] Shi XJ, Zheng C, Han CL, et al. Expressions of bovine interferon-γ in Escherichia coli and Pichia pastoris and comparision of their antiviral activities. J AgricBiotechnol, 2005, 13(4): 461−467.
史喜菊, 张灿, 韩春来, 等. 牛 γ-干扰素在大肠杆菌与毕赤酵母中的表达及抗病毒活性比较. 农业生物技术学报, 2005, 13(4): 461−467.
[12] Qin LT, Wang XJ, Hu S, et al. Expressions of bovine interferon gamma in recombinant baculovirus and determination of its antiviral activity. Acta Microbiol Sin,2007, 47(3): 503−507.
秦立廷, 王喜军, 胡森, 等. 牛 γ-干扰素在重组杆状病毒中的表达及其抗病毒活性的测定. 微生物学报, 2007,47(3): 503−507.
[13] Chen X, Niu ZW, Xu ZZ, et al. Development and preliminary application of bovine interferon-gamma capture ELISA. Chin J Anim Infect Dis, 2010, 18(4):54−59.
陈祥, 牛中伟, 徐正中, 等. 牛 γ-干扰素 ELISA检测方法的建立与初步应用. 中国动物传染病学报, 2010,18(4): 54−59.
Expression and antiviral assay of bovine interferon-γ
Zhengzhong Xu*, Xiang Chen*, Fengli Shan, Chuang Meng, Lin Sun, Jinlin Huang, Zhiming Pan,Shizhong Geng, and Xin’an Jiao
Jiangsu Key Laboratory of Zoonosis, Yangzhou University, Yangzhou 225009, China
Received: July 5, 2010; Accepted: September 21, 2010
Supported by: Natural Science Foundation of Guangdong Province (No. 06104396).
Corresponding author: Jie Wang. Tel: +86-20-36654245; E-mail: jiew@tom. com
广东省自然科学基金项目 (No. 06104396) 资助。

