八肋游仆虫中心蛋白N端半分子Loop区首个氨基酸的作用
赵 冰 段 炼 刘 文 赵亚琴 杨斌盛
(山西大学分子科学研究所,太原 030006)
八肋游仆虫中心蛋白N端半分子Loop区首个氨基酸的作用
赵 冰 段 炼 刘 文 赵亚琴 杨斌盛*
(山西大学分子科学研究所,太原 030006)
本文通过分子生物学方法将八肋游仆虫中心蛋白N端半分子loop区的首个氨基酸,天冬氨酸Asp37和Asp73,分别突变为带相反电荷的赖氨酸。使用铽敏化荧光、TNS疏水探针研究了八肋游仆虫中心蛋白N端半分子loop区的首个氨基酸的作用。结果表明:当中心蛋白loopⅠ区37位的天冬氨酸突变为赖氨酸后,loopⅠ丧失了金属离子结合能力,进而影响了中心蛋白依赖于金属离子的构象变化;而loopⅡ区73位的天冬氨酸突变为赖氨酸后仍保持金属离子结合能力,依赖于金属离子的构象变化减小。中心蛋白发挥大部分生物功能都依赖于金属离子,这就表明loopⅠ区37位的天冬氨酸在中心蛋白发挥生物功能时起着重要作用,是不可缺少的。在10 mmol·L-1Hepes、pH 7.4、20 mmol·L-1KCl条件下,八肋游仆虫中心蛋白N端半分子loopⅡ与金属离子 Tb3+和 Ca2+的结合常数分别为:KⅡ(Tb3+)=(8.31±0.18)×104L·mol-1和 KⅡ(Ca2+)=(0.94±0.12)×102L·mol-1,中心蛋白 N 端半分子的两个金属结合部位结合能力顺序为:Ⅰ>Ⅱ。
中心蛋白;N端半分子;Tb3+;Ca2+;TNS
中心蛋白是分子量约为20 kDa的酸性蛋白,属于高度保守的EF-Hand钙结合蛋白超家族[1-2]。自从绿藻中心蛋白发现以来,这些蛋白在微管组织中心(MTOC)中时间和空间上的分布,以及这种蛋白在细胞循环调控中的重要作用就成了细胞生物学研究的内容之一[2-6]。最初,中心蛋白被认为是纤维的主要成分,参与核与鞭毛单细胞鞭毛器的连接,随后发现,中心蛋白是中心粒、中心体以及有丝分裂纺锤体极体中广泛存在的组成成分[3,7-8]。
八肋游仆虫中心蛋白(EoCen)与人中心蛋白HsCenl、HsCen2、HsCen3以及钙调蛋白的同源性分别为60%、62%、66%和50%[9]。氨基酸序列分析表明EoCen由2个相对独立的区域(N端和C端)组成,每个区域包含2个EF-Hand结构和2个钙离子结合位点。由于每个EF-Hand的氨基酸序列都不同,这就决定了4个钙离子结合位点的性质也不同[10]。例如人中心蛋白HsCen2的loopⅣ区有一个高亲和位点[11-12],而HsCen3则表现出不同的结合行为:它有3个Ca2+结合位点,其中1个位于N端区域,而且是1个Ca2+/Mg2+的混合结合位点[12-13]。本实验室过去的研究工作发现,八肋游仆虫中心蛋白的4个Ca2+结合位点可分为两类,分别是C端荧光弱敏化的高亲和位点和N端荧光强敏化的低亲和位点,4个结合部位结合能力为Ⅳ>Ⅲ>Ⅰ,Ⅱ[14]。
图1为钙调蛋白N端半分子的2个EF-Hand结构结合金属离子前后的构象变化[15]。中心蛋白结合金属离子的结构模式可能与钙调蛋白类似。
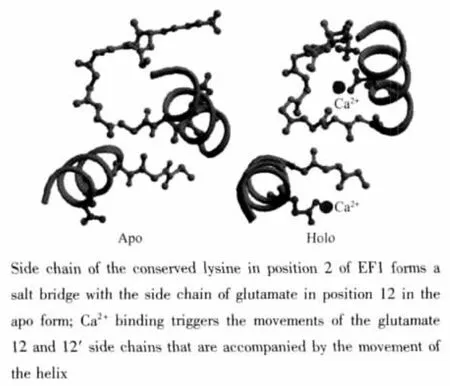
图1 钙调蛋白N端半分子结合金属离子前后的构象变化[15]Fig.1 Conformational change of N-terminal EF-Hand domain of CaM induced by Ca2+[15]
中心蛋白可能是一个钙离子传感器,在Ca2+饱和状态下,中心蛋白与特定的靶蛋白相互作用来调控细胞活性。一般来说,Ca2+的结合使得EF-Hand结构的α螺旋发生改变,转为以“开放”的构象存在,这样就导致了疏水腔的暴露,进而结合靶肽[13,16]。蛋白质发挥功能时通常伴随着构象的变化,2-对甲苯胺基-6-萘磺酸(TNS)已经被广泛用于金属离子诱导的中心蛋白构象变化的探针[17]。本实验室过去的研究发现:中心蛋白结合金属离子后,C端和N端发生的构象变化是不同的,N端能暴露出比C端更多的疏水表面[18]。
中心蛋白loop区最规范的序列中都包含3个D(天冬氨酸),目前所发现的EF-hand结构中,第一位的D都是非常保守的,很少有第一位不是D的[16]。由于中心蛋白N端是高变区,有人预测它与不同中心蛋白的功能多样性有关[3,11,19]。本文将中心蛋白N端半分子loop区的首个氨基酸天冬氨酸突变为赖氨酸,研究N端Ⅰ、Ⅱ结合部位结合能力的差异以及天冬氨酸在N端半分子构象变化中的作用,从而探索N端半分子首个氨基酸在中心蛋白发挥生物功能中的作用。
1 实验部分
1.1 试剂和仪器
N-2-羟乙基哌嗪-N′-2-乙磺酸(Hepes);2-对甲苯胺基-6-萘磺酸 (TNS)(Sigma公司);稀土氧化物Tb4O7,纯度不低于99.99%(湖南稀土金属材料研究所产品);其他均为分析纯试剂。
主要酶及生化试剂:限制性内切核酸酶BamHⅠ、SalⅠ、T4DNA连接酶,为Promega公司产品;Taq DNA聚合酶购于大连TaKaRa公司;质粒小量提取试剂盒及DNA回收试剂盒购于上海华舜生物工程有限公司;LB培养基所用的试剂Tryptone、Yeast Extract、Sodium Chloride 购 于 上 海 Sangon 公司;核酸分子量标准为MBI公司产品。
Hitachi F-2500和Hitachi-850荧光光谱仪、HP8453UV-Vis吸收光谱仪、Beckman酸度计、PM-10超滤膜、Eppendorf移液枪、Amicon Model 8010超滤器。
1.2 储备液的配制
稀土溶液:将稀土氧化物(Tb4O7)用适量的浓盐酸溶解,用双蒸水配成pH=5~6的溶液备用,以二甲酚橙为指示剂,在pH=5.6的乙酸-乙酸钠缓冲液中用标准EDTA溶液滴定,测定其标准浓度。
TNS溶液:称取一定量的TNS,加入少量NaOH溶液溶解,三次蒸馏水定容到50 mL,4℃放置备用,使用时稀释到所需浓度。
1.3 蛋白的表达和纯化
在八肋游仆虫中心蛋白N端半分子N-EoCen质粒的基础上用突变试剂盒TaKaRa MutanBEST Kit D401通过定点突变技术得到了重组表达质粒pGEX-6p-N-D73K。利用PCR技术,在全分子突变体D37K的基础上得到了N端突变体N-D37K。DNA序列测定表明所得到的突变体只含有目的位点的突变基因,而没有其他任何位点的随机突变。将重组质粒转入大肠杆菌BL21感受态细胞中,在诱导剂IPTG诱导下实现蛋白可溶性表达。融合蛋白经PPase酶切和GST亲和层析后得到目的蛋白。同时将野生型蛋白(EoCen)和课题组之前构建完成的片段分子蛋白(N-EoCen)诱导表达纯化得到目的蛋白。经SDS-PAGE分析显示所有蛋白均不含杂蛋白条带,达到实验所需纯度。
1.4 聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶包含 390 mmol·L-1Tris(pH 8.8),10%过硫酸铵,15%acrylamide/bis(29∶1),0.05%TEMED。Tris-Glycine电泳缓冲液包含25 mmol·L-1Tris(pH 8.3),250 mmol·L-1甘氨酸。电泳在室温下进行,天然胶用冰袋保护。样品在浓缩胶部分时,电泳仪电源电压设置为80 V,样品进入到分离胶后将电压调为120 V。电泳时间约为2 h。电泳完成后胶片经考马斯亮蓝R-250染色,甲醇-冰乙酸脱色液脱色。最后经VILBER LOURMAT凝胶成像系统成像。
1.5 光谱测定
荧光光谱在Hitachi-850和Hitachi F-2500荧光光谱仪上测得。测定TNS的荧光时,激发波长选定320 nm,激发和发射狭缝均为10 nm,从350~600 nm记录荧光发射谱。实验均在室温、10 mmol·L-1的Hepes、pH 7.4的条件下进行。为了便于不同滴定数据的对比并消除滴定中的稀释效应,荧光变化用摩尔荧光强度Fluorescence/cprotein来表示。
2 结果与讨论
2.1 变性胶电泳和天然胶电泳分析
N-D37K和N-D73K突变蛋白在SDS-聚丙烯酰胺凝胶电泳中 [图2A(泳道1和2)]与野生型NEoCen[图2A(泳道4)]有相同的迁移速率,所以在N端首个氨基酸突变后,分子量没有大的改变,依然是10 kDa。与变性胶不同的是,N-EoCen[图2B(泳道2)]比 N-D73K 和 N-D37K[图 2B(泳道 1和 3)]更接近胶片的底部(在电泳体系中对应正极),表明N-D37K和N-D73K比N-EoCen拥有更多的正电荷,由于天冬氨酸带负电,而赖氨酸带正电,这就证明得到了纯度较高的N-D37K和N-D73K突变蛋白。
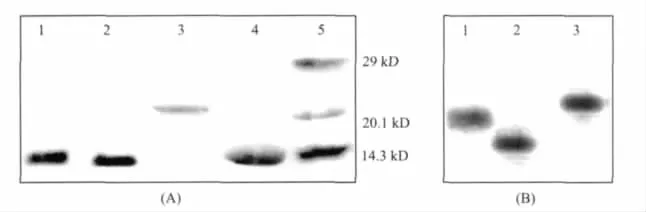
图2 (A)15%变性胶分析,(1)N-D37K;(2)N-D73K;(3)EoCen;(4)N-EoCen;(5)Marker;(B)15%天然胶分析,(1)N-D73K;(2)N-EoCen;(3)N-D37KFig.2 (A)Purified N-D37K(1),N-D73K(2),EoCen(3),N-EoCen(4),Marker(5)monitored by 15%SDS-PAGE;(B)Purified N-D73K(1),N-EoCen(2),N-D37K(3)monitored by 15%native PAGE
2.2 中心蛋白的Tb3+荧光敏化
Tb3+是被广泛应用的Ca2+结合蛋白的离子探针[20]。将Tb3+加入到蛋白溶液中,当酪氨酸或色氨酸在280 nm处激发时,在545 nm处可以检测到Tb3+的敏化荧光。图3是Tb3+在545 nm处的摩尔敏化荧光强度对r,即cTb3+/cprotein,所作的滴定曲线。从图3中可以看到,对于N-EoCen和N-D73K,随着前2个Tb3+的加入,其摩尔敏化荧光强度都得到增强,并且都在r=2时增强减弱,说明每个N-EoCen和ND73K都结合2个Tb3+离子,只是N-D73K的最大摩尔敏化荧光强度比N-EoCen降低了大约20%,而N-D37K的摩尔敏化荧光强度在r=1时增强减弱,说明每个N-D37K只结合1个Tb3+,且其最大摩尔敏化荧光强度大约只有N-EoCen的25%。这些结果表明当中心蛋白N端loopⅠ区的37位天冬氨酸突变为赖氨酸后,中心蛋白loopⅠ区丧失了金属离子结合能力。
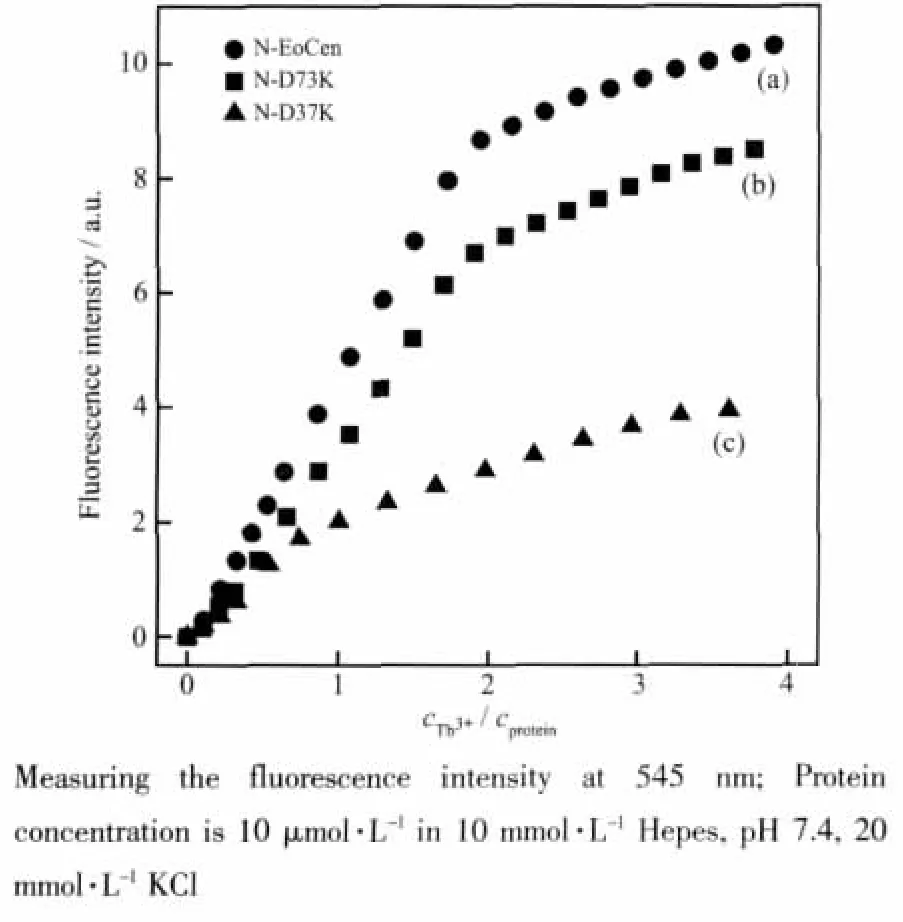
图3 Tb3+分别滴定 N-EoCen(a),N-D73K(b)和 N-D37K(c)蛋白的滴定曲线Fig.3 Titration curves for the addition of Tb3+to N-EoCen(a),N-D73K(b)and N-D37K(c),respectively
从八肋游仆虫中心蛋白的一级结构可见,N端loopⅠ区37位天冬氨酸突变为赖氨酸后,loopⅠ区的净电荷由-1变为+1,而金属离子带正电,由于排斥作用,导致LoopⅠ丧失了金属离子结合能力。loopⅡ区73位的天冬氨酸突变为赖氨酸后,loopⅡ区的净电荷由-3变为-1,仍能结合金属离子,与实验结果相吻合。N-D73K的敏化荧光强度相对于野生型N-EoCen有所降低,这可能是由于73位的天冬氨酸突变为赖氨酸后,Tb2-N-D73K与Tb2-NEoCen的三级结构不同所致。
2.3 Tb3+/Ca2+与N-D37K结合常数的计算
从N-D37K的Tb3+荧光滴定曲线 (图3c)可以得知:一个N-D37K结合一个Tb3+,即n=1,用ct,Tb3+/cb,Tb3+对1/(nct,N-D37K-cb,Tb3+)作图(图 4),按照(1)式[21]拟合。
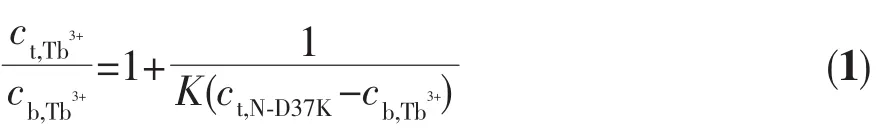
其中ct,Tb3+,cb,Tb3+分别是铽离子的总浓度和结合浓度,ct,N-D37K是N-D37K的总浓度。由图4可得Tb3+与 loop Ⅱ的结合常数,KⅡ=(8.31±0.18)×104L·mol-1。
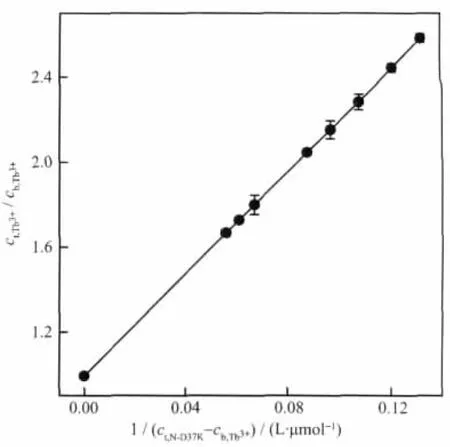
图4 ct,Tb3+/cb,Tb3+对1/(ct,N-D37K-cb,Tb3+)作图Fig.4 Plot of ct,Tb3+/cb,Tb3+versus 1/(ct,N-D37K-cb,Tb3+)
在Tb-N-D37K体系中,Ca2+的加入能使545 nm处铽离子的敏化荧光猝灭。图5是Ca2+滴定Tb-ND37K体系的荧光猝灭曲线,这种荧光猝灭来自于Ca2+和Tb3+与蛋白的竞争结合,即蛋白体系从ND37K-Tb转化为N-D37K-Ca。钙离子与N-D37K的loopⅡ的结合常数可以通过图5和(2)式[21]拟合得到。

图5 Ca2+滴定N-D37K-Tb的荧光竞争曲线Fig.5 Fluorescence quenching curve for the addition of Ca2+to N-D37K-Tb
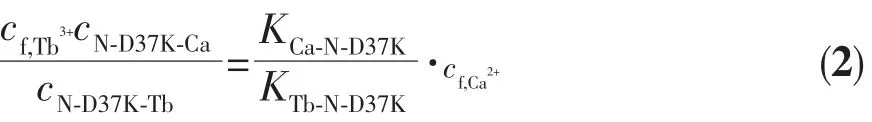
所得Ca2+与N-D37K的loopⅡ的结合常数为KⅡ=(0.94±0.12)×102L·mol-1。
Tb3+和Ca2+与中心蛋白loopⅠ、loopⅡ的平均结合常数分别为 KⅠ,Ⅱ(Tb3+)=(2.13±0.10)×105L·mol-1和 KⅠ,Ⅱ(Ca2+)=(7.52±0.02)×102L·mol-1[21],分别大约是N-D37K 的 loop Ⅱ结合常数 KⅡ(Tb3+)=(8.31±0.18)×104L·mol-1和 KⅡ(Ca2+)=(0.94±0.12)×102L·mol-1的 3倍和8倍。可以推断Tb3+和Ca2+与中心蛋白loopⅠ的结合能力比loopⅡ大,中心蛋白N端半分子的2个金属结合部位结合能力顺序为Ⅰ>Ⅱ。这与Ye等[22]提出的charge-ligand-balanced模型是一致的。
2.4 金属离子诱导的蛋白构象变化
远紫外圆二色谱可用于研究蛋白质的二级结构。图6是N-EoCen,N-D73K和N-D37K在生理条件下的圆二色谱。可见突变体N-D73K、N-D37K的CD谱与N-EoCen几乎完全重合,表明loop区天冬氨酸的突变没有引起蛋白质二级结构发生大的变化。

图6 N-EoCen、N-D73K和N-D37K的圆二色(CD)光谱Fig.6 Far-UV light CD spectra of N-EoCen and mutants
TNS是一种疏水荧光探针,它在水溶液中量子产率低,基本不发荧光,但在非极性溶液中或者和蛋白的疏水区结合后,其量子产率大增,荧光大大增强,最大荧光峰发生蓝移[23]。将TNS分别加入到apoN-EoCen、Tb3+饱和 N-EoCen 以及 Ca2+饱和 NEoCen中,测得的荧光光谱如图7A所示。可见蛋白质使TNS的最大荧光峰由500 nm蓝移到435 nm,荧光强度增强;Tb3+饱和蛋白的增强效应远大于Ca2+饱和蛋白的效应。表明N-EoCen结合金属离子后暴露出疏水残基、疏水面,即N-EoCen的三级结构在结合金属离子后发生了改变。
用TNS分别滴定N-EoCen,N-D73K和N-D37K的空蛋白、Tb3+饱和蛋白以及Ca2+饱和蛋白,其435 nm处最大荧光强度如图7B所示。从图中可以看出,在没有结合金属离子时,空蛋白使TNS 435 nm处荧光增强,有少部分疏水表面的暴露,而且NEoCen,N-D73K和N-D37K的暴露程度也不相同,37位和73位天冬氨酸的突变导致疏水表面暴露程度减小,即突变在一定程度上改变了蛋白的三级结构;Tb3+饱和蛋白的疏水暴露程度大于Ca2+饱和蛋白,都远大于空蛋白;结合金属离子后,N-D37K的疏水暴露程度较N-EoCen和N-D73K都小得多。说明Asp37突变后,loopⅠ丧失了金属离子结合能力,从而影响了中心蛋白依赖于金属离子的构象变化。

图7 (A)TNS荧光光谱:(a)只有TNS时;(b)加入apoN-EoCen 时;(c)加入 Ca2+-saturated NEoCen时;(d)加入Tb3+-saturated N-EoCen时; (B)Apo-protein,Ca2+-saturated protein 和Tb3+-saturated protein的荧光柱状图Fig.7 (A)Emission fluorescence spectra of TNS alone(a);in the presence of apoN-EoCen(b);Ca2+-saturated N-EoCen(c)and Tb3+-saturated NEoCen(d);(B)Plot of Fluorescence of apo-protein,Ca2+-saturated protein and Tb3+-saturated protein
3 结 论
中心蛋白发挥大部分生物功能都依赖于金属离子,当中心蛋白loopⅠ区37位的天冬氨酸突变为赖氨酸后,loopⅠ丧失了金属离子结合能力,进而影响了其依赖于金属离子的构象变化。说明loopⅠ区37位的天冬氨酸在中心蛋白发挥生物功能时起着重要作用,是不可缺少的。而loopⅡ区73位的天冬氨酸突变为赖氨酸后仍保持金属离子结合能力,依赖于金属离子的构象变化减小。在10 mmol·L-1Hepes、pH 7.4、20 mmol·L-1KCl条件下,中心蛋白loopⅡ与Tb3+以及Ca2+的结合常数分别为KⅡ(Tb3+)=(8.31±0.18)×104L·mol-1和KⅡ(Ca2+)=(0.94±0.12)×102L·mol-1,N 端半分子的 2 个金属结合部位的结合能力顺序为:Ⅰ>Ⅱ。
[1]Huang B,Mengersen A,Lee V D.J.Cell Biol.,1988,107:133-140
[2]Schiebel E,Bornens M.Trends Cell Biol.,1995,5:197-201
[3]Salisbury J L.Curr.Opin.Cell Biol.,1995,7:39-45
[4]Salisbury J L,Suino K M,Busby R,et al.Curr.Biol.,2002,12:1287-1292
[5]Wolfrum U,Giessl A,Pulvermuller A.Advances in Experimental Medicine and Biology.New York:Kluwer Academic Publishers,2002:155-178
[6]Tourbez M,Firanescu C,Yang A,et al.J.Biol.Chem.,2004,279(46):47672-47680
[7]Salisbury J L,Baron A,Surek B,et al.J.Cell Biol.,1984,99(3):962-970
[8]Salisbury J L,Floyd G L.Science,1978,202(4371):975-977
[9]Daunderer C,Schliwa M,Craf R.Eur.J.Cell Biol.,2001,80:621-630
[10]Juan M S,Fatiha K,Liliane A,et al.J.Mol.Biol.,2010,395:191-204
[11]Wiech H,Geier B M,Paschke T,et al.J.Biol.Chem.,1996,271(37):22453-22461
[12]Durussel I,Blouquit Y,Middendorp S,et al.FEBS Lett.,2000,472(2):208-212
[13]Cox J A,Tirone F,Durussel I,et al.Biochemistry,2005,44:840-850
[14]Zhao Y Q,Feng J Y,Ling A H,et al.Spectrochim.Acta Part A,2009,71:1756-1761
[15]Biekofsky R,Turjanski A,Estrin D,et al.Biochemistry,2004,43:6554-6564
[16]Rigden D J,Galperin M Y.J.Mol.Biol.,2004,343:971-984
[17]Wang Z J,Ren L X,Zhao Y Q,et al.Spectrochim.Acta Part A,2007,66:1323-1326
[18]Duan L,Zhao Y Q,Wang Z J,et al.J.Inorg.Biochem.,2008,102:268-277
[19]Bhattacharya D,Steinkter J,Melkonian M.Plant.Mol.Biol.,1993,23:1243-1254
[20]YANG Pin(杨频),YANG Bin-Sheng(杨斌盛).Introduction to Methods of Ion Probe(离子探针方法导论).Beijing:Science Press,1994:9-13
[21]REN Lie-Xiang(任列香),ZHAO Ya-Qin(赵亚琴),FENG Jiu-Ying(丰九英),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22:87-90
[22]Ye Y M,Lee H W,Yang W,et al.J.Am.Chem.Soc.,2005,127:3743-3750
[23]McClure W O,Edelman G M.Biochemistry,1966,5:1908-1919
Roles of Asp37 and Asp73 in the Loop of N-Terminal Domain of Ciliate Euplotes Octocarinatus Centrin
ZHAO BingDUAN Lian LIU Wen ZHAO Ya-Qin YANG Bin-Sheng*
(Institute of Molecular Science,Shanxi University,Taiyuan 030006,China)
Ciliate Euplotes octocarinatus centrin (EoCen)is a member of the EF-hand superfamily of calciumbinding proteins,which often associated with the centrosomes and basal bodies.To explore the importance of Asp37 and Asp73 in the loop of N-terminal of EoCen,the mutants of N-D37K and N-D73K (D is aspartic acid,and K is lysine)were obtained by molecular biological methods.The experiments of aromatic residue-sensitized Tb3+energy transfer demonstrate that:N-D73K can bind two equivalents Tb3+,which is similar to N-EoCen(WTEoCen binds four equiv.Tb3+),and N-D37K can only bind one equivalent Tb3+.Using 2-p-toluidinylnaphthalene-6-sulfonate (TNS)as a hydrophobic probe,exposure of the hydrophobic surface upon metal binding was found to be significantly reduced for the metal ion-saturated N-D37K mutant.The results indicate that Asp37 plays an important role in the biological functions of N-terminal domain of EoCen.Meanwhile the conditional binding constants of the N-EoCen loop Ⅱ were quantitatively found to be KⅡ=(8.31±0.18)×104L·mol-1and KⅡ=(0.94±0.12)×102L·mol-1with Tb3+and Ca2+,respectively,and the order for the metal-binding affinity of the two sites in N-EoCen isⅠ>Ⅱ.
centrin;N-terminal;Tb3+;Ca2+;TNS
O641.1;O614.341;O614.23+1
:A
:1001-4861(2011)02-0245-06
2010-09-06。收修改稿日期:2010-09-25。
国家自然科学基金(No.20771068;20901048)和山西省自然科学基金(No.20901048)资助项目。
*通讯联系人。 E-mail:yangbs@sxu.edu.cn

