糖尿病大鼠蛋白尿与肾脏病理及nephrin表达的相关性研究
屈智慧,杨立志,赵 颖,肖庆飞,崔明姬
(吉林大学第一医院肾内科,吉林长春130021)
糖尿病肾病(DN)是糖尿病慢性微血管并发症之一,是欧美国家导致终末期肾病的主要病因,其早期肾脏病理特征是肾脏肥大、基底膜增厚、细胞外基质增多。临床早期表现为微量蛋白尿,继之出现临床蛋白尿,可致进展性肾功能损害。其早期临床标志是白蛋白尿,而白蛋白尿的产生与一种近年来研究的足突裂孔蛋白nephrin表达减少有关。本研究观察不同时期糖尿病大鼠尿白蛋白的排泄量与大鼠肾脏病理改变及Nephrin蛋白表达的相关系性,为进一步研究糖尿病肾病的发生发展奠定基础。
1 材料与方法
1.1 实验动物 成年清洁级雄性Wistar大鼠40只,购自北京实验动物中心,体质量220±20 g,普通饲料喂养,随意饮水,摄食,室温控制在25℃左右,湿度55%,12小时交替照明。
1.2 动物模型制作与分组 按随机数字表法将40只大鼠分为正常组(NC)与糖尿病模型组(DM),每组大鼠20只。造模前禁食12小时(不禁水),将链脲菌素(STZ)溶于0.1 mmol/L枸橼酸缓冲液,pH4.2,按50 mg/kg一次性腹腔内注射,每日监测尿糖,3天后采尾静脉血测血糖浓度大于16.7 mmol/L,尿糖阳性,确定为糖尿病模型形成。正常组给予等体积的枸橼酸缓冲液一次性腹腔注射。
1.3 标本的采集 分别于0周、4周、8周、12周(各周均指造模成功后的各周末)从NC组与DM组各随机取大鼠5只处死,处死前称体重后置入代谢笼中收集24小时尿液,计尿液总量后取10ml离心,取上清液于-20℃冰箱保存待测。留尿后用乙醚麻醉大鼠,剪尾测血糖,摘眼球取血,离心后取血清-20℃冰箱保存,用于血肌酐、尿素氮的检测。取血后颈椎离断处死大鼠,迅速取出肾脏,右肾去除包膜,生理盐水洗去血迹后称重,用于计算肾重/体重指数(KW/BW)。左肾纵向切开,部分标本用4%多聚甲醛固定48小时,常规制备石蜡切片。连续切片厚3-4 μ m,做常规HE染色与PAS染色,以及免疫组化染色,光镜观察。
1.4 指标的检测 免疫比浊法检测24 h尿白蛋白量。采用Beckman全自动生化仪测定大鼠血尿素氮(BUN),血肌酐(Scr),尿肌酐(Ucr),计算内生肌酐清除率(Ccr),Ccr(ml/min.kg)=Ucr(mg/dl)x每分钟尿量(ml/min)/Scr(mg/dl)/体重(kg)。
1.5 肾组织病理检查 标本用4%多聚甲醛固定48 h,乙醇梯度脱水,二甲苯透明,石蜡包埋切片,连续切片厚3-4 μ m,PAS染色光镜观察。
1.6 肾组织nephrin蛋白免疫组化表达 首先采用SP法,石蜡切片脱蜡水化后,微波修复抗原,3%过氧化氢灭活内源性过氧化物酶活性,PBS洗涤,正常血清封闭非特异性抗原,依次加入一抗山羊抗鼠nephrin多克隆抗体(1∶100,美国Santa Cruz),二抗为滴加生物素化兔抗山羊IgG二抗(福州迈新),DAB显色,苏木精复染,封片,镜检。以PBS代替一抗作阴性对照染色。采用HMIAS2000高清晰度彩色图文分析系统,在高倍镜下每张切片随机选取10个完整肾小球,以胞质出现棕黄色颗粒为阳性信号,分别测量出每个肾小球阳性区面积、阳性区积分光密度,二者相除后得阳性区平均积分光密度值(IOD),再取IOD均值进行免疫组化的半定量分析,代表样本相对阳性表达量。
2 结果
2.1 两组大鼠不同时期体重、肾重/体重指数、24小时尿白蛋白及肌酐清除率(Ccr)的变化
0周时两组大鼠体重无差异,实验期间NC组体重较DM组增长迅速,4周起两组体重在各周比较差异有统计学意义(P<0.05);DM组大鼠肾重/体重指数第4周起,与NC组比较均有增加差异有统计学意义(P<0.05);DM组4周后尿白蛋白开始增加,与同期NC组比较差异有统计学意义(P<0.05),至12周时,DM组尿白蛋白与同期NC组比较差异更加明显(P<0.01);0周时两组大鼠肌酐清除率无差异,第8周时DM组大鼠肌酐清除率增高明显,与同期NC组比较差异有统计学意义(P<0.05),但12周时DM组大鼠肌酐清除率较8周时有所下降,考虑与肾脏损伤加重有关。(见表1)。
表1 两组大鼠不同时期体重、肾重/体重指数、尿白蛋白及肌酐清除率(Ccr)的变化(±s)
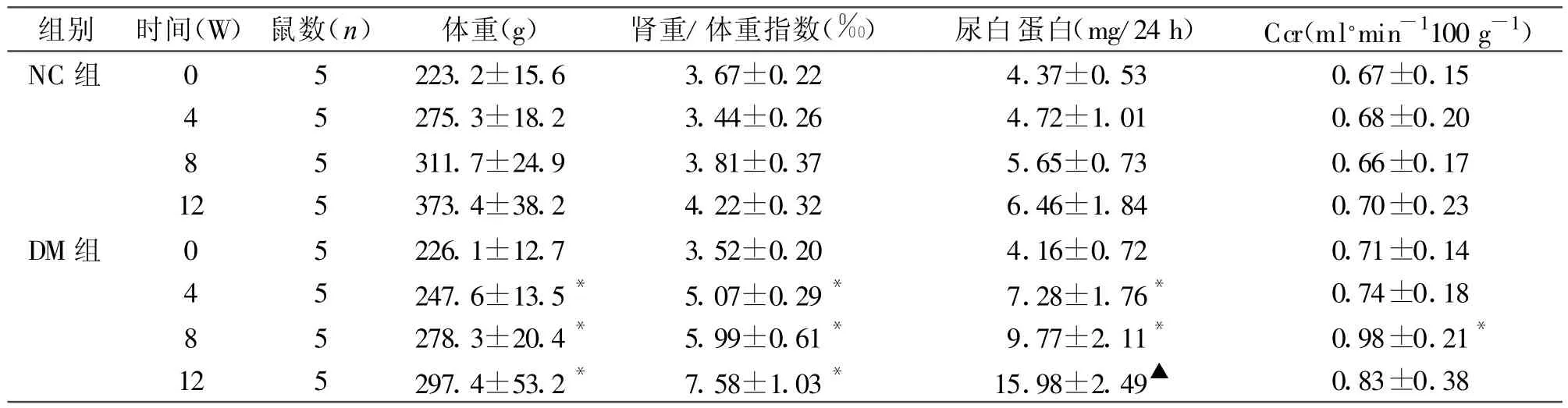
表1 两组大鼠不同时期体重、肾重/体重指数、尿白蛋白及肌酐清除率(Ccr)的变化(±s)
注:与同期NC组比较,*P<0.05,▲P<0.01
组别 时间(W) 鼠数(n) 体重(g) 肾重/体重指数(‰) 尿白蛋白(mg/24 h) Ccr(ml◦min-1100 g-1)NC组 0 5 223.2±15.6 3.67±0.22 4.37±0.53 0.67±0.15 4 5 275.3±18.2 3.44±0.26 4.72±1.01 0.68±0.20 8 5 311.7±24.9 3.81±0.37 5.65±0.73 0.66±0.17 12 5 373.4±38.2 4.22±0.32 6.46±1.84 0.70±0.23 DM组 0 5 226.1±12.7 3.52±0.20 4.16±0.72 0.71±0.14 4 5 247.6±13.5* 5.07±0.29* 7.28±1.76* 0.74±0.18 8 5 278.3±20.4* 5.99±0.61* 9.77±2.11* 0.98±0.21*12 5 297.4±53.2* 7.58±1.03* 15.98±2.49▲ 0.83±0.38
2.2 肾组织病理光镜检查结果
光镜PAS染色显示,整个实验过程中NC组大鼠肾脏组织均未见明显病理学改变。DM组第4周末时,较NC组及本组0周比较肾小球体积增大,系膜区轻度增宽,第8周末肾小球系膜基质增多,系膜细胞明显增多,基底膜增厚,第12周伴有基底膜弥漫增厚,毛细血管塌陷明显。(见图1)。
2.3 肾组织nephrin蛋白的表达
NC组不同时间大鼠肾组织nephrin表达均匀分布于肾小球毛细血管袢,可见棕黄色的nephrin沿基膜呈线形分布。DM组大鼠肾组织nephrin表达从第8周开始不如0周及4周均匀,染色强度减弱,棕黄色线样沉积逐渐变细、变淡,第12周时褪色更加明显。同时测定阳性区肾组织nephrin蛋白的表达量DM组大鼠第8周时较0周、4周降低,第12周时降低更加明显,差异有统计学意义(P<0.05,P<0.01),而NC组大鼠不同时期均无变化。(见图2,表3)。
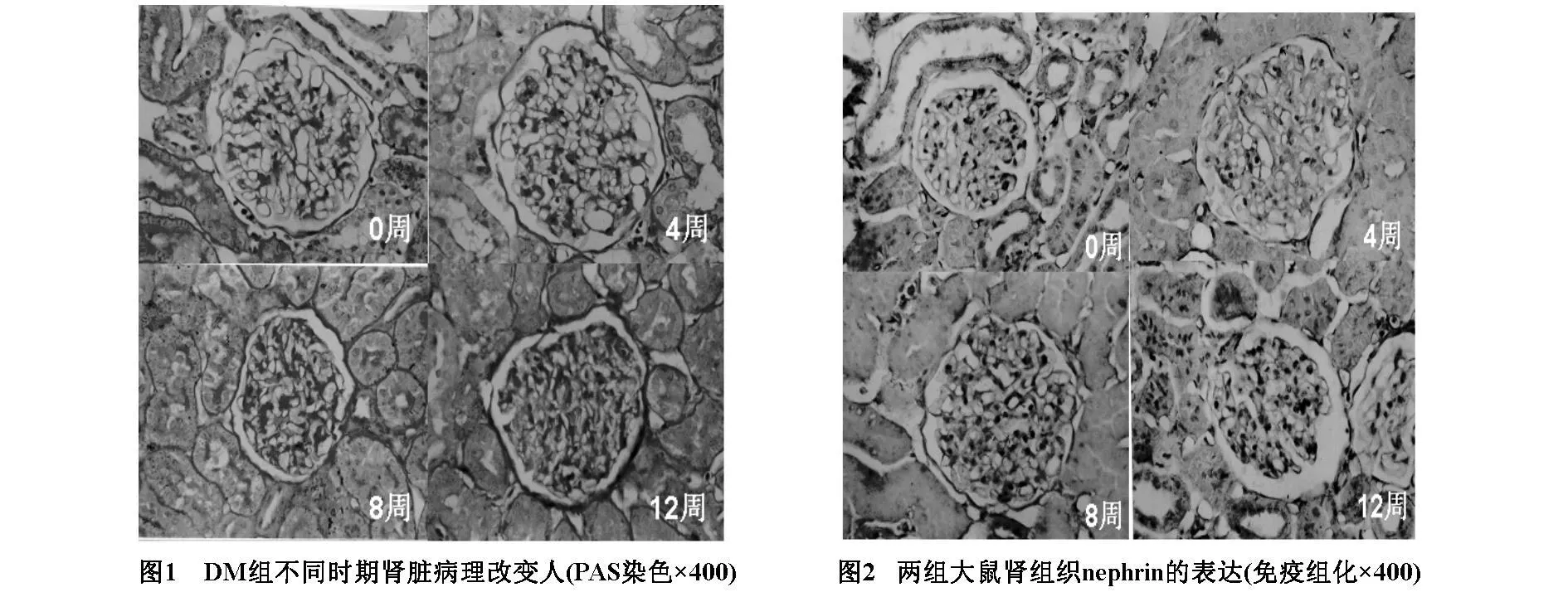
表3 两组大鼠不同时期肾小球nephrin蛋白免疫组化表达量的比较(±s)

表3 两组大鼠不同时期肾小球nephrin蛋白免疫组化表达量的比较(±s)
注:与本组0周比较,*P<0.05,▲P<0.01;
组别 0周 4周 8周 12周NC组 35.26±1.73 37.01±2.11 34.88±2.24 38.47±2.59 DM 组 36.55±1.62 31.79±2.03 24.10±1.85*20.21±1.96▲
3 讨论
近年来随着糖尿病发病率的逐渐增高,对糖尿病肾病的研究也倍受重视,尤其是糖尿病肾病早期白蛋白尿的产生与作用机制。Lin等[1]研究证明DN蛋白尿进展的两个关键因素是足细胞数量的减少及足细胞裂孔蛋白 nephrin的减少。Nephrin蛋白是1998年瑞典教授Karl Tryggvason在研究先天性肾病综合征芬兰型时发现的,它是肾小球滤过屏障上皮细胞足突之间裂孔隔膜上第一个被确定的蛋白[2-3]。其在足突裂孔膜处形成“拉链样结构”,它的缺失或氨基酸序列的改变,会导致裂孔膜的破坏,进而产生大量尿蛋白[4]。
糖尿病不同时期蛋白尿的排泄量及其与nephrin蛋白表达异常关系的研究结果也不尽相同。Doublier等[5]证实糖尿病早期肾小球nephrin蛋白减少,说明nephrin是糖尿病早期肾脏损伤的标志物。Aaltonen[6]等利用PCR检测STZ诱导的糖尿病大鼠肾组织中nephrin mRNA的表达,显示第4周nephrin mRNA平均上调50%,这种趋势一直持续到16周。Bonnet[7]用RT-PCR与免疫组化的方法研究糖尿病自发高血压小鼠,结果发现,随着蛋白尿的出现,肾组织中nephrin mRNA的含量减少,免疫组化染色亦减退。
本研究中发现,DM组第4周时尿白蛋白排泄量开始增加,大鼠肾重/体重指数同步增加,而肌酐清除率第8周时有明显增高,说明尿白蛋白的改变早于肾功能的改变,白蛋白尿是糖尿病早期肾损害的标志。肌酐清除率第12周时有所下降,说明随着糖尿病病程的延长,尿蛋白排泄率不断增加导致肾脏损伤加重。肾组织病理光镜结果发现第4周时只有肾小球体积增大,系膜区轻度增宽,第8周时肾小球系膜基质增多,系膜细胞明显增多,基底膜增厚,待第12周时出现基底膜弥漫增厚,毛细血管塌陷明显。DM组大鼠肾组织nephrin表达从第8周开始不如0周及4周均匀,染色强度减弱,棕黄色线样沉积逐渐变细、变淡,第12周时褪色更加明显。同时测定阳性区肾组织nephrin蛋白的表达量DM组大鼠第8周时较0周、4周降低,第12周时降低更加明显,而NC组大鼠不同时期均无此变化。说明糖尿病肾病临床早期出现微量蛋白尿,继之出现临床蛋白尿,最终进展至肾功能损害,这一系列改变与足细胞裂孔蛋白nephrin的表达有相关性。
总之,我们认为糖尿病大鼠随着糖尿病病程的延长,尿蛋白排泄率不断增加与肾脏病理损伤的严重程度有关,且与肾组织nephrin的表达相关,足细胞裂孔蛋白nephrin是糖尿病肾损伤的早期标志。应该更加深入定量研究nephrin蛋白在糖尿病不同时期的作用,为降低糖尿病肾病的发生率开辟一个新的道路。
[1]Lin CL,Wang FS,Hsu YC,et al.Modulation of Notch-1 signaling alleviates VEGF-mediated diabetic nephropathy[J].Diabetes,2010,59:1561.
[2]Tryggvason,K.Unraveling the mechanisms of glomerular ultrafiltration:nephrin,a key component of the slit diaphragm[J].J Am Soc Nephrol,1999,10:2440.
[3]Wickelgren I.First component found for new kidney filter[J].Science,1999,286:225.
[4]Welsh GI,Saleem MA.Nephrin-signature molecule of the glomerular podocyte?[J].J Pathol,2010,220:328.
[5]Doublier S,Salvidio G,Lupia E,et al.Nephrin expression is reduced in human diabetic nephropathy:evidence for a distinct role for glycated albumin and angiotensin II[J].Diabete,2003,52:1023.
[6]Aaltonen P,Luimula P,Astrom E et al.Changes in the expreesion of nephringene and protein in experimental diabetic nephropathy[J].Lab Invest,2001,81:1185.
[7]Bonnet F,Cooper ME,Kawachi H,et al.Irbesartan normalises the deficiency in glomerular nephrin expression in a model of diabetes and hypertension[J].Diabetologia,2001,44(7):874.

