葡萄糖6-磷酸异构酶在类风湿性关节炎诊断中的意义
崔丽艳,胡晓舟,张文静,张 捷
(北京大学第三医院检验科,北京100191)
类风湿性关节炎(RA)是一种常见的慢性炎症性疾病,病因不是很清楚,主要表现为关节受损。关节内及关节外自身抗体的存在是RA的特征之一。自身抗体的检测如类风湿因子是最常用的诊断和预测指标[1]。RA患者对自身抗体的反应是不同的。大约70-80%的RA患者体内存在RF,其他自身抗体比如抗C1q抗体[2]和抗中性粒细胞胞浆抗体[3]则很少出现。然而,RF也在其他自身免疫性疾病、感染性疾病和3-5%的健康人(老年人时增加到10-30%)血清中存在[4],表明类风湿因子对RA不是很特异。葡萄糖-6-磷酸异构酶(GPI)是一种广泛表达并且具有多种功能的蛋白质,它是能量循环过程和糖分解过程中必不可少的胞浆酶,同时它又作为细胞外信号传导分子。众所周知,GPI是自分泌运动因子和神经细胞因子,可能在肿瘤和自身免疫方面起着一定的作用[。5,6另]外,文献[7]报道,GPI可以引起DBA/1小鼠关节炎,支持GPI在小鼠的自身免疫过程中发挥着一些直接作用。因此本研究通过分析RA患者血清中GPI、RF、CRP、ESR的独立检测的水平以及联合检测来探讨其对于RA诊断的意义。
1 资料与方法
1.1 研究对象
1.1.1 RA组 选择2007年12月至2008年9月北京大学第三医院风湿免疫科门诊和住院患者39例,其中男性13例,女性26例,年龄20-83岁,平均年龄(61±16)岁,所有患者均符合美国风湿病协会(ACR)1987年修订的RA诊断标准。
1.1.2 非RA组 同期在我院门诊就诊和住院的患者52例,其中男性18例,女性34例,年龄19-83平均年龄(54±17)岁,均符合国内或国际相应的诊断标准。其中系统性红斑狼疮患者23例,混合型结缔组织病2例,强直性脊柱炎6例,干燥综合征10例,未分化结缔组织病3例,多发性肌炎/皮肌炎5例,脊柱关节病2例,肠病性关节炎1例。
1.1.3 健康对照组 我院体检健康者32例,其中男性10例,女性22例,年龄26-81平均年龄(53±16)岁。
1.2 研究方法
1.2.1 标本的采集与保存 所有病例均空腹采集静脉血3 ml,分离血清,-80℃冰箱备用。所有标本一次冻融后测定。
1.2.2 试剂及测定方法 GPI试剂盒和抗原标准品均由上海北加生化试剂公司提供,采用双抗体夹心酶联免疫吸附法(ELISA)检测血清中GPI;RF-IgM和CRP所有试剂均由贝克曼库尔特公司提供,方法为速率散射比浊法,在IMMAGE双光径免疫浊度分析仪上完成测定;ESR为动态血沉测定法,所用血沉仪由北京健峰公司提供。
1.3 统计学处理
采用SPSS10.0统计学软件进行数据分析。符合正态分布的数据以±s表示,不符合正态分布的数据以中位数(25%-75%分位数)表示。符合正态分布的数据的组间比较采用独立样本t检验,不符合正态分布的数据的组间比较采用非参数检验。诊断的敏感性、特异性、准确性通过计算得到,各项指标的诊断价值的比较通过ROC曲线得到。用配对资料McNemar χ2检验和Spearman相关分析,评价诊断指标之间的差异及相关性。
2 结果
2.1 RA组与非RA组、对照组之间各项指标的比较 RA组GPI、RF、CRP、ESR 水平均明显高于非 RA组和正常对照组,差异具有显著性(P<0.05)。各指标在非RA组和正常对照组之间比较没有差异(P>0.05),各组之间性别以及年龄进行比较,统计学上没有显著差异(P>0.05),说明在病例的选择上各组之间没有差异。结果见表1。
2.2 GPI与 RF、CRP、ESR的相关性分析 GPI与RF具有明显的正相关(r=0.576 P<0.05),GPI与ESR、CRP也具有明显的正相关(r=0.411 P<0.05;r=0.422 P<0.05)。

表1 患者的一般资料
2.3 GPI、RF、CRP及 ESR的 ROC曲线 GPI、RF、CRP及ESR四项检测指标的曲线下面积分别为0.821、0.783、0.687、0.709,GPI与 CRP、ESR 的曲线下面积比较均有显著性差异,差异具有统计学意义(P<0.05)。其余各检测项目间比较均无显著差异(P>0.05)。见图1及表2。
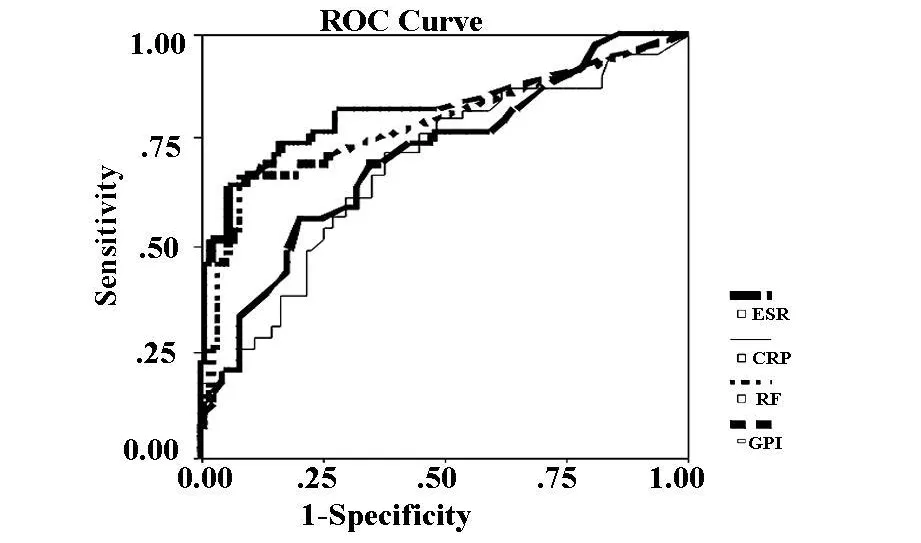
图1 GPI、RF、CRP及ESR的ROC曲线
2.4 诊断的敏感性、特异性及准确性分析 根据ROC曲线,以敏感性及特异性之和最大的点作为诊断界值,GPI、RF、CPR及ESR诊断 RA的敏感性、特异性及准确性见表3。GPI与RF联合检测的敏感性、特异性及准确性分别为89.7%[80.2%-99.3%] 、72.6%[58.6%-86.6%]和 78.1%[65.1%-91.0%]。四项指标单独检测的敏感性无显著性差异(P>0.05),特异性及准确性GPI与RF明显高于CRP与ESR,具有统计学意义(P<0.05),但是GPI与RF之间以及CRP与ESR之间均无显著性差异(P>0.05)。GPI与RF联合检测的敏感性明显高于二者单独检测(P<0.05),特异性没有显著差异(P>0.05),准确性明显高于RF(P<0.05)。
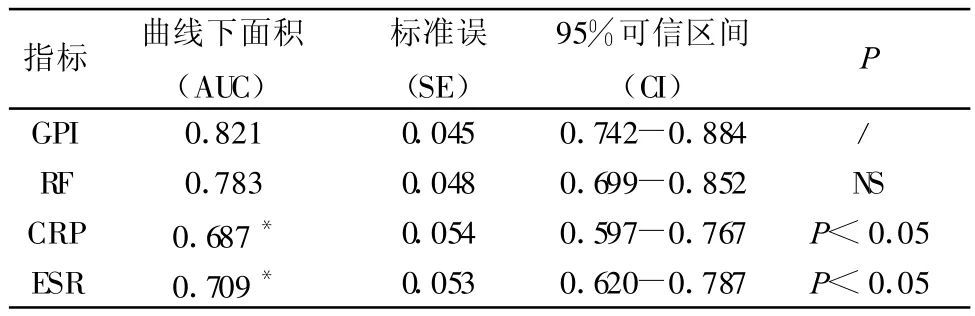
表2 各项指标检测的ROC曲线分析
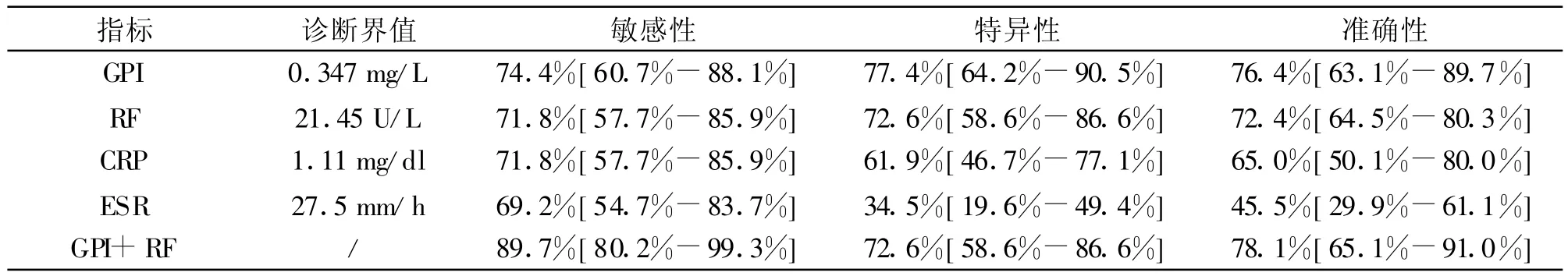
表3 各项指标单独检测及联合检测诊断RA的敏感性、特异性及准确性
3 讨论
类风湿性关节炎(RA)的发病是多因素作用的结果,包括遗传因素可能的作用、环境因素、免疫机制和使炎症发生的细胞因子网络的作用[8-11]。然而疾病发生发展的机制仍然不是很清楚。RA和特定的HLA-DR,CD4+T细胞的关系是在关节炎的启动和发展过程中起作用[12]。自身抗体在RA和其他各种炎症性关节炎中的病理作用还不是很明确,但是使用T细胞受体转基因关节炎小鼠模型K/BxN进行研究发现,葡萄糖-6-磷酸异构酶(GPI)可以作为B细胞和T细胞的自身抗原,将抗GPI抗体转移到NA?VE小鼠体内可以诱导与人类RA特征相似(不是完全相同)的关节炎的特征[13]。
研究结果显示,RA患者GPI、RF、CRP及 ESR水平明显高于对照组。有文献报道,对GPI的自身免疫反应可以自发的诱导K/BXN T细胞受体转基因小鼠的关节炎[7]可以推测GPI在人类关节炎的发生过程中起了重要作用,同时也证明了GPI不是类风湿性关节炎的疾病特异性抗体,而是与广泛的免疫相关的炎症性关节炎相关的一种抗原。阻断此种抗原的作用可能有助于改善疾病的预后。
GPI与RF、ESR及CRP具有明显的正相关,此结果提示我们在关节炎的发病过程中是多种因素联合作用的结果,文献[13-15]报道GPI可以诱导类风湿性关节炎的发生,CRP、ESR作为反映类风湿性关节炎患者关节炎症程度的指标。这些结果提示血清中GPI可能参与了关节炎症的发生。
通过ROC曲线分析,四项检测指标的曲线下面积按由高到低的顺序排列分别为GPI(0.821)、RF(0.783)、ESR(0.709)、CRP(0.687),但 GPI与 RF 的曲线下面积比较无显著性差异。四者单独检测的敏感性由高到低依次为GPI(0.744)、RF(0.718)CRP(0.718)、ESR(0.692),特异性由高到低的顺序为GPI(0.774)、RF(0.726)、CRP(0.619)、ESR(0.345),准确性由高到低依次为 GPI(0.764)、RF(0.724)、CRP(0.650)、ESR(0.455)。而将GPI与 RF联合检测后诊断的敏感性(0.897)及准确性(0.781)提高了,特异性(0.726)与单独检测GPI没有显著性差异。敏感性提高,特异性没有显著差异,与我们所选择的联合检测的方式相关。单独检测GPI与以往的RF、CRP、ESR等指标相比,没有明显的优势,但是将GPI与RF联合检测提高了诊断的敏感性及准确性,因此在临床上我们可以二者联合进行检测,对患者的早期诊断具有重要的意义。但是我们需要收集更多的病例来验证该实验结果,并且对患者进行随访,观察该指标对患者预后判断的作用,这对于临床工作将更有意义。
[1]Bl ä ss S,Engel JM,Bur mester GR.The immunologic homunculus in rheumatoid arthritis[J].Arthritis Rheum,1999,42(12):2499.
[2]Siegert CE,Daha MR,van derVoort EA,et al.IgG and IgA antibodies to the collagen-like region of C1q in rheumatoid vasculitis[J].Arthritis Rheum,1990,33(11):1646.
[3]Coremans IE,Hagen EC,Daha MR,et al.Antilactoferrin antibodies inpatientswith rheumatoid arthritis are associated with vasculitis[J].Arthritis,Rheum,1992,35(12):1466.
[4]Mageed RA.The RF antigen.In:van Venrooij WJ,Maini RN,editors.Manual of Biological Markers of Disease[M].Dordrecht:Kluwer Academic Publishing,1996.
[5]Sun YJ,Chou CC,Chen WS,et al.The crystal structure of a multifunctional protein:phosphoglucose isomerase/autocrine motility factor/neuroleukin[J].Proc Natl Acad Sci USA,1999,96(10):5412.
[6]Chou CC,Sun YJ,Meng M,et al.The crystal structure of phosphoglucose isomerase/autocrine motility factor/neuroleukin complexedwith its carbohydrate phosphate inhibitors suggests its substrate/receptor recognition[J].J Biol Chem,2000,275(30):23154.
[7]Schaller M,Burton DR,Ditzel HJ.Autoantibodise to GPI in rheumatoid arthritis:linkage between an animal model and human disease[J].Nat Immunol,2001,2(8):746.
[8]Arend WP.The innate immune system in rheumatoid arthritis[J].Arthritis Rheum,2001,44(10):2224.
[9]Corrigall VM,Panayi GS.Autoantigens and immune pathways in rheumatoid arthritis[J].Crit Rev Immunol,2002,22(4):281.
[10]Hirano T.Revival of the autoantibody model in rheumatoid arthritis[J].Nat Immunol,2002,3(4):342.
[11]Klareskog L,Lorentzen J,Padyukov L,et al.Genes and environment in arthritis:can RA be prevented?[J].Arthritis Res,2002,4(Suppl 3):S31.
[12]Panayi GS,Lanchbury JS,Kingsley GH.The importance of the T cell in initiating and maintaining the chronic synovitis of rheumatoid arthritis[J].Arthritis Rheum,1992,35(7):729.
[13]Matsumoto I,Staub A,Benoist C,et al.Arthritis provoked by linked T and B cell recognition of a glycolytic enzyme[J].Science,1999,286(5445):1732.
[14]SchallerM,Burton DR,Ditzel HJ.Autoantibodies to GPI in the rheumatoid arthritis:linkage between an animal model and human disease[J].Nat Immunol,2001,2(8):746.
[15]Maccioni M,Zeder-Lutz G,Huang H,et al.Arthritogenic monoclonal antibodies from K/BxN mice[J].J Exp Med,2002,195(8):1071.

