胰腺癌患者血清中CA199、CA242、CA125、CEA 检测分析
吴爱祝,梁 茱,王海枫
(海南省人民医院中心实验室,海南海口570311)
本实验应用多肿瘤标志物蛋白芯片检测系统对133例胰腺癌和87例胰腺炎患者,以及1150例健康体检者血清标本作对照进行了肿瘤标志物CA199、CA242、CA125、CEA 的检测,初步评价多肿瘤标志物检测系统对胰腺癌患者的临床应用价值。
1 材料与方法
1.1 检测对象 胰腺癌组患者为海南省人民医院2004年12月-2009年12月住院病人共133例,均经病理检查确诊。其中男性88例,女性45例,平均年龄58岁。胰腺炎病人组87例,男性52例,女性35例,平均年龄50岁。健康对照组为我院保健科同期体检者1150例,体检中其它检查未发现任何肿瘤,男性767例,女性383例,平均年龄46.8岁。
1.2 仪器和试剂 HD-2001A型系列生物芯片检测仪和多肿瘤标志物蛋白芯片检测试剂盒均由上海数康生物科技有限公司研制生产。
1.3 检测方法
1.3.1 样本收集 抽取空腹静脉血2 ml,2 000 rpm离心8 min,吸出血清移至另一干净的EP管内4℃保存5天内检测。去除溶血和黄疸血样本,脂血样本10 000 rpm离心5 min后取下层血清检测。
1.3.2 操作步骤 严格按照试剂盒操作说明书进行。
1.3.3 结果判定 肿瘤标志物的临界值为CA199<35U/ml;CEA<5 ng/ml;CA242<20 KU/L;CA125<35 KU/L。超过临界值计算机自动判定为阳性。
1.3.4 统计学方法 使用SAS9.13统计软件进行统计分析,各项数据进行正态性分析,为非正态分布以中位数、极差表示,组间比较采用多组秩和检验。
2 结果
2.1 正常对照组、胰腺癌组和胰腺炎组阳性率比较 表1中胰腺癌患者多肿瘤标志物联合检测CA19-9阳性率最高,为 79.6%,其次为 CEA阳性率为68.4%,CA242阳性率为50.4%,CA125阳性率为42.1%。胰腺癌组阳性率84.5%显著高于炎症组阳 性率28.7%和健康体检对照组阳性率1.6%。
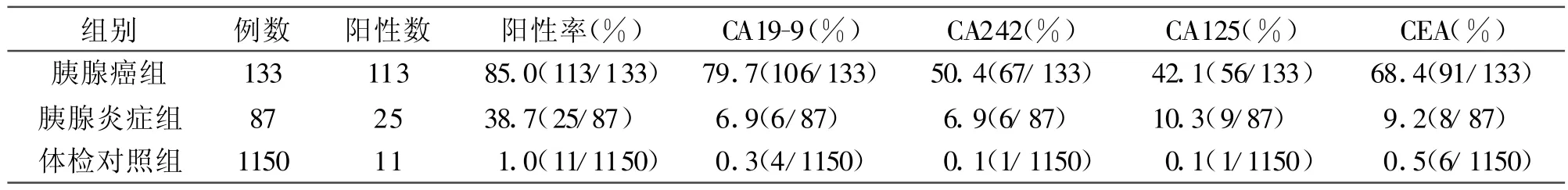
表1 胰腺癌组、胰腺炎组、健康体检对照组三组血清中 CA19-9、CA242、CA125、CEA阳性率
2.2 健康体检对照组、胰腺癌组和胰腺炎组患者血清中四种肿瘤标志物定量检测(以中位数表示)结果胰腺癌组CA199、CEA、CA242、CA125与健康体检对照组比较,与胰腺炎组比较,差异均有显著性(P<0.01)。胰腺炎组与健康体检对照组无显著差异。见表2。
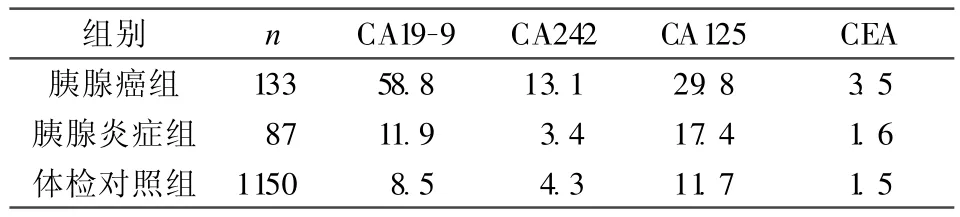
表 2 三组血清中 CA19-9、CA242、CA125、CEA定量检测(中位数)
2.3 表3中30例胰腺癌患者手术前及术后各测定1次血清CA199、CEA 、CA242、CA125 水平,结果分析手术前高于手术后(P<0.05)。
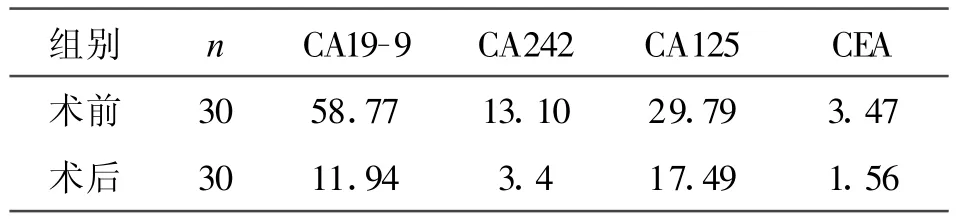
表3 胰腺癌患者中 CA19-9、CA242、CA125、CEA水平(中位数)
2.4 四项标志物联合检测分析敏感度最高,达89.6%。见表4。

表4 四种肿瘤标志物及联合检测诊断胰腺癌的敏感度、特异性(%)
3 讨论
胰腺癌是具有恶性程度高、发展较快、预后较差的特点,早期往往无明显症状及体征,且影像学检查结果也不令人十分满意,往往错过了最佳的治疗时机。所以早期发现、早期诊断、早期治疗是提高生存率的关键,肿瘤标志物的问世无疑是令人兴奋的,人们一直在努力寻找高灵敏度、高特异性的肿瘤标志物。目前临床上常用的肿瘤标志物灵敏度、特异性不够高,器官特异性也不强。但联合检测可以提高其灵敏度和特异性[1]。蛋白芯片能一次检测提供几种肿瘤标志物的大量信息,符合多种肿瘤标志物联合检测提高肿瘤早期诊断的阳性率和准确率的要求。本实验结果显示:进行了肿瘤标志物CA199、CA242、CA125、CEA的检测胰腺癌阳性率为84.5%,炎症组和健康对照组的阳性率分别为38.7%和1.6%,胰腺癌的阳性率显著高于炎症组和健康体检对照组(P<0.01)。30例胰腺癌患者手术前四项肿瘤标志物的水平表达高于手术后;联合检测以上四种肿瘤标志物诊断胰腺癌的敏感、特异性均高于单一标志物检测。与国内一些报道相似[2,3]。
总之,联合检测血清中 CA199、CA242、CA125、CEA对胰腺癌的辅助诊断,疗效观察、病情监测等均有一定的价值。
[1]中华医学会检验医学分会肿瘤标志物专家委员会.肿瘤标志物临床检测的基本原则[J].中华检验医学杂志,2004,27:273.
[2]夏 峰,郑 姬,王曙光,等.多肿瘤标志物的联合检测和分析对胰腺癌诊断的价值探讨[J].消化外科,2006,5(2):111.
[3]彭 莉,李春岚,朱传金,等.肿瘤标志物联合检测在胰腺癌的诊断中的应用[J].肿瘤基础与临床,2006,19(1):30.

