关于“熵增原理”表述的争鸣
高盘良
(北京大学化学与分子工程学院 北京 100871)
目前熵增原理数学表述大致有3种方式
(1) ΔS隔离≥0(>为不可逆过程;=为可逆过程)[1]。
(2) ΔS隔离≥0(>0 不可逆,自发;=0 可逆,平衡)[2-4]。
(3) ΔS孤立体系<0不可能发生的过程;>0 不可逆过程;=0可逆过程[5]。
表述(3)把过程分为两类:不可能发生的过程和可能发生的过程,其中可能发生的过程中又分为不可逆过程及可逆过程;表述(1)与表述(3)是一致的。
表述(2)有两个问题值得讨论:① 不可逆与自发能否等同或并列起来?② 可逆与平衡,其中平衡是指平衡过程,还是指平衡态?如是平衡过程,则与可逆过程是完全相同的表述,这样表述属于“画蛇添足”,是多余的。如是平衡态,据熵是状态函数的性质应无熵变。据文献[2]:“在隔离体系中过程总是自发地朝着熵值增加的方向进行,而当达到熵值最大的状态时,体系处于平衡态”,从而得出ΔS隔离≥0(>0 不可逆,自发;=0 可逆,平衡),此处的平衡明确是指平衡态。ΔS隔离=0不是熵极大的数学判据将在本文的第2部分分析。
为了分析上述问题,必须从热力学第二定律要解决的问题:方向和限度这个大前提来讨论。
1 变化方向:不可逆与自发能否等同或并列起来?
为了研究不可逆与自发的关系,必须从热力学过程的基本概念说起。系统的宏观态随时间而变,说明系统进行着宏观过程或热力学过程[6-7],改变系统宏观平衡态需要系统与环境之间发生相互作用。当一个系统从一个状态变化至另一状态时,系统即进行了一个过程,系统可以从同一始态出发,经不同的途径变化至同一终态[6-7],也就是说,从同一始态出发,可经过可逆与不可逆两种途径变化至同一终态。因此,热力学过程应包含3个要素:系统(主体),环境(与系统发生热力学相互作用),方式(可逆和不可逆)。
如膨胀和压缩过程:膨胀过程是公认的自发过程(相同始态和终态间),一次或多次对抗等外压膨胀,ΔS隔离>0属不可逆过程;无限缓慢减压,ΔS隔离=0 属可逆过程。自发过程的逆过程压缩过程不可能自动发生,是公认的非自发过程,需借助外力(环境)才能恢复到始态,一次或多次加压,ΔS隔离>0 属不可逆过程;无限缓慢加压,ΔS隔离=0属可逆过程。
以上说明不可逆与自发不等同,不可逆过程ΔS隔离>0存在不可消除的后果,可逆过程ΔS隔离=0不存在不可消除的后果,可逆与不可逆是热力学上的专有名词,有严格的科学内涵,不能简单地理解为一般生活语言,由不可逆→单向性→自发。自发过程ΔS隔离>0,但ΔS隔离>0未必一定是自发过程,肯定是不可逆过程。
表述(2)的熵增原理在教材中引来了一些混乱。如:① 一些物理化学的题解书中把ΔS隔离>0的过程(如压缩过程明显不属于自发过程)一概都称为自发过程。② 文献[2]中有一个思考题:自发过程一定是不可逆过程,而不可逆过程一定是自发的。上述说法对吗?为什么?书中给出的答案是:第一句对,第二句错。因为不可逆过程可以是非自发的,如自发过程的逆过程。同一本书自相矛盾,此处的答案基本是对的,错误的是表述(2)。③ 有一本光催化的学术著作把光合作用写成了自发反应:“CO2光还原反应是因为它在光催化过程中是自然(发)发生的……”[8]。在此不一一列举。
对于自发过程一直存在着两种意见:在热力学原理的表述和教学中有没有必要讲自发过程?本文暂不讨论这个问题。但造成以上混乱的根本原因在于自发过程缺乏科学的定义,各人都有自己的理解。下面看看国内物理化学教材关于自发过程的不同的典型定义。
(1)定义一:“在一定条件下,不需要外力推动,任其自然就能自动发生的过程,称为自发过程”[9]; “‘自发过程’或‘自动过程’,是指无需外力帮助,顺其自然,就可以发生的过程”[10]。
这个定义为许多教师所接受,但有两点美中不足:一是忽略了环境在自发过程中的作用, “任其自然”或“顺其自然”是把环境当作旁观者,而环境是热力学过程的三要素之一,任何热力学过程都存在系统与环境间的热力学相互作用。二是没有明确指出环境对过程的双重作用。如系统始态为2pӨ,只有在环境的压力小于2pӨ时,膨胀过程才能自发进行,反之,可能发生非自发的压缩过程。因此,建议改为“在无需对系统作功的环境T、p条件下,能自动发生的不可逆过程,称为自发过程”。
(2)定义二[3]:在自然条件下,能够发生的过程,称为自发过程。自发过程的逆过程称为非自发过程。所谓自然条件,是指不需要人为加入功的条件。需要说明的是,若在大气环境的恒压条件下,系统的体积缩小时,它自然得到恒压体积功,但这是维持恒压条件的自然结果,而并非人为加入的功,故仍属自发过程。所谓人为地加入功,是指人为地加入压缩功或电功等非体积功。……自然条件下自发过程是热力学中的不可逆过程……。使自发过程的逆过程能进行,环境必须对系统作功。
一个如此冗长的定义让人费解,但还是没有把自发过程说清楚。有以下一些问题:① 自然条件除了不需要人为加入功以及温度和压力如人们一般认为的常温常压外,高温高压甚至极端条件下还存在自发过程吗?② 对于功的理解一般分为体积功、有用功、表面功……,现在又提出人为加入的功和非人为加入的功,而又把压缩功与有用功归入人为加入的功,对初学热力学的学生如不产生混乱,至少是过于繁琐,不利于对原理的理解。③ 人为地加入功而发生的过程是非自发过程,但同一作者在文献[4]中提出“隔离系统与环境间没有任何能量交换,若其内部发生不可逆过程,那一定是自发过程”。但隔离系统是人为划分的,可以把电源、光源包括在新的隔离系统中, 电解用的电源与水组成新的隔离系统,产生氢和氧,熵增了, 在封闭系统中不自发的过程,放到“隔离系统”中, 就成了自发过程了,好像变戏法一样。据此类推,这世界上就没有不自发的过程了,物理化学中就没有必要讨论自发与非自发过程了。④ 此定义认为“自然条件下自发过程是热力学中的不可逆过程”,那么自然条件下的非自发过程(ΔS隔离>0)是不是热力学不可逆过程?如是,又为什么不可逆过程只列自发而不列非自发,前述的混乱是否与此有关呢?
有人建议对热力学第二定律的熵增原理作如下表述[11]:任意封闭体系加环境可当作孤立体系,称为总体(universe)。ΔS总体=(ΔS体系+ΔS环境)>0能发生不可逆过程;=0能发生可逆过程;<0根本不能发生。这样的表述把发生过程的主体(系统或体系)与保证过程发生的环境合在一起,称为总体,以免与隔离系统中的系统相混淆;把实际发生的过程(无论自发或非自发)都认定为不可逆过程;以上发生过程的系统都是封闭系统,这与热力学第二定律的表述就一致了。
2 过程限度与平衡的稳定性
表述(2)的后半部分是ΔS隔离=0可逆,平衡;或文字表述如文献[2]“在隔离体系中过程总是自发地朝着熵值增加的方向进行,而当达到熵值最大的状态时,体系处于平衡态”,这里把熵值最大的状态称为平衡态。这样表述有两点不足:① 没有明确“达到反应限度的平衡态是稳定平衡态”。② ΔS隔离=0不是熵极大的数学判据。
首先,稳定态有稳定平衡态和亚稳平衡态。何谓稳定平衡态?“事物的稳定性不仅指的是处在一定条件下的事物具有永久不变性,而更为主要的是指事物有一定的抗干扰能力[6-7]。” “亚稳平衡态是某种热力学系统处于某种平衡态的特殊情况。系统处于亚稳态也满足平衡条件和稳定性条件。但是该系统往往受外界小的干扰即向稳定的平衡态过渡。例如通常过冷液体或过饱和气体就是处于亚稳态”[12]。它们的数学判据为[6-7]:“对于U、V固定的封闭体系(它具有体积为外参量),熵为严格极大的态是体系的稳定平衡态”;“等温等压只有体积为外参量的封闭体系,Gibbs自由能为严格极小的态是体系的稳定平衡态”,而亚稳态只满足极值的条件(一级微商等于0),而不满足严格极值的条件(二级微商<或>0)。
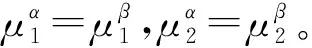
以上说明,ΔS隔离=0不是熵极大的判据,更不是稳定平衡态(变化限度)的判据。至于与此有关的对热力学第二定律为基础的化学平衡和相平衡中的理解错误就不在此一一列举了。
参 考 文 献
[1] 韩德刚,高执棣,高盘良.物理化学.第2版.北京:高等教育出版社,2009
[2] 孙世刚.物理化学(上).厦门:厦门大学出版社,2008
[3] 天津大学物化教研室.物理化学(上册).第5版.北京:高等教育出版社,2009
[4] 天津大学物化教研室.物理化学(简明版).北京:高等教育出版社,2010
[5] 范康年.物理化学.第2版.北京:高等教育出版社,2005
[6] 韩德刚,高执棣.化学热力学.北京:高等教育出版社,1997
[7] 高执棣.化学热力学基础.北京:北京大学出版社,2006
[8] 张金龙.光催化.上海:华东理工大学出版社,2004
[9] 沈文霞.物理化学核心教程.北京:科学出版社,2004
[10] 胡英.物理化学.第5版.北京:高等教育出版社,2007
[11] 朱志昂,阮文娟.近代物理化学(上).第4版.北京:科学出版社,2008
[12] 徐龙道.物理学词典.北京:科学出版社,2004

