从海带中提取碘的实验教学设计与改革
盖利刚 姜海辉 马万勇
(山东轻工业学院化学工程学院 山东济南 250353)
碘是动植物和人体的必需微量元素,也是制备无机和有机碘化物的基本原料。虽然海水中碘含量甚低,但海带、海藻等一些海洋植物具有选择性吸收和富集碘的能力[1]。据文献报道[2],海带中碘含量一般在0.3%以上,最高可达0.7%~0.9%;我国海带碘含量多数在0.5%左右。由于海带价廉易得,可作为实验室提取碘的原料[1-5]。
从海带中提取碘是大学化学综合设计型实验的常见实验。以海带为原料提取碘,主要有灰化法、发酵法和浸出吸附法[6]。发酵法和浸出吸附法很容易将海带中的有机物(如甘露醇等)引入海带提取液中,给后续碘的提取,特别是采用有机溶剂萃取分离获碘[1-3]增加难度。灰化法是实验室从海带中提取碘所广泛采用的方法[1-5]。根据具体实验流程的差别,灰化法提取碘又包括加热升华[4-5]和溶剂萃取两条路线[1-3](图1)。
加热升华法能直观地看到紫色的碘蒸气,实验现象明显;但凝华在试管或烧瓶底部的碘单质很难收集,故用此法难以计算海带中碘的百分含量。有机溶剂萃取法能够从碘的水溶液中富集和分离碘,但如何将碘单质和有机溶剂分离开来,是该方法难以解决的问题。利用碘遇淀粉变蓝只能用于含I2溶液的定性分析,采用氧化还原滴定虽能对含I2溶液进行定量分析,但收集不到单质碘。周令芬[1]采用NaNO2氧化、CCl4萃取法得到碘的CCl4溶液,再加入NaOH水溶液使碘歧化转入水溶液,将含碘水溶液分离、酸化、冷冻干燥得到了单质碘;但文献[6]没有给出从定量海带中提取的单质碘的质量,而且NaNO2氧化法能生成NO(NO在空气中进一步被氧化成NO2(有毒)),冷冻干燥实验周期长,不适合在大学化学实验教学中推广。
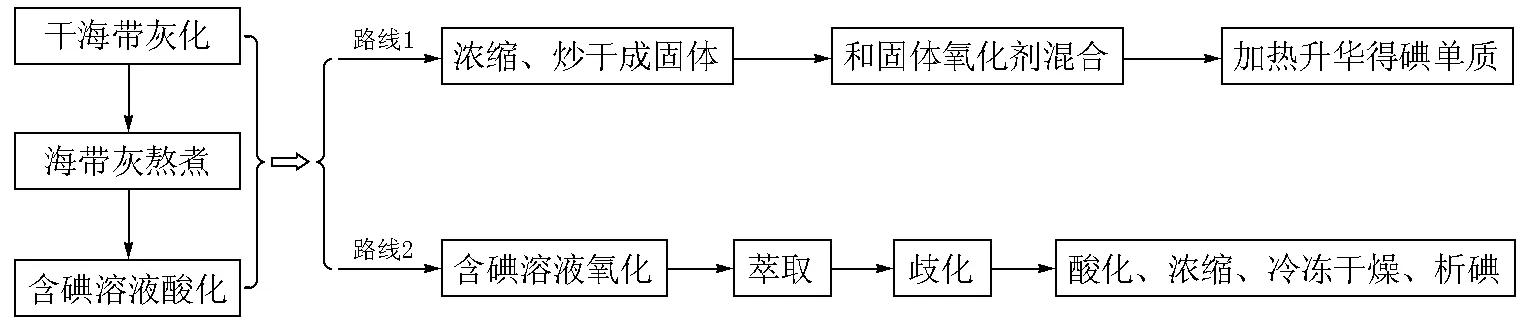
图1 灰化法从海带中提取碘的实验路线
本实验对上述从海带中提取碘的实验作了改进,在实验中融入绿色化学理念,对实验内容和实验要求进行了重新设计。主要体现在以下4点:(1)用海带碱溶法代替海带灰化法,既可以将海带中的碘有效地转移至水溶液中,又避免了海带灰化过程所造成的空气污染和能量消耗。(2)以双氧水为氧化剂,采用电位滴定法控制I-的氧化程度,可避免生成I2的过氧化。(3)以沸点低、极性小的无水乙醚为萃取剂,既可以避免富集I2过程中混入极性有机物(如甘露醇等),又可以使I2和萃取剂有效分离;得到的I2收率较高、可用差量法称量。(4)实验内容既包含萃取、减压分离和氧化还原滴定等基本操作,又涉及酸度计、电位滴定仪和分光光度计的使用,体现了化学分析和仪器分析的有机结合。
1 实验目的
(1) 认识从植物中提取化学品的价值和意义,了解单质碘的用途。
(2) 熟悉碘离子、碘酸根和单质碘的化学反应和单质碘的测定方法。
(3) 熟悉萃取、减压蒸馏和氧化还原滴定等基本操作。
(4) 学习酸度计、电位滴定仪和分光光度计的使用。
2 实验原理
(1) 海带中的碘主要以碱金属碘化物[4]和有机碘化物[7]形式存在。加入碱溶液将海带中的有机碘转化为碱金属碘化物,以提高海带中I-向水溶液的转移程度。调溶液至指定pH,将含I-水溶液氧化、析碘;再用无水乙醚萃取、干燥、减压分离,得单质碘。
(2) 电位滴定氧化析碘。向酸化的I-的水溶液中滴加一定浓度的双氧水,在滴定过程中监测指示电极的电位变化,根据反应生成I2的物质的量的变化所引起的电极电位突跃,来确定滴定终点。
双氧水氧化析碘反应如式(Ⅰ),生成I2的过氧化反应如式(Ⅱ)。
H2O2+2H++2I-=I2+2H2O
(Ⅰ)
5H2O2+I2=2HIO3+4H2O
(Ⅱ)
(3)分光光度法确定碘含量[8]。采用紫外-可见分光光度计,于200~800nm范围内测量I2的水溶液的吸收光谱,确定最佳吸收波长为460nm;再于460nm处测定提取I2的水溶液的吸光值。根据Lambert-Beer定律确定所提取的碘的质量。
(4) 碘量法确定碘含量[2]。用1~3mmol/L标准硫代硫酸钠溶液滴定含I2水溶液,滴至溶液呈淡黄色时,加入3mL 0.4%的淀粉溶液,继续滴定至蓝色刚好消失,记录所滴加的硫代硫酸钠溶液的体积。做用该标准硫代硫酸钠溶液滴定新鲜蒸馏水的空白实验。根据反应式(Ⅲ)计算所提取的碘的质量。
(Ⅲ)
3 材料、试剂与仪器
3.1 材料和试剂
无水碳酸钠、浓盐酸、浓硫酸、30%过氧化氢、无水乙醚、无水硫酸镁、硫代硫酸钠、重铬酸钾和可溶性淀粉,以上试剂均为分析纯;市售干海带。
3.2 仪器
HJ-3恒温磁力搅拌器(江苏金坛市中大仪器厂),PHS-2F型数字pH计(上海精密科学仪器有限公司),501型氧化还原复合电极(上海精密科学仪器有限公司),TU-1810型紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
4 实验要求
(1) 实验方案制定。根据所提供的材料、试剂和仪器,自行查阅相关文献,分小组制定实验方案。指导教师组织学生集中讨论,并对各小组制定的实验方案进行点评。
(2) 熟悉与本实验有关的实验装置、仪器的安装及使用。指导教师给学生演示相关实验装置、仪器的安装及使用,并指导学生学会正确安装和使用相关实验装置和仪器。
(3) 按论文格式要求撰写实验报告。
5 思考与设计
思考、回答以下问题,并完成相关数据的采集。
(1) 碱溶法煮泡海带与不加碱或海带灰化法相比有何优点?
(3) 根据Nerst方程(式Ⅳ),H2O2/H2O电对的电极电势与双氧水浓度以及溶液的pH有关。请设计双氧水浓度与海带浸出液酸化的正交实验,确定最佳实验条件,并完成实验数据采集。数据采集表包括如下内容:干海带样品序号、质量,浸出液酸化后pH,滴定前后电位变化情况,电位突跃时所用双氧水的体积,溶液颜色,吸光度(λ=460nm),氧化析碘后溶液中I2的质量。

(Ⅳ)
(4) 如何确定溶液中的I-全部转化成I2,而且生成的I2没有进一步被氧化?请设计合理的实验方案。
(5) 本实验为什么采用无水乙醚作萃取剂?文献中报道的以四氯化碳为萃取剂在本实验中是否可行?为什么?
(6) 如何回收减压分离过程中的无水乙醚?请画出可行的实验装置简图。
(7) 如何确定差量法所提取的I2的纯度?完成以下数据采集:干海带样品序号、质量,氧化析碘后溶液中I2的质量,乙醚萃取后差量法所得I2的质量,萃取效率(η=((A0-Ar)/A0)×100%),A0和Ar分别为萃取前和萃取后水溶液的吸光度),以及提取I2的纯度检验(分别用碘量法和分光光度法完成)。
6 教学设计特点
(1) 通过调研文献,设计、讨论、修改方案,开展实验以及撰写实验报告,培养学生的科研意识,并体现教学与科研的相互促进。
(2) 思考与设计的内容贯穿实验的全过程,涉及无机及分析化学(卤素、氧化还原反应与滴定、化学键与分子结构)、有机化学(萃取、减压蒸馏)和仪器分析(紫外-可见分光光谱法、电位分析法)课程的内容,知识点分布广,有利于提高学生分析和解决问题的能力。这种“问题化”教学方式,易激发学生的实验兴趣,使学生积极参与,成为实验教学的主体[9]。
(3) 将绿色化学理念融入实验教学课堂,有助于培养和提高学生的环保意识。
参 考 文 献
[1] 周令芬.海南大学学报(自然科学版),1997,15(3):236
[2] 崔克宇,刘少春,王悦,等.吉林师范大学学报(自然科学版),2007(4):38
[3] 谭志安,花蓓,施巧芳,等.泰州职业师范学院学报,2002,2(1):29
[4] 胡小莉,李原芳,凌莉莎,等.西南师范大学学报(自然科学版),2007,32(5):168
[5] 李春梅,审玉双,贾密英,等.中国现代教育装备,2007(6):53
[6] 王京刚,冯丽娟,相湛昌,等.无机盐工业,2008,40(11):11
[7] 迟玉森,庄桂东,韩荣伟,等.海盐湖与化工,2005,34(6):12
[8] 陈玉峰,冉广芬,马海州,等.2006,14(2):42
[9] 刘震,梁靓,窦鹏,等.大学化学,2010,25(1):54

