繁茂膜海绵原细胞形态学识别及分离纯化特点
曲 翊, 宋悦凡, 曹旭鹏, 张 卫,3
(1. 中国科学院 研究生院, 北京 100039; 2. 中国科学院 大连化学物理研究所, 辽宁 大连 116023; 3. 澳大利亚Flinders大学 海洋生物过程及生物产品研究中心, 阿德莱德 SA 5042)
繁茂膜海绵原细胞形态学识别及分离纯化特点
曲 翊1,2, 宋悦凡1,2, 曹旭鹏2, 张 卫2,3
(1. 中国科学院 研究生院, 北京 100039; 2. 中国科学院 大连化学物理研究所, 辽宁 大连 116023; 3. 澳大利亚Flinders大学 海洋生物过程及生物产品研究中心, 阿德莱德 SA 5042)
利用透射电镜对繁茂膜海绵(Hymeniacdidon pelevis)的原细胞进行观察, 确定其超微结构特点为:细胞核大, 核仁显著。细胞质中富含线粒体和处于不同消化阶段的溶酶体。对繁茂膜海绵本体和芽体旺盛分生组织进行观察, 发现原细胞在不同组织中形态多变。同时针对不同部位分别进行组织离散和原细胞富集, 结果证明不同来源的富集原细胞团在原细胞比例和生长分化过程中都存在差异。
繁茂膜海绵(Hymeniacdidon pelevis); 原细胞
海绵是海洋中最低等的多细胞动物, 近年来从海绵中发现了大量的生物活性物质, 使海绵成为了海洋药物研究中重要的药源生物[1]。为解决在海绵药物开发过程中的生物量供给问题, 近10年来国际上开展了一系列研究以解决海绵资源供给不足问题。海绵细胞离体培养因其可能利用细胞工程和基因工程技术实现活性物质的代谢调控, 从而可能实现活性物质的大规模可控生产, 成为近年来无脊椎动物细胞培养领域的一个研究热点[2]。
海绵没有组织和器官的分化, 不同类型的细胞能保持功能和结构上的相对独立。目前可以确定的细胞类型有上皮细胞(epithelial cells)、吞噬细胞(phagocytes)、领细胞(choanocytes)、胶原细胞(collencytes)、原细胞(archeaocytes)等十几种。做为海绵体内的“干细胞”, 原细胞是海绵中不可缺少的细胞类型, 具有低分化、高增殖潜力的特点, 是最理想的海绵细胞离体培养对象[3]。但海绵原细胞在海绵体内数量少, 形态多变, 不易确认, 给细胞培养工作造成了一定困难。作者采用石蜡切片和透射电子显微镜法对中国黄海繁茂膜海绵(Hymeniacidon perlevis)本体组织和芽体中的原细胞进行识别, 并针对海绵不同部位进行原细胞分离纯化结果的比较研究。
1 材料与方法
1.1 材料
繁茂膜海绵采自大连凌水桥黄海海域潮间带,自然状态下为片状生长。当处于生殖准备阶段时, 会改变形态, 出现芽状生长(图1)。

图1 室内养殖状态下的繁茂膜海绵Fig. 1 Hymeniacdidon pelevisin aquarium
1.2 方法
1.2.1 海绵组织离散及原细胞富集
制备过程参照Custodio[4]介绍的方法, 根据繁茂膜海绵自身特征进行部分修改, 具体过程为: 室温条件下, 海绵在天然海水(含 25×10−6CuSO4)中浸泡3~5 h, 同时进行磁力搅拌。将处理后的海绵切成1 cm左右小块, 在无钙镁海水中振荡5次, 弃上清,再重复振荡5次。
将前处理完毕的组织放入含10 μmol/L EDTA的无钙镁海水中, 振荡5 min, 300目滤网过滤。滤液经800 r/min离心5 min 后弃上清, 加入无钙镁海水清洗细胞, 反复两次。向混合细胞中加入无钙镁海水并轻轻吹打, 待细胞混合均匀后静置12~24 h以进行选择性聚集。将选择性聚集形成的细胞聚集体在天然海水中培养以进行差速贴壁。24 h后使用含10 μmol/L EDTA的无钙镁海水将分布于细胞聚集体上层的原细胞离散下来。离散时间由镜检控制。离散后的细胞液经低速离心后再经 Ficol-泛影葡胺密度梯度离心。收集ρ=1.09 ~ 1.11的细胞, 由无菌海水稀释至106个/mL, 接种培养。
1.2.2 原细胞电镜样品的制备
取 1 mL富集原细胞样品。参考 Mannuel的方法[5], 使用 2.5%戊二醛溶液(pH7.4)在室温下固定2 h。固定后细胞经锇酸固定、酒精丙酮梯度脱水、环氧树脂定向包埋。切片经醋酸铀-柠檬酸铅染色,由透射电子显微镜(JEM-2000EX, JEOL, Japan)观察。
1.2.3 海绵组织切片的制备
取繁茂膜海绵本体和芽体, 经10%甲醛固定30 min后再由5%氢氟酸消化骨针5 h。处理后的样品经梯度脱水、浸蜡后进行常规切片, HE染色, 中性树胶封片。
2 实验结果
2.1 原细胞的超微结构
如图 2所示, 繁茂膜海绵原细胞在离散状态下呈圆形或椭圆形, 在聚集状态下细胞发生变形。原细胞与周边细胞之间的界限明显, 细胞核大, 具有双层核膜, 核仁显著。细胞质淡染, 细胞器多, 富含线粒体及各个阶段的溶酶体。
2.2 海绵本体组织的形态学观察
从海绵本体HE染色的石蜡切片(图3)中可以看到游离于中胶层的原细胞。细胞形态巨大, 形态多变,细胞核与核仁明显。海绵组织中骨针束(Bundle)含量丰富, 经酸消化后可以看到与参与骨针束固定的胶原物质。
2.3 海绵芽体的组织形态学观察
图4是海绵芽体的HE染色结果, 处于生长状态的海绵组织具有较为丰富的变形拖尾细胞, 该类细胞正是正在向胶原细胞转化的原细胞, 具有显著的变形特征: 多为梭形, 拖尾明显。镜下观察表明, 芽体外扁平细胞层不如本体组织明显, 有外皮结构。整个芽体的骨针含量低于本体组织。繁茂膜海绵特征性的骨针束结构(Bundle)在芽体中含量较低。大芽与小芽相比, 骨针含量更低, 组织结构更致密。水沟系统发育更为完善。
2.4 不同材料来源对原细胞分离结果的影响
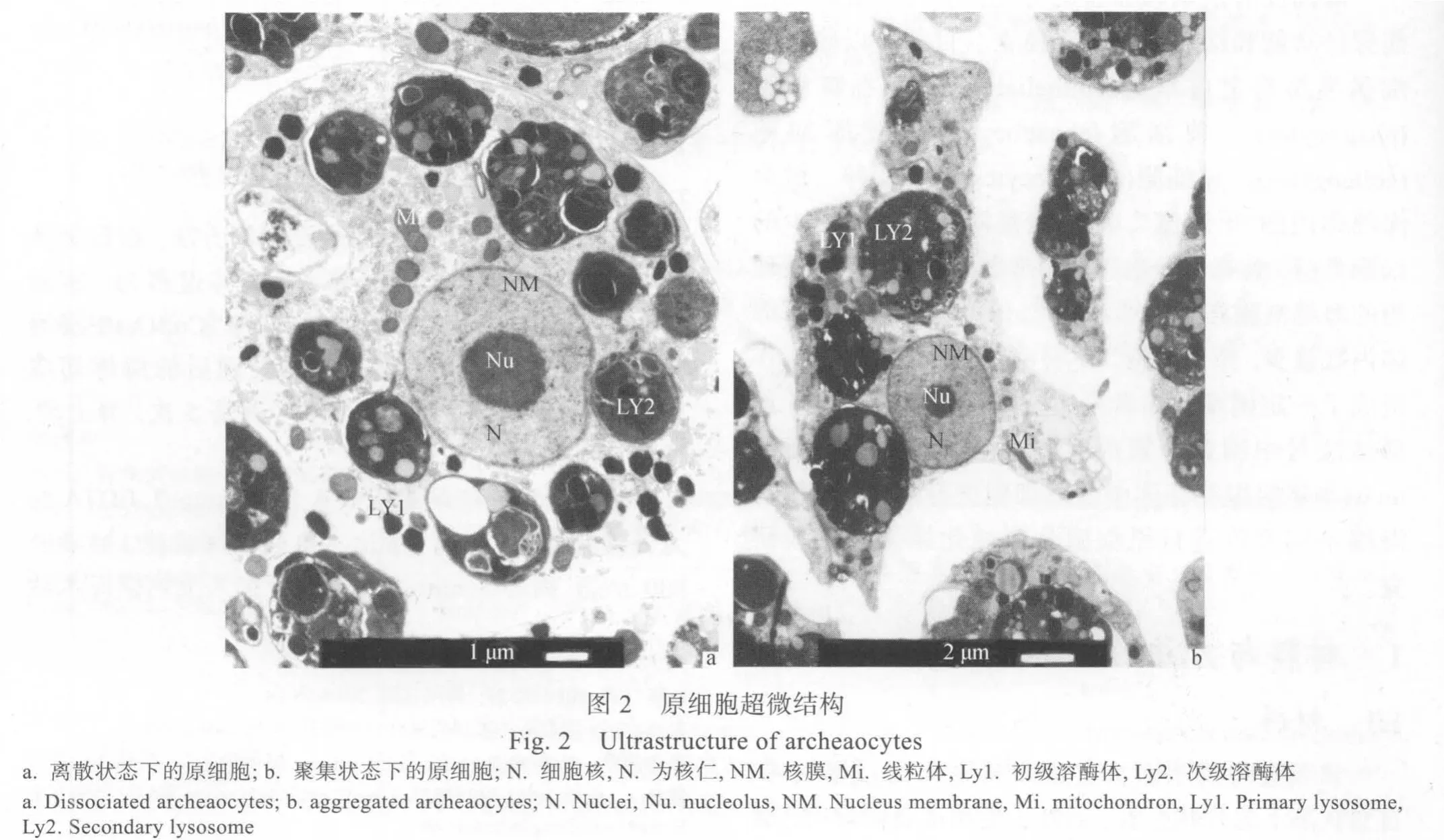
图5所示为分离纯化各步的原细胞含量(%)。与本体组织分离纯化结果相比, 采用芽体进行细胞分离纯化可以得到更高纯度的富集原细胞。经差速贴壁去除上皮和胶原后, 采用两步法进行原细胞的富集纯化: (1)低速离心; (2)密度梯度离心。经低速离心纯化后, 来源于本体的原细胞纯度为 51.34%, 来源于芽体的细胞纯度为63.58%,T检验结果表明, 两者差异极显著(P<0.01)。将低速离心得到的细胞体系再经密度梯度离心法进行纯化, 可以得到纯度更高的富集原细胞体系。来源于本体的原细胞纯度为72.25%, 来源于芽体的原细胞纯度为80.41%,T检验结果表明, 两者差异显著(P<0.05)。

图3 海绵本体组织Fig. 3 Tissue of Hymeniacdidon pelevis

图4 海绵芽体Fig. 4 Bud of Hymeniacdidon pelevis
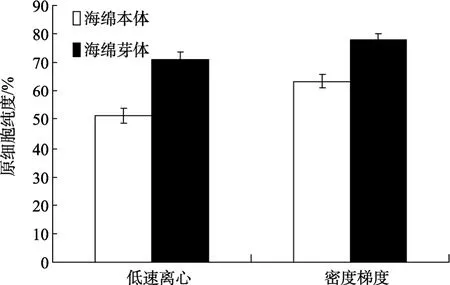
图5 不同材料来源的原细胞纯化结果Fig. 5 Purification of archeaocytes from tissue and bud
2.5 不同材料来源对细胞培养结果的影响
来源于本体和来源于芽体的原细胞在成团和贴壁分化能力上都存在差异(图6)。源于本体的细胞成团较小, 易贴壁, 在差速贴壁阶段, 细胞团在24 h之内全部贴壁铺展, 光镜下可见大量上皮细胞贴壁和原细胞迁出现象, 细胞团之间也通过胶原和上皮的贴附现象彼此连接。经低速离心和密度梯度纯化之后, 富集原细胞成团速度较快, 在培养至 72 h出现贴壁分化现象。来源于芽体的细胞成团较大, 但贴壁分化能力较弱。在差速贴壁阶段, 细胞团在24 h之内全部贴壁, 但具有明显胶原细胞迁出现象的细胞团不足50%, 细胞团之间也没有彼此连接现象。经低速离心和密度梯度纯化之后, 富集原细胞成团速度快, 细胞团大于来源于本体的细胞团。在培养过程中,细胞团通过彼此汇合达到体积增大, 在72 h之内出现光滑上皮, 但直至培养第 6 天也没有出现细胞团贴壁现象。

图6 原细胞富集体系培养结果Fig. 6 Primary culture of archeaocytes
3 讨论
原细胞是海绵组织中必不可少的一种细胞, 被认为是海绵体内的干细胞[6], 在海绵生长的不同生理状态可以向不同的细胞类型转化。但海绵组织中的原细胞较为稀少。只有在特殊的情况下, 例如生殖,出芽, 组织修复等情况下原细胞才会聚集于某些区域[2]。繁茂膜海绵的生长具有周期性, 具有明显的出芽现象。原细胞在芽体(bud)与本体(mother sponge)中的不同形态, 表现出原细胞的形态多变性。尤其在芽体中由于生长旺盛, 向胶原细胞分化, 细胞变形为梭形, 常有胶原拖尾, 是原细胞向胶原细胞分化的显著标志。芽体发育过程起始于细长的小芽(Filament)。在发育过程中, 小芽的末端逐渐膨大, 直至形成明显芽体后随着断裂作用脱离本体。游离的芽会寻找合适的附着基, 一旦附着, 便会继续发育成海绵。细长小芽的组织切片结果表明, 扁平细胞层结构不明显, 小芽内部的原细胞含量多于本体组织。当细长小芽发育成大芽时, 随着发育的成熟, 芽体中的细胞类型也会发生显著变化, 形成以原细胞为主的细胞构成方式。一个发育完全成熟的芽体外皮层被裹在扁平细胞中, 在外皮层内部具有丰富的胶原。
原细胞具有运动性, 同时具有消化和吞噬功能。通常在领细胞周围会汇聚大量原细胞, 将领细胞捕获到的食物进行吞噬消化, 以供整个机体生长发育所需。同时消化后的废物可以通过原细胞的胞吐作用经水沟系统排出体外。电镜下观察到的细胞超微结构可以证明原细胞强大的吞噬能力: 胞质中充满大量吞噬体及各个阶段的溶酶体。而且, 原细胞的线粒体数量多, 可以为吞噬消化过程提供大量能量,使原细胞在外源性和内源性物质的降解和循环中发挥重要作用。超微结构证实, 原细胞的核比例大, 具有明显核仁, 携带大量遗传物质, 是一类具有增殖潜能的细胞。培养结果证实, 随着纯度增加, 细胞成团速度加快, 证明原细胞的细胞活力强, 适于进行体外培养。不同来源的细胞体系在细胞培养中存在明显差异: 在差速贴附阶段, 来源于本体的细胞体系具有更强的贴壁及迁移能力。这一现象可能与海绵组织中的细胞比例有关, 光镜结果表明繁茂膜海绵具有明显的外骨骼(Cortex)和典型的扁平细胞层,由于生长在潮间带, 风浪冲击作用较强, 所以外骨骼连接紧凑, 扁平细胞数量多, 细胞层致密。在差速贴附过程中, 本体由于其扁平细胞比例高, 更易出现贴壁现象。而芽体的扁平细胞层不明显, 细胞比例低, 贴壁迁移现象不明显。随着原细胞纯度的不断增加, 细胞培养规律更趋近于小细胞彼此汇合成大团,贴壁能力减弱。这可能与原细胞的分化方向有关, 需要进一步的实验验证。
从本体和芽体分别进行细胞离散纯化, 结果证明从芽体中更易获得高纯度的原细胞, 而且更易保持其未分化的状态。这一结果可以为原细胞培养建系提供一条有希望的探索途径。由于海绵原细胞的形态多变, 以往对原细胞的观察鉴定一直没有定论。本文通过同时对比不同生长状态的组织中的原细胞的形态和结构特征, 对海绵原细胞的各种存在形态有所判定, 为深入研究海绵原细胞提供必要的信息。
[1] Müller W E G, Wiens M, Batel R, et al. Establishment of a primary cell culture from a sponge: Primmorphs fromSuberites domuncula[J]. Marine Ecol Progr Ser,1999, 178: 205-219.
[2] Bergquist P L. Sponges[M]. London: Hutchinson, 1978:268.
[3] Uriz M J, Turon X, Galera J,et al. New light on the cell location of avarol within the spongeDysidea avara(Dendroceratida)[J]. Cell Tissue Res, 1996, 285(3):519-527.
[4] Custodio M R, Prokic I, Steffen R, et al. Primmorphs generated from dissociated cells of the spongeSuberites domuncula: A model system for studies of cell proliferation and cell death[J]. Mech Ageing Dev,1998, 105(1-2): 45-59.
[5] Manuel M, Ana R. Reproductive output in a Mediterranean population of the homosclerophoridCorticium candelabrum(Porifera, Demospongiae), with notes on the ultrastructure and behavior of the larva[J]. Marine Ecology, 2008, 29(2): 298-316.
[6] Liming Sun, Yuefan Song, Yi Qu, et al. Purification and in vitro cultivation of archaeocytes (stem cells) of the marine spongeHymeniacidon perleve(Demospongiae)[J]. Cell Tissue Res, 2007, 328(1): 223-237.
Received: Feb., 25, 2010
Key words:Hymeniacdidon pelevis; archeaocyte
Abstract:Archeaocytes in Hymeniacdidon pelevis were observed by normal light microscope and transmission electron microscope. The results showed that archeaocyte has numerous mitochondria, phagosomes and lysosomes in several stages of digestion. The morphological results show that the shape of archeaocytes changes in different tissues. The cell culture data shows that archeaocytes from different origins have distinguishing difference in growth and differentiation behaviors.
(本文编辑:梁德海)
Histological characterization and purification of archeaocytes of marine sponge Hymeniacdidon pelevis
QU Yi1,2, SONG Yue-fan1,2, CAO Xu-peng2, ZHANG Wei2,3
(1. Graduate School of the Chinese Academy of Sciences, Beijing 100039, China; 2. Marine Bioproducts Engineering Group, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China; 3. Flinders Centre for Marine Bioprocessing and Bioproducts, Flinders University, Adelaide SA5042, Australia )
Q24
A
1000-3096(2011)01-0001-05
2010-02-25;
2010-05-24
国家高技术研究发展计划项目(2006AA09Z435)
曲翊(1978-), 女, 辽宁大连人, 博士研究生, 研究方向为生物化工, 电话: 0411-84379527, E-mail: qyi@dicp.ac.cn; 张卫, 通信作者,E-mail: weizhang@dicp.ac.cn

