花生壳药材质量标准的研究
周 萍,杨月娥,杨 敏
(大理学院药学院,云南大理 671000)
花生壳药材质量标准的研究
周 萍,杨月娥,杨 敏
(大理学院药学院,云南大理 671000)
目的:完善花生壳药材的质量标准,为花生壳的合理利用和质量控制提供依据。方法:对花生壳进行性状及显微特征观测;对花生壳中木犀草素采用薄层色谱法(TLC)和高效液相色谱法(HPLC)进行鉴别;按水分测定法和灰分测定法检测了花生壳中的水分、总灰分、酸不溶性灰分;用热浸法测定了醇溶性浸出物含量,用HPLC法测定了木犀草素的含量。结果:10个不同产地的花生壳在与木犀草素对照品的相应位置上,显示相同颜色的斑点及相同的保留时间。花生壳含水分为7.66%~9.99%,总灰分为2.16%~4.23%,酸不溶性灰分为0.28%~1.79%,醇溶性浸出物为4.38%~8.25%,木犀草素为0.111%~0.371%。结论:该方法简便、准确,可用于花生壳药材的质量评价。
花生壳;质量标准;木犀草素;HPLC
花生壳为豆科植物落花生(ArachishypogeaeL.)的干燥果壳,在我国有丰富的资源,国内外在化工、食品、医药有广泛研究和应用〔1〕。药理研究表明:花生壳有降低血压、血脂,抗氧化,抗菌和治疗冠心病的作用〔2-4〕,以花生壳为原料生产的“脉舒胶囊”是治疗高血脂症的纯中药制剂,花生壳的药用价值和开发前景广阔。花生壳作为中药材已收载于《云南省药品标准》〔5〕,但仅有性状等项目,现行质量控制指标有待提高和完善。为了进一步利用和开发花生壳资源,提高药材和制剂质量,本试验对其进行了系统的研究,希望为花生壳质量标准的制定提供参考依据。
1 试验材料与仪器
1.1 仪器 Agilent 1100型高效液相色谱仪(包括四元泵,自动进样器,DAD检测器,chemstation化学工作站);硅胶GF254预制薄层板(10 cm×20 cm,青岛海洋化工厂);旋转蒸发仪(上海亚荣生化仪器厂);电热鼓风干燥箱(JC101型,南通嘉程仪器有限公司);电子天平(上海精密科学仪器有限公司)。
1.2 材料 木犀草素对照品(中国生物制品检定所,批号:111520-200201);花生壳购于市场,产地分别为:宾川(2份)、昆明(1份)、开远(1份)、保山(1份)、湖南(1份)、东川(1份)、元谋(1份)、永胜(2份),经本院生药学教研室杨月娥老师鉴定,样品均为豆科植物落花生(ArachishypogaeaL.)的干燥成熟果壳,样品粉碎成粗粉后备用;其他试剂均为分析纯。
2 方法与结果
2.1 性状 本品呈类舟型,两端钝圆,可见果柄残痕或喙状小突起,长2~5 cm,宽1~1.5 cm,厚1~1.5 cm,外表面黄白色,向外凸起,微带波状起伏,有类方型或不规则的凹状网纹,内表面凹状起伏,表面有一层白色薄膜,时有褐色斑纹,其膜层不易脱,有光泽,体轻质脆,易折断;断面不整齐,有的外层可见丝状物,气微,味淡〔5〕。
粉末特征:灰黄色,梯纹导管较大,稀有网纹导管。纤维成束,壁厚。木栓细胞红黄棕色,长方形或多角形。可见薄壁细胞。见图1。

图1 花生壳粉末特征
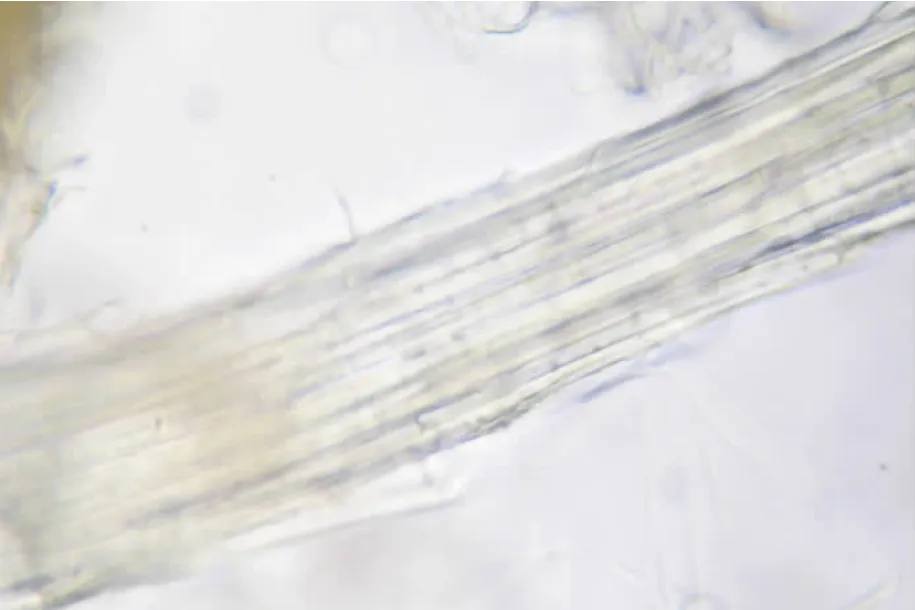
2-网纹导管

3-木栓细胞
2.2 鉴别试验
2.2.1 高效液相色谱法(HPLC) 在含量测定项下记录的色谱图(图2)中,结果显示供试品主峰的保留时间与对照品色谱峰的保留时间一致。
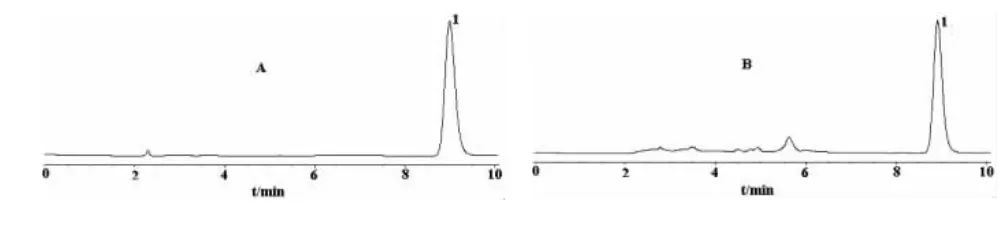
图2 HPLC色谱图
2.2.2 薄层色谱法
2.2.2.1 对照品溶液的制备 取木犀草素对照品适量,加甲醇制成每1 mL含1 mg木犀草素的溶液作为对照品溶液。
2.2.2.2 供试品溶液的制备 取10个不同产地样品粉末2 g,分别加70%乙醇20mL,浸泡1 h,水浴加热回流提取2 h,趁热过滤,滤液蒸干溶剂,加入10 mL甲醇溶解后过滤,滤液作为供试品溶液。
2.2.2.3 薄层色谱条件及结果 吸取上述供试品溶液、对照品溶液各5μL分别点于同一硅胶GF254薄层板(使用前在110℃下活化30min,保存在干燥器中备用)上,以甲苯-乙酸乙酯-甲酸-甲醇(8∶5∶1∶1)为展开剂,展开,取出,晾干,置紫外灯(254 nm)下检视。结果显示供试品色谱中,在与对照品色谱相应的位置上,分别显相同颜色的斑点(Rf=0.76)。
2.3 杂质检查
2.3.1 水分 照“水分测定法”(中国药典2010年版一部附录ⅨH第一法)〔6〕测定花生壳的水分含量,结果见表1。
2.3.2 总灰分和酸不溶性灰分 照“灰分测定法”〔6〕,测定总灰分和酸不溶性灰分,结果见表1。
2.4 含量测定
2.4.1 浸出物含量测定 花生壳中主要药理活性物质为黄酮类等脂溶性成分,其含量多少关系到药材质量的好坏。将样品按照“浸出物测定法”〔6〕,以70%乙醇为溶剂,采用热浸法,测得花生壳的醇溶性浸出物含量,结果见表1。
2.4.2 木犀草素的HPLC含量测定法
2.4.2.1 色谱条件和系统适用性试验 Agilent ZorBax SB C18色谱柱(4.6mm×150 mm,5 μm),流动相为甲醇-0.2%磷酸(54∶46),流速1.0 mL/min,检测波长350 nm,柱温30 ℃〔7〕,进样量10 μL。色谱柱的理论板数按木犀草素对照品色谱峰计算不低于5 000。重复性:取同一对照品溶液连续进样5次,测得木犀草素峰面积的RSD=0.55%。木犀草素对照品与供试品的HPLC色谱图见图2。
2.4.2.2 对照品溶液的制备 取木犀草素对照品适量,加甲醇制成每1mL含1.476 mg木犀草素的溶液作为对照品溶液。
2.4.2.3 供试品溶液的制备 取“2.2.2.2”项下供试品溶液2mL,临用前以0.45μm微孔滤膜过滤,即得。
2.4.2.4 线性关系 取“2.4.2.2”项下对照品溶液1.2mL,用甲醇定容至25mL,即得浓度为70.85μg/mL的木犀草素对照品溶液,将此溶液分别用流动相稀释0,2,4,8,16,32倍,将不同浓度的对照品溶液分别进样10μL,以浓度C为横坐标,以峰面积A为纵坐标,绘制标准曲线,得线性回归方程为A=16.881C+0.959 6(r=0.999 7)。结果表明木犀草素在2.21~70.85μg/mL范围内呈良好线性关系。
2.4.2.5 稳定性试验 取同一供试品溶液,分别于0,1,6,12,24,36 h进样测定,木犀草素峰面积的RSD=1.76%。表明供试品溶液在36 h内基本稳定。2.4.2.6 精密度 取同一样品(开远)6份,精密称定,按“2.4.2.3”项制备供试品,在规定色谱条件下测得木犀草素含量的RSD=1.8%(n=6)。
2.4.2.7 准确度 精密称取已测知含量的花生壳(开远)粗粉9份,每3份一组,按高、中、低3个水平分别精密加入木犀草素对照品,然后按“2.4.2.3”项制备供试品,按“2.4.2.1”色谱条件测定木犀草素含量,计算加样回收率,木犀草素平均回收率为100.7%,RSD=2.6%(n=9)。
2.4.2.8 样品测定 将不同产地花生壳样品,分别按“2.4.2.3”项制备供试品,在规定色谱条件下分别测定峰面积,根据线性回归方程求出供试品浓度,并计算含量,结果见表1。结果表明:不同产地花生壳中木犀草素含量差别较大。
3 讨论
花生壳中以木犀草素为代表的黄酮类含量较高〔8-10〕,适合作为指标成分对药材进行质量控制,故本研究选择木犀草素为指标成分。
根据不同产地花生壳的实验测定结果,按平均值的±20%浮动的指导意见,建议花生壳的水分不得超过10%,总灰分不得超过4%,酸不溶性灰分不得超过1%,醇溶性浸出物不得少于7%,按干燥品计算,含木犀草素不得低于0.3%。
花生壳中木犀草素的含量随产地的不同,差异很大,因此在提取花生壳中木犀草素时,应注意选取原材料。
〔1〕杨莉,谢宇,胡立明.花生壳在食品、医药、化工方面的研究与开发〔J〕.花生学报,2008,37(3):24-28.
〔2〕周萍,王海燕,胡燕.花生的药用价值研究进展〔J〕.时珍国医国药,2009,20(11):2854-2855.
〔3〕张斌,孙兰萍,马龙,等.花生壳提取物的体外抗氧化活性研究〔J〕.资源开发与市场,2009,25(7):586-589.
〔4〕夏满莉,王敏,周新妹.花生壳总黄酮的舒血管作用机制初步探讨〔J〕.嘉兴学院学报,2008,20(6):18-21.
〔5〕云南省卫生厅.云南省药品标准〔M〕.昆明:云南大学出版社,1996:58.
〔6〕国家药典委员会.中国药典:一部〔M〕.北京:中国医药科技出版社,2010:附录50-62.
〔7〕周萍,胡碧波,朱倩,等.花生壳总黄酮及木犀草素含量〔J〕.中药材,2006,29(8):769-771.
〔8〕李芳清,徐卫东.花生壳中黄酮类化合物的提取及其纯化〔J〕.食品科学,2009,30(8):101-105.
〔9〕阳文辉,李卫彬,黄锁义,等.超声波提取花生壳总黄酮及其鉴别〔J〕.微量元素与健康研究,2006,23(5):28-30.
〔10〕唐丽萍,龚云麒,吴小燕,等.不同产地花生壳中木犀草素的HPLC测定〔J〕.花生学报,2005,34(2):1-4.
(责任编辑 蒋 康)
Study on Quality Standard of Peanut Hull
ZHOU Ping,YANG Yue'e,YANGMin
(College of Pharmacy,DaliUniversity,Dali,Yunnan 671000,China)
Objective:To perfect the quality standard of peanut hull.It can provide scientific basis for the utilization and development of peanut hull.MethodsCharacteristics and micro-features of peanut hull samples were observed.The samples were identified by TLC and HPLC with luteolin standard as reference.Water,total ash and acid-insoluble ash in peanut hull were examined by determination ofwater and ash.The contentof ethanol-soluble extractiveswasmeasured by hotextractionmethod and of luteolin was determined by HPLC.ResulteThe 10 samples from different habitats and kinds presented the spots of the same colors and same retention time at the corresponding position.The content of water,total ash ,acid-insoluble ash,ethanol-soluble extractives and luteolin were 7.66%~9.99% ,2.16%~4.23% ,0.28%~1.79% ,4.38%~8.25%and 0.111%~0.371%respectively.ConclusionThemethods are simple,convenient,and accurate and can be used for the quality control of peanuthull.
peanuthull;quality standard ;luteolin;HPLC
Q949.751.9
A
1672-2345(2011)02-0001-03
云南省教育厅科研基金资助项目(07Z10589)
2010-12-29
2011-01-14
周萍,副教授,主要从事药物质量控制研究.

