黄瓜灰霉病菌对多菌灵、速克灵及乙霉威的抗性检测
王美琴,赵晓军,张 鑫,周建波,杨外芬,刘福生
(1.山西农业大学农学院,山西太谷030801;2.山西省农业科学院植物保护研究所,山西太原030032)
由灰葡萄孢(Botrytis cinerea Pers.)侵染引发的灰霉病是黄瓜生产上的重要病害,在露地、保护地均有发生,给黄瓜生产造成了严重损失。由于灰霉病菌具有繁殖速率高、遗传变异大和适合度高的特性[1-2],多年连续大量使用化学药剂使该病原菌对一些杀菌剂产生了抗性。我国防治灰霉病的杀菌剂品种主要为苯并咪唑类的多菌灵、甲基硫菌灵,二甲酰亚胺类的速克灵、异菌脲以及N-苯氨基甲酸酯类的乙霉威[3]。
国内外已有灰霉病菌对多种杀菌剂产生抗性,甚至多重抗药性的报道[4-6]。山西省各地近年来该病害在黄瓜上的发生与为害日趋严重,常用杀菌剂的田间防治效果下降。张永杰等[7-9]已报道了山西省灰霉病菌对多菌灵、速克灵及乙霉威的抗性,其中,晋中地区对这3种杀菌剂的抗性频率分别为86%,30.3%和26%。
为了解近几年山西省晋中地区黄瓜灰霉病菌对多菌灵、乙霉威及速克灵的抗性频率和抗性水平的发展情况,本研究从山西太谷、祁县和平遥3地的黄瓜病果上分离纯化到30个灰霉病菌菌株,并测定了其对这3种杀菌剂的抗性频率和抗性水平,旨在为生产上合理用药提供一定的理论指导。
1 材料和方法
1.1 供试杀菌剂
98%多菌灵原粉和96%乙霉威原粉(均由上海新农药业公司生产);97.8%速克灵原粉(由浙江禾益农化有限公司生产)。
1.2 菌株的采集与分离
2009年3月,于山西太谷(田丰村和里秀村)、祁县(东观镇和九级村)和平遥(王家庄)3地的保护地采集黄瓜灰霉病病果30个,并采用组织分离法进行分离[10],切取病果内病健交界处小块组织,移在PDA平板中央,待长出菌丝时,取菌落边缘的菌丝转接到另一个平板上进行纯化,显微镜下观察是否得到纯化的菌种。
1.3 含药培养基制备
98%多菌灵原药是用0.1 mol/L稀HCl配成1 000 μg/mL母液,加入2~3滴0.2%的乳化剂Tween 80;96%乙霉威和97.8%速克灵原粉是用丙酮配成1 000 μg/mL母液,以0.2%的量加入乳化剂Tween 80。母液在4℃冰箱中储存备用,用时以无菌水稀释至所需的浓度,以1∶10的比例将药液加入到融化的PDA培养基中充分摇匀,制成含药平板。
1.4 抗药性频率测定
其测定采用最低抑制浓度法(MIC),鉴别浓度用Yarden标准[11],乙霉威和多菌灵以0.5 μg/mL作鉴别浓度,速克灵的鉴别浓度为1.0 μg/mL。用直径为0.4 cm的打孔器在培养2 d的待测菌株边缘取菌块接种于含鉴别浓度的PDA平板上,每个处理重复3次,放在22~23℃恒温箱中培养48 h,观察、记录菌株生长情况。在鉴别浓度上正常生长的菌株为抗性菌株。

1.5 抗药性水平测定
其测定采用FAO推荐的菌落直径法[12],取1.4鉴别出的敏感菌株3个和抗性菌株6个作为待测菌株,用直径为0.4 cm的打孔器在待测菌株菌落边缘取菌块,接种于一系列质量浓度的含药平板上。乙霉威敏感菌株的测试质量浓度依次为0.005,0.01,0.02,0.05,0.1,0.2 μg/mL,抗性菌株为 1.0,1.5,2.0,2.5,5.0,10.0 μg/mL;多菌灵敏感菌株为 0.01,0.02,0.05,0.1,0.2 μg/mL,抗性菌株为 5,10,20,50 ,100 μg/mL;速克灵敏感菌株为 0.05,0.1,0.25,0.5,0.75 μg/mL,抗性菌株为5.0,10.0,15.0,20.0,50.0 μg/mL。以不加药剂为对照,每个处理重复3次。置于22~23℃恒温箱中培养48 h,测量菌落直径。根据菌落在不同浓度药剂平板上的生长抑制率,用SAS软件对数据进行统计分析。
抗性水平=抗性菌株EC50/感菌株EC50
2 结果与分析
2.1 菌株的分离及培养性状和形态特征
用组织分离法获得14个采自山西省太谷县的黄瓜病果灰霉菌株,编号为Tg1~Tg14;8个采自祁县,编号为 Qx1~Qx8;8个采自平遥,编号为Py1~Py8。初期菌丝呈灰色,并逐渐加深,变灰褐色,在PDA平板上生长速度较快,48~72 h均可长满直径为9 cm的平板。15 d后在平板上形成黑色、片状或不规则的小型菌核。通过镜检观察,病菌的分生孢子梗较长,多数丛生,直立,褐色,有隔,顶端具1~2次分支;分支顶端膨大呈头状,其上密生小柄,产生大量分生孢子,如同葡萄穗;分生孢子球形至卵球形,无色,单胞,表面光滑。
2.2 灰霉病菌对3种杀菌剂的抗性频率
通过MIC法对分离到的30个灰霉菌株进行室内测定,结果如图1所示。由图1可知,乙霉威的抗性菌株21个,敏感菌株9个,抗性频率为70%;多菌灵的抗性菌株24个,敏感菌株6个,抗性频率为80%;速克灵的抗性菌株27个,敏感菌株3个,抗性频率为90%。

2.3 灰霉病菌敏感菌株对3种杀菌剂毒力测定
表1结果表明,乙霉威敏感菌株的平均EC50为0.036 9 μg/mL,多菌灵敏感菌株的平均EC50为0.057 4 μg/mL,速克灵敏感菌株的平均EC50为 0.269 2 μg/mL。
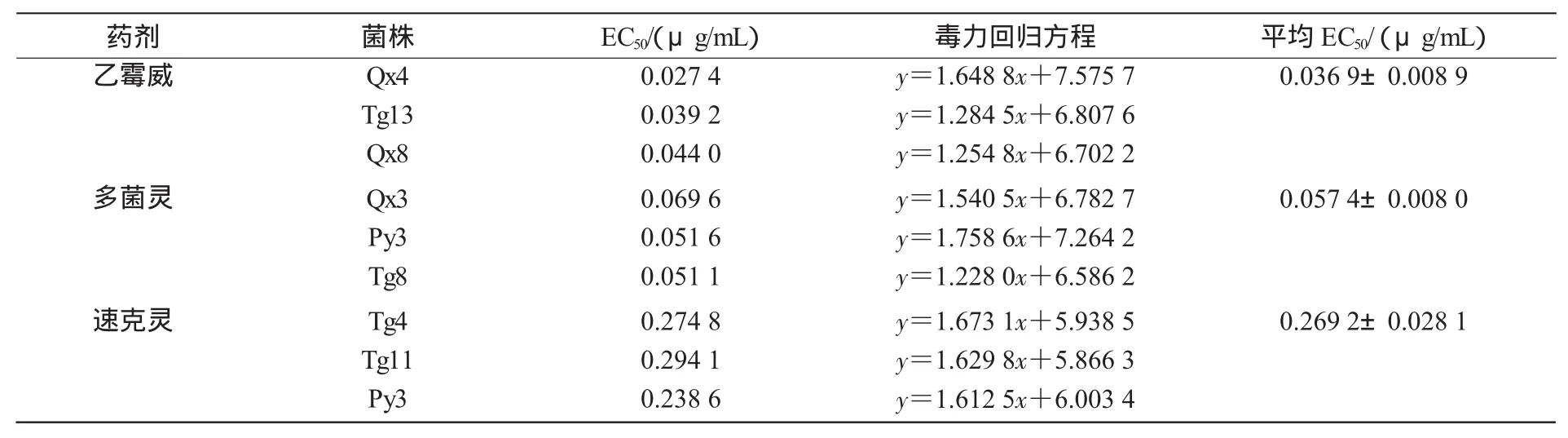
表1 灰霉病菌敏感菌株对乙霉威、多菌灵和速克灵的EC50
2.4 灰霉病菌的抗性菌株对3种杀菌剂的抗性水平
表2结果表明,乙霉威6个抗性菌株的EC50在2~3 μg/mL之间,平均抗性倍数为66.0倍,说明山西省晋中地区黄瓜灰霉病菌对乙霉威的抗性达到中抗。多菌灵抗性菌株的EC50在22~27 μg/mL之间,平均抗性倍数为421.5倍,说明山西省晋中地区黄瓜灰霉病菌对多菌灵的抗性达到高抗;速克灵抗性菌株的EC50在11~19 μg/mL之间,平均抗性倍数为53.3倍,说明山西省晋中地区黄瓜灰霉病菌对速克灵的抗性为中抗。

表2 灰霉病菌抗性菌株对乙霉威、多菌灵和速克灵的抗性水平
3 结论与讨论
2003年报道的有关山西省晋中地区灰霉病菌对多菌灵、速克灵和乙霉威的抗性频率分别为86%,30.3%和26%[7-9],本试验测定的黄瓜灰霉病菌对这3种杀菌剂的抗性频率分别为80%,90%和70%,速克灵和乙霉威的抗性频率均大幅度增加,而多菌灵却略有下降。分析其原因认为,当时在许多地区灰霉病菌对多菌灵已经达到高抗,防效降低,以至多菌灵在生产中已经停止使用,病原菌对其的敏感性有所下降,而速克灵和乙霉威仍然是防治灰霉病的常用药剂,所以其抗性频率大幅度增加,但其抗性程度集中在中抗水平。建议在生产中要减少速克灵和乙霉威的用药量或者与其他杀菌剂科学合理地混合使用,以延缓抗药性的产生,延长药剂的使用年限。
近年来,对于灰霉病的防治方法,除了使用化学药剂外,许多科技工作者也尝试使用其他的防治方法,如生物防治,筛选拮抗菌株[12-13],或者用人工嫁接的方法来降低病害的发生等[14]。
[1]Fraile A,AlonsoA,Sagasta E M.Some characteristics of Botrytis cinerea isolates tolerant to procymidone[J].Plant Pathology,1986,35:82-85.
[2]刘波,叶钟音,刘经芬,等.速克灵抗灰霉病菌菌株性质的研究[J].植物保护学报,1992,19(4):297-301.
[3]周明国,叶钟音.杀菌剂抗性研究进展[J].南京农业大学学报,1994,17(3):33-41.
[4] Katan T.Resistance to 3,5-dochlorophenyl-N-cylicimide(dicarboximide)fungicides in the gray mould pathogen Botrytis cinerea[J].Plant Pathology,1983,31:133-141.
[5]朱桂宁,黄福新,蔡健和,等.广西番茄灰霉病病菌的多重抗药性监测[J].中国蔬菜,2003(4):14-16.
[6]王万立,王勇,刘耕春,等.天津市茄子灰霉病菌的抗药性检测[J].华北农学报,1998,13(4):107-111.
[7]刘慧平,韩巨才,闫秀琴,等.灰霉病原菌对多菌灵的抗性监测[J].山西农业大学学报,2003,23(2):93-97.
[8]韩巨才,闫秀琴,刘慧平,等.山西省灰霉病菌对速克灵的抗性监测[J].山西农业大学学报,2003,23(4):299-302.
[9]张永杰,闫秀琴,韩巨才,等.山西省灰霉病菌对乙霉威的抗性监测[J].山西农业大学学报,2003,23(4):308-311.
[10]康萍芝,张丽荣,沈瑞清.木霉菌对灰葡萄孢菌的拮抗作用[J].内蒙古农业科技,2008(6):49-51.
[11]Yarden O,Katan T.Mutations leading to substitutions at amino acids 198 and 200 of Beta-tubulin that correlate with benomyl-resist field strains of Botrytis cinerea[J].Phytopathology,1993,83(12):1478-1483.
[12]Gorgolous S G,J Dekker.Detection and measurement of fungicide resistance general principles[J].FAO Pl Prot Bull,1982,30(2):39-71.
[13]王美琴,陈俊美,薛丽,等.番茄内生细菌的分离及拮抗菌的筛选[J].山西农业科学,2007,35(2):55-58.
[14]李淑菊,马德华,霍振荣.黄瓜灰霉病苗期人工接种抗病性鉴定技术[J].天津农业科学,1997,3(2):13-14.

