食管钡餐结合食管低张CT检查对食管癌手术可切除性的评价
杨保智 YANG Baozhi
温 娟 WEN Juan
边 媛 BIAN Yuan
李胜华 LI Shenghua
王 军 WANG Jun
杜 鑫 DU Xin
陕西省咸阳市第一人民医院影像科 陕西咸阳 712000
食管癌在我国的发病率较高,术前评价食管癌能否切除及其临床分期一直是临床研究的热点[1,2]。影像学检查是临床术前评价的重要手段,以往多采用单一影像学检查方法对食管癌进行评价,但存在许多弊端。本文采用食管钡餐结合食管低张CT扫描两种方法对食管癌进行术前评价,并与手术和病理结果相对照,为临床正确评价食管癌手术切除的可能性及开展综合治疗提供客观依据。
1 资料与方法
1.1 一般资料 选取2008-08~2010-04咸阳市第一人民医院收治经病理证实的42例食管癌患者,其中男性27例,女性15例;年龄41~70岁,平均57岁。胸上段食管癌14例,胸中段食管癌18例,胸下段食管癌10例,术前查体及影像学检查未发现远处转移。所有患者术前1周内分别行食管钡餐检查和食管低张CT平扫。42例中,行根治切除术38例,探查术4例。术后病理:鳞癌34例,未分化小细胞癌8例。
1.2 检查方法 42例均行食管钡餐造影、食管镜及食管低张CT扫描检查。食管钡餐造影检查:患者取立位,口服300%(W/V)气钡混悬液65ml,多体位透视并摄片观察,明确病变部位、范围及性质。CT扫描方法:应用Philips MX8000 CT机,扫描范围自胸廓入口至胃底平面,层厚3.2mm,间隔3.2mm连续扫描。扫描前15min肌注山莨菪碱10mg,扫描定位后患者口含“产气粉”3g,然后通过吸管吸入20%~30%(W/V)钡胶浆30ml,嘱患者快速吞咽后屏气扫描。测量病变食管壁厚度、长度、病灶与周围结构(主要观察与气管、主支气管、主动脉)的关系。以上检查及诊断均由经验丰富的高年资医师完成,采用双盲法测量病变食管壁厚度及长度。
1.3 统计学方法 应用SPSS 11.0软件进行分析,计量资料数据以均数±标准差表示,采用单因素方差分析(One-way ANOVA)的LSD法进行比较;多组计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 癌肿管壁厚度与外侵的关系 见表1。
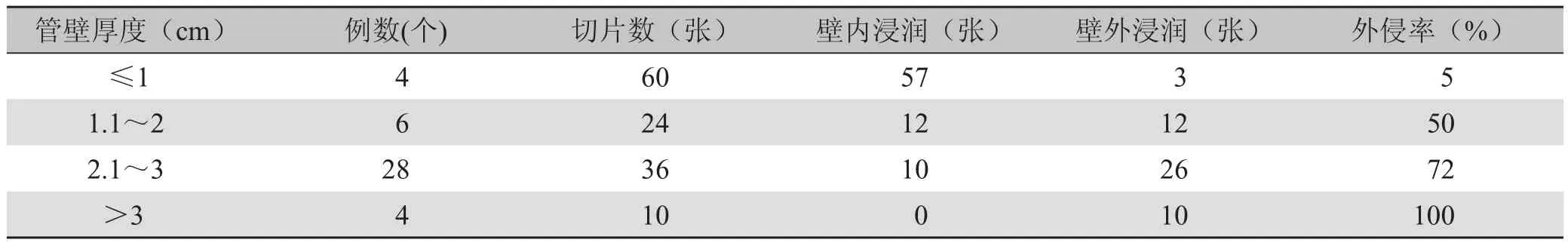
表1 CT测量食管壁厚度与镜下癌浸润的关系
2.2 肿瘤与主动脉接触角度与浸润的关系 接触面<45°20例(图1),接触面介于45°~90°之间16例,接触面>90°6例(图2、3),见表2。
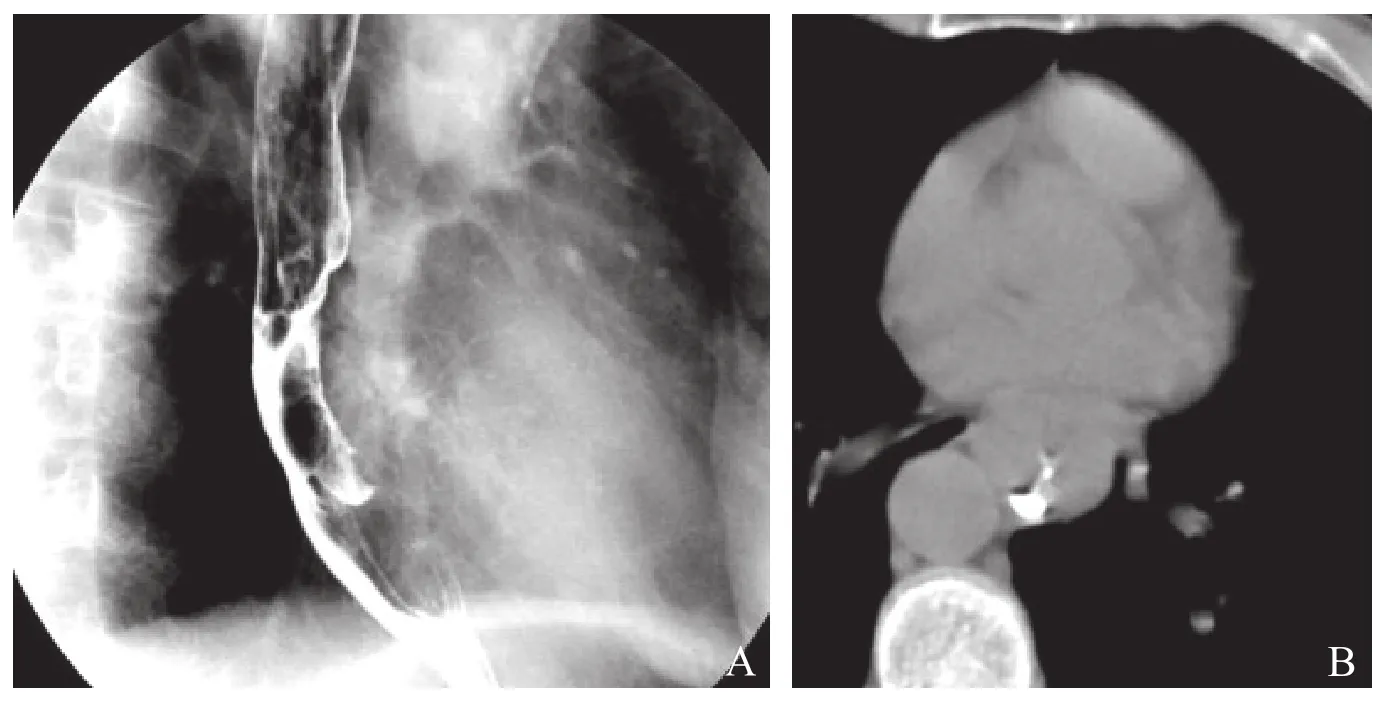
图1 A.食管钡餐造影;B.食管低张CT扫描。蕈伞型食管癌示食管腔内充盈缺损,钡剂通过呈偏流征象,癌肿与主动脉接触角度<45°,食管周围脂肪间隙清晰,手术证实主动脉未受侵

图2 A.食管钡餐造影;B.食管低张CT扫描。溃疡型食管癌示腔内斑片状不规则龛影,管壁僵硬,黏膜破坏,癌肿与主动脉接触角度>90°,手术证实主动脉受侵
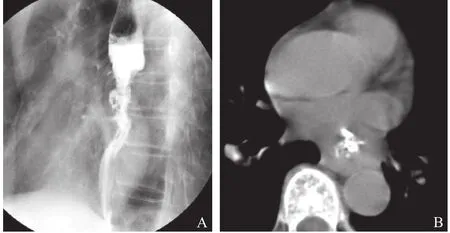
图3 A.食管钡餐造影;B.食管低张CT扫描。髓质型食管癌,狭窄段较长,管壁全周受侵僵硬,黏膜破坏,癌肿与主动脉接触角度>90°,手术证实心脏、主动脉、左下肺静脉受侵

表2 肿瘤和主动脉的接触角度与浸润的关系
2.3 肿瘤类型与气管、支气管受侵的关系 食管钡餐造影示位于气管分叉水平18例,气管旁11例(图4),见表3。
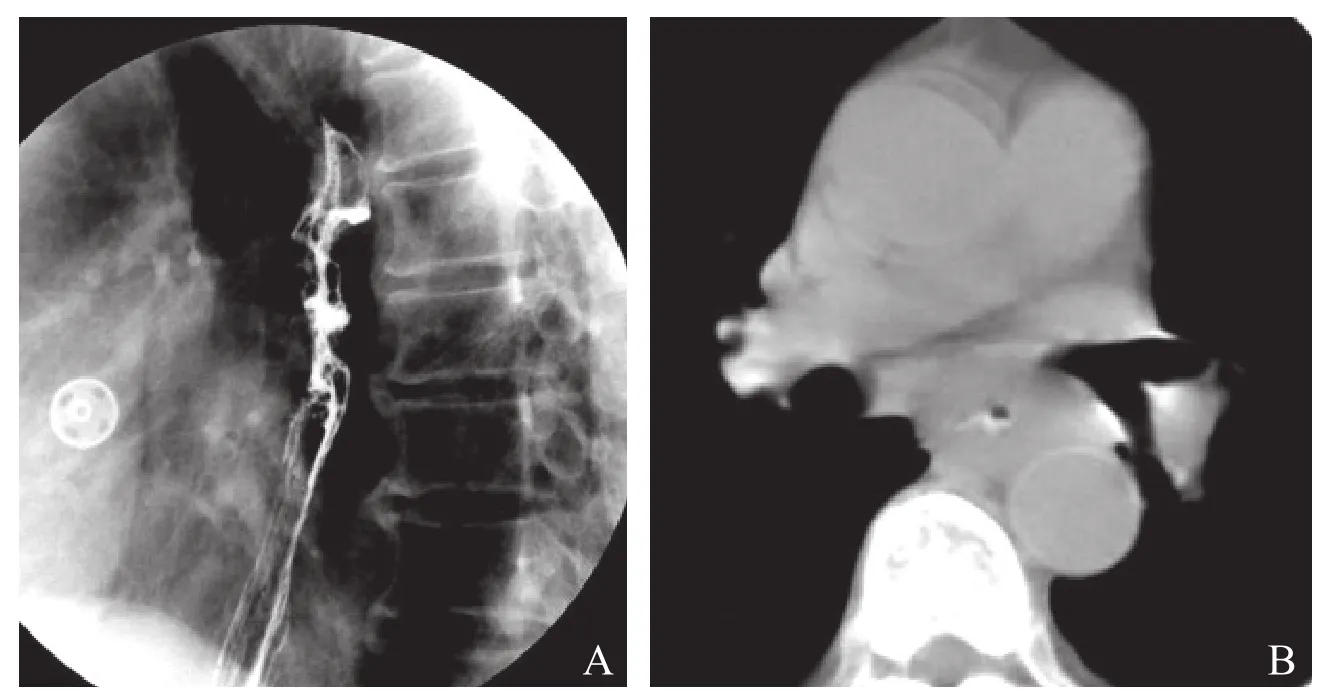
图4 A.食管钡餐造影;B.食管低张CT扫描。缩窄型食管癌示食管局部狭窄,管壁明显增厚达2.5cm,癌肿与主动脉角度>90°,手术证实主动脉、左主支气管受侵

表3 肿瘤类型与气管、支气管受侵的关系
2.4 食管钡餐造影、CT扫描与手术测量病变食管长度的差异 见表4。
表4 食管钡餐造影、CT扫描与手术测量病变食管长度的差异(,cm)

表4 食管钡餐造影、CT扫描与手术测量病变食管长度的差异(,cm)
注:(1)与食管钡餐造影组、手术组比较,P<0.05
检查方法 髓质型 蕈伞型 溃疡型 缩窄型食管钡餐造影 7.8±1.1 4.1±2.7 7.0±2.0 4.0±2.6 CT扫描 5.4±2.5(1) 4.3±2.1 5.4±3.7(1) 3.8±1.5手术 7.4±2.5 4.7±3.0 7.9±2.8 4.2±3.1
3 讨论
3.1 食管钡餐造影 食管钡餐造影目前仍是检查食管癌的重要方法之一,能对食管癌做出定位及定性诊断[3],在良好的造影片上,能充分地显示食管的全貌及病变所在。由于钡剂能够对病变的轮廓勾划得较为清楚和完整,因此对病变范围、大小及类型的判断极有价值,特别对早期食管癌管壁的扩张功能状况及黏膜皱襞的显示方面尤为突出[4]。食管钡餐造影可见病变处黏膜皱襞增粗、迂曲、中断、破坏,管腔狭窄,充盈缺损等征象,是估计食管癌手术切除率较为简便的方法,主要是根据病变长度、溃疡大小、软组织肿块大小以及外压周围器官程度情况等做出判断。①髓质型食管癌病变范围较长,病变与正常食管分界欠清晰,呈移行性,本组11例髓质型食管癌,气管、支气管受侵率高达72.7%。②蕈伞型表现为菜花状或蘑菇状充盈缺损,阻塞食管腔,引起食管上段管腔轻至中度扩张,病变边缘锐利。③溃疡型表现为大小不等的长形龛影,钡剂通过梗阻较轻,病变易侵犯邻近组织,有时出现食管-支气管瘘。④缩窄型表现为管腔呈环形或对称性狭窄,病变范围小,病变上方管腔高度扩张,病变下端呈漏斗形;此型和蕈伞型食管癌气管、支气管基本不受累及。
3.2 CT检查 CT具有较高的密度分辨力,加之扫描时行食管低张并口服对比剂,在良好的对比下能够清晰显示食管断面的形态、肿瘤腔外侵犯及其与邻近结构的关系、食管壁的厚度、有无淋巴结转移等,从而有利于肿瘤分期,对指导临床拟定治疗方案具有重要意义[5]。常规食管CT检查因食管腔充盈差而使病灶显示欠佳,采用食管低张加“产气粉+钡胶浆”可使食管壁松弛,管腔扩张充分,造影剂附着在癌肿表面与气体形成明显对比,有利于观察食管黏膜皱襞病变;同时可增加造影剂在食管内的停留时间,这对把握扫描时间、提高检出率有很大帮助。
食管壁不规则增厚是肿瘤外侵的重要表现。通常认为,CT片上正常食管壁的厚度不应>3mm,Moss等[6]认为如食管壁厚度达到5mm,肿瘤可以侵及食管壁肌层。本研究结果表明食管壁厚度与肿瘤向外侵犯之间关系密切:当食管壁厚度≤1cm时,癌肿多局限于壁内浸润;食管壁厚2cm时,外侵率为50%;食管壁厚3cm时,外侵率为72%;食管壁厚>3cm时,外侵率高达100%。有研究表明,当食管壁厚度≤1cm时,属易切除型;壁厚>1cm时,属切除较难型;癌肿侵犯主动脉、气管、心包时,属姑息切除或探查型[7]。本研究结果与以上研究结果一致,因此,食管壁的增厚程度应作为癌肿能否手术切除的重要指征。
大血管的受侵是影响手术的主要原因,胸部大血管中主动脉最易受侵。Takashima等[8]认为如果食管周围脂肪间隙消失,可判定主动脉受侵。本研究认为在脂肪层消失的基础上,还要参考食管癌与主动脉的接触角度。接触角度>90°者受侵率明显高于<90°者 (χ2=8.78,P<0.01),<45°者主动脉受侵率最低。Rabkin等[9]认为,气管、支气管壁呈现“内凸”状提示受累。由于食管的解剖学特点,中上段食管癌较易侵及气管、支气管,引起其形态改变。本研究发现,蕈伞型及缩窄型食管癌患者气管、支气管未见癌肿浸润,髓质型较溃疡型气管、支气管受侵率明显增高,说明不同类型食管癌气管、支气管受侵率存在明显差异。
准确判断食管癌患者的食管病变长度是临床选择治疗方法的重要依据,食管病变长度不同,治疗手段不同。本研究显示,食管病变长度在髓质型和溃疡型上测量差异有统计学意义(P<0.05),造影较CT扫描测量长,造影测量与手术结果较一致,此与Drudi等[10]的研究结果较一致,可作为术前判断食管癌病变长度的可靠方法。
本研究表明,食管癌手术适应证的选择应根据CT片上测量的病变管壁最大厚度,癌肿与主动脉的接触面角度,气管、支气管的形态,癌肿与心脏、肺静脉的关系等进行综合判定,并参考食管造影片测量的病变食管长度及黏膜改变综合考虑。因此,术前正确评价食管癌手术切除的可能性,可避免不必要的剖胸探查。
总之,食管钡餐造影可全面直观地显示病变,对病变长度估算较准确,能清楚地显示黏膜情况、管腔狭窄程度、管壁蠕动功能等,但对肿瘤组织在食管壁内侵犯情况、周围脏器及淋巴结有无转移等不能明确。CT检查能较准确地判断癌肿的管壁内浸润及对周围脏器的侵犯情况,对指导分期、手术方案的选择及预后价值较大。X线食管钡餐造影和CT检查在食管癌影像诊断中各有优势,二者结合对食管癌可切除性的评价更有价值。
[1]Van Overhagen H, Lameris JS, Berger MY, etal.CT assessment of resectability prior to transhiatal esophagectomy for esophageal/gastroe-sophageal junction carcinoma. J Comput Assist Tomogr, 1993, 17(3): 367-373.
[2]Czekajska-Chehab E, Smajkiewicz L, Drop A. Dynamic computed tomography assessment of local extent and resectability of esophageal carcinoma. Ann Univ Mariae Curie Sklodowska, 2002, 57(2): 29-38.
[3]李果珍,戴建平,王仪生.临床 CT 诊断学.北京 : 中国科学技术出版社, 1994: 484-487.
[4]聂周成. 早期食管癌的X线征象及误诊原因分析. 中国误诊学杂志, 2004, 4(11): 1915.
[5]胡富魁, 欧阳镜铭. 食管癌的诊断与治疗. 中级医刊,1996, 31(6): 11-12.
[6]Moss AA, Schnyder P, Thoeni RF, etal. Esophageal carcinoma: pretherapy staging by computed tomography.Am J Roentgenol, 1981, 136(6): 1051-1054.
[7]李彩英, 刘怀军, 彰俊杰, 等. 术前CT判断食管癌可切除性. 中国医学影像技术, 2004, 20(12): 1895-1897.
[8]Takashima S, TakeuchiN, Shiozaki H, etal. Carcinoma of the esophagus: CT vs MR imaging in determining resectability. Am J Roentgenol, 1991, 156(2): 297-302.
[9]Rabkin IKH, Iudin AL, Langurazova DR, etal. The role of computerized tomography in preoperative evaluation of disseminated esophageal cancer. Grud Serdechnososusdistaia Khir, 1990, 4(3): 52-55.
[10]Drudi FM, Trippa F, Cascone F. Esophagogram and CT vs endoscopic and surgical specimens in the diagnosis of esophageal carcinoma. Radiol Med (Torino), 2002, 103(4):344-352.

