注射用七叶皂苷钠无菌检查方法学验证
陈晓宁
(山东绿叶制药有限公司,山东烟台 264003)
注射用七叶皂苷钠的主要成分为七叶皂苷钠A和七叶皂苷钠B,是从七叶树科植物天师栗的干燥成熟种子中提取的一种含酯键的三萜皂苷,适用于脑水肿、创伤或手术所致肿胀,也用于静脉回流障碍性疾病。本实验按照《中国药典》2005年版要求对注射用七叶皂苷钠现行检查方法进行验证,以期建立注射用七叶皂苷钠的无菌检查方法。
1 仪器与试药
1.1 仪器
HTY-2000A 智能集菌仪;一次性全封闭集菌培养器(DGB220、DGB330),分别由杭州高得、泰林医疗器械厂生产。
1.2 菌种
金黄色葡萄球菌[Staphylococcus aureus,CMCC(B)26003],铜绿假单胞菌[Pseudomonas aeruginosa,CMCC(B)10104],枯草芽孢杆菌 [Bacillus subtilis,CMCC (B)63501], 生孢梭菌[Clostridium sporogenes,CMCC(B)64941],白色念珠菌[Candida albicans,CMCC(F)98001],黑曲霉[Aspergillus niger,CMCC(F)98003],以上均由中国药品生物制品检定所提供。
1.3 培养基
商品脱水培养基、硫乙醇酸盐流体培养基、改良马丁培养基、营养肉汤培养基、营养琼脂培养基、玫瑰红钠琼脂培养基、蛋白胨均由北京三药科技开发公司提供。
1.4 稀释液和冲洗液
稀释液和冲洗液均采用0.1%蛋白胨水溶液。
1.5 试药
注射用七叶皂苷钠(批号:200809042,规格:5 mg;批号:200811234,规格:10 mg;批号:200804124,规格:15 mg,检品数量:120 支/批,山东绿叶制药有限公司)。供试品药液(注射用七叶皂苷钠用0.1%蛋白胨水溶液进行溶解、稀释)。
2 方法与结果
洁净度为100 级的单向流空气区域内进行,其环境洁净度10 000 级。检验全过程严格遵守无菌操作。
2.1 菌液制备[1-2]
接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35℃培养18~24 h;接种白色念珠菌的新鲜培养物至改良马丁培养基中,23~28℃培养24~48 h,上述培养物用0.9%无菌氯化钠溶液制成每毫升含菌数小于100 cfu(菌落形成单位)的菌悬液。
接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基上,23~28℃培养 5~7d,加入 3~5 ml 0.9%无菌氧化钠溶液,将孢子洗脱,然后,吸出孢子悬液(用管口带有薄的无菌纱布能过滤菌丝的无菌毛细吸管)至无菌试管内,用0.9%无菌氧化钠溶液制成每毫升含孢子数小于100 cfu 的孢子悬液。
2.2 方法验证
按《中国药典》2005年版[3]规定,取规定量的供试品按薄膜过滤法溶解、过滤、冲洗。过滤前先用少量冲洗液湿润滤膜。过滤时,保持供试液及冲洗液覆盖整个滤膜表面。将滤器中的溶液摇匀。每张滤膜每次冲洗量为100 ml,流速不易过快(以泵速为30~140 r/min 为宜),在最后一次的冲洗液中加入小于100 cfu 的试验菌,过滤。将硫乙醇酸盐流体培养基或改良马丁培养基加至滤筒内。金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌接种于硫乙醇酸盐流体培养基,白色念珠菌、黑曲霉接种于改良马丁培养基,每种培养基加入量为100 ml/筒。阳性对照:另取一装有同体积培养基的容器,加入等量试验菌,作为对照。按规定温度培养3~5d。硫乙醇酸盐流体培养基置30~35℃培养,改良马丁培养基置23~28℃培养。各试验菌同法操作。阴性对照:取一套DGB220 滤器置于集菌仪上,取稀释剂200 ml,与供试品同法操作,滤过。注入硫乙醇酸盐流体培养基和改良马丁培养基各100 ml,作为阴性对照。
2.3 结果
培养结果与对照管比较(如含供试品各容器中的试验菌均生长良好,则供试品的检验量在该检验条件下无抑菌作用或其抑菌作用可以忽略不计),本品各容器中的试验菌均生长良好,照此检查法和检验条件进行供试品的无菌检查[4-6]。注射用七叶皂苷钠无菌检查方法验证结果,见表1~3。

表1 注射用七叶皂苷钠实验结果
3 讨论
上述结果表明,本品按《中国药典》2005年版二部进行无菌检查方法学验证,与对照管比较,含供试品各容器中的试验菌均生长良好,表明在上述试验方法下该样品对金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、生孢梭菌、白色念珠菌、黑曲霉菌无抑菌作用或其抑菌作用忽略不计,符合《中国药典》2005年版无菌检查方法学验证规定。所以注射用七叶皂苷钠的无菌检查可以用0.1%蛋白胨水溶液作为稀释液和冲洗液,可以用薄膜过滤法检验,冲洗量为100 ml/膜。
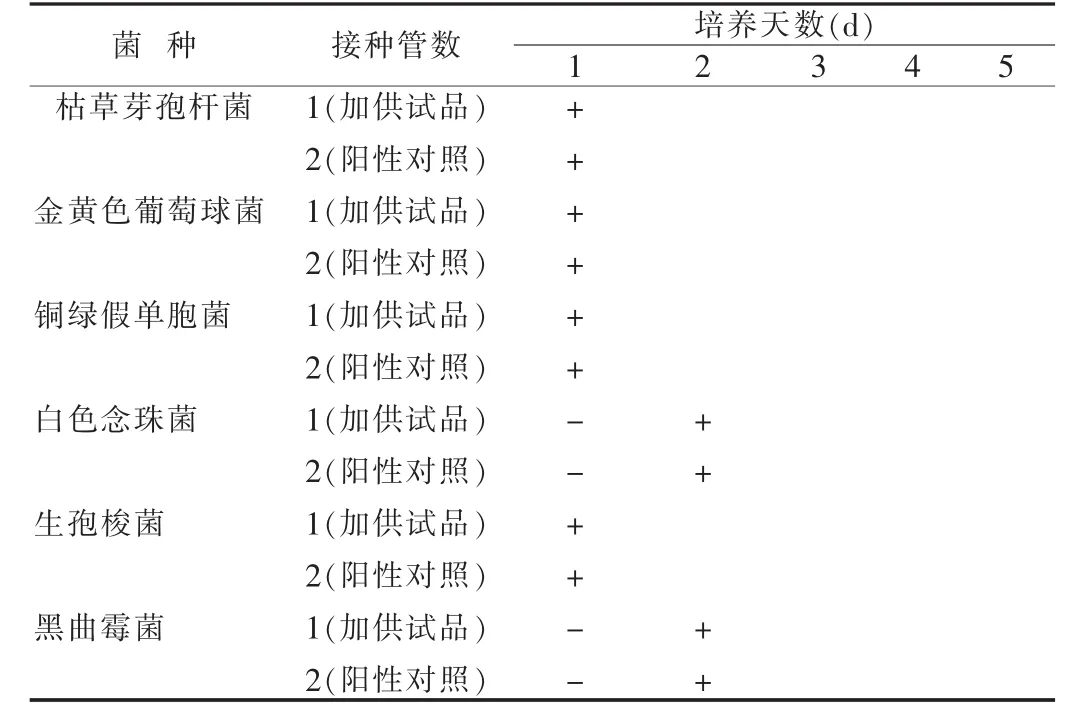
表2 注射用七叶皂苷钠实验结果
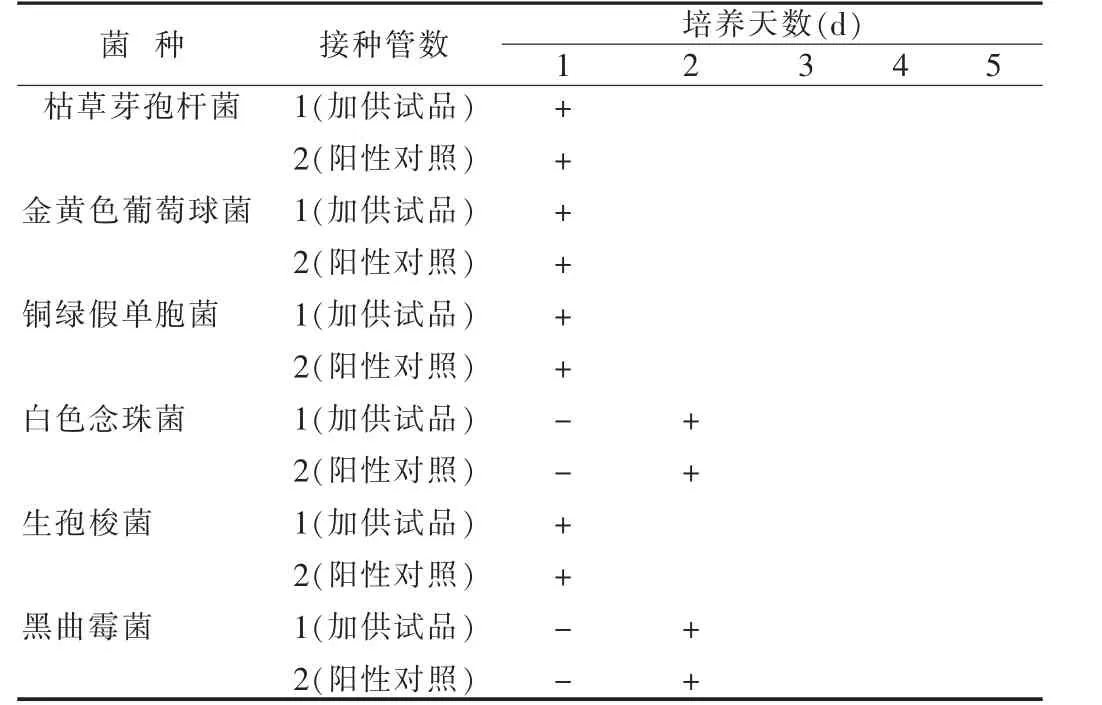
表3 注射用七叶皂苷钠实验结果
[1]马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2000:198-199.
[2]张新妹,李会轻,胡昌勤,等.无菌检查法中有关阳性对照菌规定的探讨[J].中国药师,2003,6(11):730-732.
[3]国家药典委员会.中华人民共和国药典[S].二部.北京:化学工业出版社,2005:附录 89-93.
[4]中国药品生物制品检定所.中国药品检验标准操作规范[S].北京:中国医药科技出版社,2005:313-321.
[5]沈国荣,吴建铭,缪丽燕.制剂配制设备的清洁验证[J].抗感染药学,2008,5(1):24-25.
[6]张广求.参菊洗剂微生物限度检查方法的建立[J].抗感染药学,2008,5(4):233-244.

