硫酸铁-硫酸配比对软锰矿氧化吸收H2S的影响
卢丽芬,陈学蓉,黄兆龙、*,李秀林,唐云翠,李芳
(1.红河学院理学院云南蒙自661100;2.云南省高级天然药物与化学生物学重点实验室,云南蒙自661100)
硫酸铁-硫酸配比对软锰矿氧化吸收H2S的影响
卢丽芬1,陈学蓉2,黄兆龙1、2*,李秀林1,唐云翠1,李芳1
(1.红河学院理学院云南蒙自661100;2.云南省高级天然药物与化学生物学重点实验室,云南蒙自661100)
研究了硫酸-硫酸铁酸性溶液氧化吸收硫化氢的工艺条件.采用廉价的天然原料,氧化吸收和铁盐再生同步完成,可以连续运行.工艺条件为:室温,0.5mol/L硫酸,1.0mol/L铁离子,硫化氢最大吸收率为99.2%.
硫化氢;软锰矿;硫酸铁;氧化吸收
硫化氢气体主要来自于石油低温炼焦、合成氨中的造气及硫化矿湿法冶金等工业过程中,它是环境监测的重点对象之一.工业上常使用酸性氯化铁溶液氧化吸收[1],有人报道了软锰矿氧化吸收[2]及微生物处理[3-4]等方法.化学氧化法中吸收和氧化剂再生一般采用交替进行,微生物处理法节能环保,但反应速率和范围受限.本文研究了一种利用硫酸-硫酸铁-软锰矿悬浊液联合氧化吸收硫化氢的新方法,通过硫酸铁氧化硫化氢,软锰矿氧化亚铁离子,再生出硫酸铁,并部分氧化硫化氢,使铁盐再生与气体吸收同步进行.本方法不但可降低生产成本,而且可以有效地提高硫化氢的吸收效果.吸收过程只需适时补充消耗的软锰矿和硫酸,从最终的吸收液还可提取硫酸锰、硫磺副产品.
1 实验部分
1.1 试剂与仪器
H2SO4,Fe2(SO4)3,Na2S,FeS,MnO2.所有试剂纯度均为AR.
软锰矿(取自云南建水矿山,含二氧化锰51. 8%),H2S(自制).
吸收装置:微型气体发生器与双孔具塞250mL的锥形瓶连接(吸收瓶内含硫酸铁、二氧化锰、硫酸等混合吸收液),逸出的尾气用1.0mol/L的NaOH溶液的吸收瓶吸收.发生器中含恒量的硫化钠,加入过量硫酸制备硫化氢.
1.2 实验方法
1.2.1 硫酸铁酸性溶液吸收硫化氢
在4个250mL吸收瓶中分别装入50mL不同浓度的硫酸铁(分别为1.0 mol/L和0.5mol/L)和硫酸(分别为1.0 mol/L和0.5mol/L)的混合溶液,分别定量通入H2S,尾气导入1.0mol/LNaOH溶液.每5min取2.0mL氧化吸收液测定Fe2+浓度,直至Fe2+浓度恒定为止(5分钟内通入全部气体,下同),最后取2. 0mL尾气吸收液测定Na2S浓度,计算氧化吸收率.
1.2.2 二氧化锰酸性悬浊液吸收硫化氢
在250mL锥形瓶中装入50mL浓度为1.0mol/L的硫酸溶液,加入3.0g二氧化锰粉末,振摇下定量通入H2S气体,尾气导入氢氧化钠溶液.反应一定时间后测定吸收液中的Mn2+和H2S浓度,测定尾气吸收液的Na2S浓度,计算氧化吸收率.
1.2.3 二氧化锰氧化硫酸亚铁
在250mL锥形瓶中装入50mL浓度为0.5mol/L的硫酸亚铁溶液(分别含1.0及0.5mol/L的硫酸),不断振摇.反应开始后每5min取2.00mL离心液测定Fe2+浓度,直至Fe2+被完全氧化.
1.2.4 二氧化锰-硫酸铁悬浊液吸收硫化氢
在250mL锥形瓶中装入50mL含有硫酸的硫酸铁溶液,混合液中硫酸浓度和Fe3+浓度均分别取1. 0mol/L、0.5mol/L两种水平(共四种组合).
加入3.0g二氧化锰,摇匀,振摇下持续通入H2S气体一定时间,尾气用1.0mol/L氢氧化钠溶液吸收.反应完毕后测定吸收液中的Mn2+和H2S浓度,测定尾气吸收液的Na2S浓度,计算氧化吸收率.用软锰矿代替二氧化锰试剂吸收时,按实际MnO2含量换算出软锰矿用量,吸收监测时的Mn2+扣除原矿中浸出的Mn(II)量.
1.2.5 吸收液各成分的检测
硝酸铵-硫酸亚铁法测定吸收液中被还原的锰离子.重铬酸钾法测定吸收液中被还原的二价铁离子.碘量法测定氧化吸收液及尾气吸收液中的硫化物[7].
2 结果与讨论
2.1 酸度对硫酸铁吸收H2S的影响
用4份不同浓度配比的硫酸和硫酸铁吸收液吸收硫化氢后的C(Fe2+)与时间的关系见图1.反应5min后,吸收液中已经检验不出硫化氢(用1%的硫酸铜检验吸收液无黑色沉淀).

表1 酸度-铁浓度对硫化氢吸收效果的影响
从表1可以看出:3号配比液的吸收率较高(低酸低铁),15min之后C(Fe2+)已经接近恒定,表明已吸收完全.对于低酸高铁及高酸低铁的吸收效果均不好,特别是高酸低铁的A线吸收率最低.其原因可能是:硫化氢在高酸条件下容易逸出,故高酸低铁时吸收最差.考虑到Fe3+容易水解,吸收液的酸度不应太低,选择0.5mol·L-1硫酸+1.0 mol·L-1Fe3+的组成.
2.2 酸度对二氧化锰吸收硫化氢的影响
表2给出了二氧化锰悬浊液对硫化氢的吸收率与硫酸浓度的关系,根据反应液中的c(Mn2+)可以计算氧化吸收的硫化氢量.
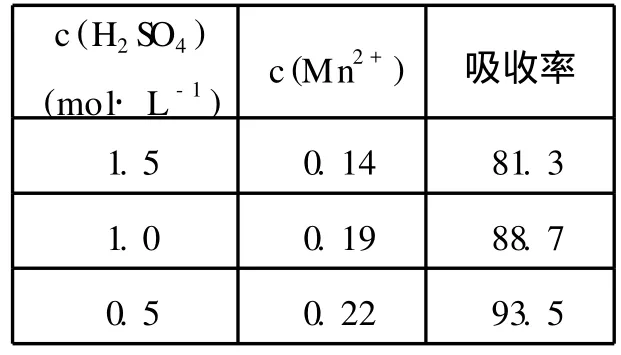
表2 酸度对二氧化锰吸收硫化氢效率的影响
从表2可以看出,室温下,二氧化锰对硫化氢也有较好的吸收效果,酸度减小,吸收率增大,可能是硫化氢的溶解度随酸度的增大减小,所以,二氧化锰氧化吸收宜在低酸进行.
2.3 二氧化锰氧化硫酸亚铁的速率分析
图1是1.0和0.5mol/L硫酸溶液中,二氧化锰氧化硫酸亚铁的氧化率与时间的关系.

图1 硫酸浓度对H2S吸收率的影响
从图1看出,在两个酸度下二氧化锰对亚铁离子的氧化率都很高,5min即可将大部分亚铁氧化到三价铁,因为该反应是耗酸的反应,酸度增大,可以提高氧化速率.可见,用二氧化锰来再生三价铁是可行的.
2.4 二氧化锰-硫酸铁混合吸收液浓度与吸收率的关系
表3列出了硫酸及硫酸铁的不同浓度配比(含3.0g二氧化锰,持续通入一定量的硫化氢)与吸收液的锰离子浓度及吸收率的关系.

表3 硫酸和硫酸铁浓度对硫化氢吸收率的影响
从表3看出,高酸低铁时吸收率最大.低酸低铁吸收率最小,原因可能是二氧化锰氧化亚铁离子,以及氧化硫化氢时都要耗酸,故提高酸度有利于铁离子的再生,也有利于提高H2S的吸收率.但在高酸时(1. 0 mol/L),提高Fe3+浓度,H2S的氧化率会降低,这与单纯酸性硫酸铁吸收硫化氢的结果相反,因为存在过量二氧化锰,可随时保持较恒定的Fe3+浓度,具有稳定的氧化作用,另外,估计悬浊液的流动性不同,影响了硫化氢的溶解性质及氧化率.此外还表明,提高酸度比提高铁离子浓度更有利于硫化氢的吸收.
根据以上实验,可得到采用硫酸铁-二氧化锰氧化吸收H2S的实验条件是:
(1)酸度:1.0mol·L-1硫酸.在吸收过程中需间歇地补充消耗的硫酸.
(2)硫酸铁浓度:0.5mol·L-1(C(Fe3+)).
(3)二氧化锰用量:3.0gMnO2/50mL吸收液,软锰矿按MnO2实际含量换算加入.
结论
软锰矿-硫酸铁联合吸收硫化氢方案是可行的,吸收条件为:室温,0.5mol·L-1硫酸,1.0mol·L-1铁离子.原料廉价易得,氧化吸收和试剂再生同步完成.方法简单、适用、投资小,适合间歇式产生H2S的中小型企业.
[1]吴红应,董放战,牛利民.硫化氢废气处理新方法研究[J].无机盐工业,2006,38(10):53-56
[2]汪云华,彭金辉,关晓伟等.氧化吸收硫化氢的新工艺研究[J].无机盐工业,2006,38(6):49-50
[3]蒲万芬,胡佩.酸性气体中硫化氢的微生物脱除方法[J].天然气工业,2005,25(3):166-170
[4]Yang Y H,Allen E R.Biofiltration controlof hydrugen sulfide 1.Design and operational parameters[J].Journal of the Air andWasteManagenmentAssociation,1994,44:863-868
[责任编辑 张灿邦]
The Effects of Iron Sulfate and Sulfuric Acid Ratio on Oxygen Absorption for H2S with Pyrolusite
LU L i-fen1,CHEN Xue-rong2,HUANG Zhao-long1,2*,L I X iu-lin1,TANG Yun-cui1,L I Fang1
(College of Science,Honghe University,Mangzi 661100,China)
oxygen absorption technics of hydrogen sulfide in the solution of iron sulfate and sulfuric acid was studied.By using low cost the naturalmaterial,the procedure of oxygen absorption and ferric salt regeneration occurred simultaneously,continuous operation.the optimum conditions were as follows:0.5mol/L H2SO4,1.0mol/L Fe3+at room temperature.Maximum H2S absorbency of the solution was 99.2%.
hydrogen sulfide;pyrolusite;iron sulfate;oxygen absorption
book=4,ebook=39
O652
A
1008-9128(2011)02-0012-03
2011-01-18
红河学院大学生科技创新基金项目(SSTIF1014)
卢丽芬(1987-),女(白族),云南祥云人,红河学院07级化学专业学生.
黄兆龙(1958-),男,教授.研究方向:冶金分析和资源综合利用.

