马尔堡病毒核蛋白的原核表达及纯化
王皓婷 ,王水明 ,史子学 ,邵东华 ,魏建超 ,刘学辉 ,王志亮 ,王雪敏 ,马志永
(1.中国农业科学院上海兽医研究所兽医公共卫生研究室,上海 200241;2.河北工程大学农学院,河北 邯郸056001;3. 南京出入境检验检疫局,江苏 南京 211106;4. 中国动物卫生与流行病学中心,山东 青岛 266114)
马尔堡出血热是由马尔堡病毒引起的一种致死率极高的烈性传染病。最早有关马尔堡出血热爆发的记录是在1967年德国马尔堡。据报道当时有31人感染病毒发病,其中7人死亡。这31个感染病毒的人中有25人是由于接触了感染马尔堡病毒的猴子而致病的[1]。马尔堡病毒可由人与人之间的亲密接触传播,传染性强。目前尚没有有效的疫苗和特效的治疗药物。
感染马尔堡病毒后,潜伏期约为5天,发病后症状表现为发烧、浑身发冷、头痛、肌肉痛。随后有些人会出现皮疹的症状,大部分人会有恶心、呕吐、腹泻、骨头疼痛及腹痛等症状。随着时间的推移,症状可能会越来越严重,最终导致大量出血及多器官功能障碍[2]。大多数病人在感染病毒后的两周内会死亡。病毒可通过人与人之间的直接接触而传播,也可通过接触马尔堡出血热患者的体液或遗骸而使健康人感染[3]。到目前为止,该病毒的自然宿主尚不能确定,但多数学者怀疑与蝙蝠有关[4-5]。
马尔堡病毒和埃博拉病毒共同构成丝状病毒属,但属两个不同的种系[6]。马尔堡病毒只有一种血清型。在电子显微镜下观察呈不同的形态,多为长细丝状,也有时呈卷曲的蚯蚓状或6形、环形。病毒颗粒直径较一致,约80~100 nm,但长度差异较大,一般为 300~1500 nm,病毒表面有一层蛋白包膜,具有抗原性[7-8]。马尔堡病毒基因组全长约19 kb,为单股负链RNA病毒。基因组编码7种病毒蛋白,包括核蛋白(NP)、基质蛋白 VP24和VP40、结构蛋白 VP30和VP35、依赖RNA的RNA多聚酶(L蛋白)、糖蛋白7(gp7)[9]。由于核蛋白有很强的抗原性,故将核蛋白亚克隆入原核表达质粒。成功表达后,利用His-Band Ni+柱进行亲和层析纯化,获纯化蛋白,用于后续研究。
1 材料和方法
1.1 实验材料
原核表达质粒 pET-28(a)、大肠杆菌 DH5 α、BL21(DE3)菌体、IPTG、抗生素等由本实验室保存;各种限制性内切酶购自大连宝生物公司;T4连接酶购自Invitrogen公司;His Bank Kits蛋白质纯化试剂盒购自Novagen公司;普通质粒小量提取试剂盒和DNA片段胶回收试剂盒购自博大泰克生物技术公司;辣根过氧化物酶(HRP)标记的羊抗鼠二抗为美国Sigma公司产品;其他试剂均为国产分析纯;马尔堡病毒核蛋白基因(GenBank No: Z29337.1)由南京金思特科技有限公司合成。
1.2 实验方法
1.2.1 基因克隆与原核表达载体的构建
在基因合成前的设计阶段,将HindⅢ和EcoRⅠ的酶切位点插入到马尔堡病毒NP基因的两端。合成的NP基因克隆至pUC57质粒中。对PUC57-MNP质粒进行HindⅢ和EcoRⅠ的双酶切,酶切完毕后对酶切产物进行琼脂糖凝胶电泳,利用胶回收试剂盒回收约2100 bp的目的片段,将回收产物亚克隆入pET-28(a)载体,构建 pET-28(a)-M-NP 重组质粒。
重组质粒构建好后,按常规方法转化感受态E. coli DH5α,涂布卡那霉素抗性平板,挑单克隆摇菌12 h后,提取质粒,用HindⅢ和 EcoRⅠ进行双酶切,酶切产物经琼脂糖电泳进行分析鉴定。将阳性重组质粒送往上海桑尼公司进行目的片段的序列测定。
1.2.2 目的基因的诱导表达
将重组质粒用热休克法转化感受态细菌E.coliBL21(DE3),挑取单克隆培养,37 ℃振荡培养12 h后,按1:100 比例转种,接种100 mL含有卡那霉素(终质量浓度为50 g/mL)的LB液体培养基,37 ℃振荡培养3 h。3 h后以终浓度0.5 mmol/L 的IPTG诱导目的蛋白表达。诱导表达4 h后,以12000 r/min转速,离心5 min收菌。菌体沉淀用20 mL裂解buffer重悬,置于摇床中振荡裂解1 h。1 h后超声冰浴破菌。裂解后的菌液,在4 ℃下以5000 r/min离心10 min,将离心后的沉淀和上清分别收集并分别制备样品,以10%SDS-PAGE分析重组蛋白的表达情况。沉淀用8 ml含6M尿素的1×Binding buffer重悬,置4 ℃过夜。
1.2.3 表达产物的纯化
将诱导后表达的蛋白用His-Band Ni+柱进行亲和层析纯化,8%SDS-PAG检测纯化效果。
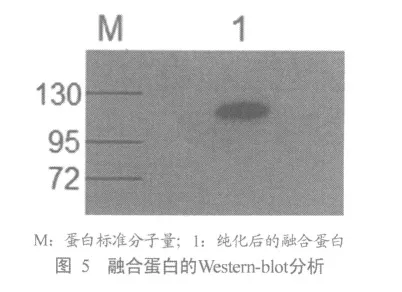
1.2.4 融合蛋白的Western-blot分析
按照常规方法进行Western-blot分析,一抗为His抗体,稀释度为1:3000。二抗为辣根过氧化物酶标记的羊抗鼠抗体,稀释度为1:5000。具体步骤参照《分子克隆试验指南》。
2 结果
2.1 原核重组表达载体pET-28(a)-M-NP的构建和测序
马尔堡病毒NP基因全长2088 bp,亚克隆入pET-28(a)载体,对重组质粒进行HindⅢ和 EcoRⅠ的双酶切。以1%琼脂糖凝胶电泳分析双酶切产物,在与预期相符的约2100 bp 处有特异性条带(图1),表明马尔堡NP基因已成功克隆到原核表达质粒。将重组质粒送往上海桑尼公司进行序列测定后,结果表明目的片段序列正确没有突变。
2.2 重组蛋白的表达
将鉴定后序列正确的重组质粒转化大肠杆菌BL21(DE3),以终浓度1 mmol/L的IPTG诱导6 h,诱导前后分别取1 mL菌液制样,以10%SDS-PAGE电泳鉴定后,证明目的蛋白成功表达(图2)。
将pET-28(a)诱导后,pET-28(a)-M-NP诱导前后,超声后离心的上清和沉淀分别制样,10%SDS-PAGE检测表达情况。图3表明重组蛋白在上清沉淀中均有表达。上清在非变性条件下,沉淀在变性下分别纯化。

2.3 NP重组蛋白的纯化
用含6M尿素的1×Bingbuffer将超声裂解后离心的沉淀重悬过夜,在变性条件下用His-Band Ni+柱进行亲和层析纯化。将破菌上清在非变性条件下用His-Band Ni+柱进行亲和层析纯化,10%SDS-PAGE检测纯化结果(图4)。
2.4 重组核蛋白的Western-blot分析
融合蛋白带有His标签,以Anti-His单克隆抗体对重组核蛋白进行Western-blot分析发现,在约97KD处有特异性反应条带显现(图5)。说明融合蛋白可以与Anti-His单克隆抗体发生特异性反应。
3 讨论
感染病毒的非人灵长类动物和病人是主要传染源,且症状越重的患者传染性越强,潜伏期的患者传染性较弱。目前我国境内尚无此病症,但由于此病的危害性较大,建立完善检测方法是当务之急。
本实验利用大肠杆菌表达系统获取重组蛋白。大肠杆菌表达系统虽不能完全真实反映蛋白的天然构象,但由于此方法操作简便成本低廉,便于大规模生产。大肠杆菌表达系统的产物易于纯化且无感染性[10]。
为了便于目的蛋白的纯化,在重组表达外源蛋白时引入His标签。His标签有表达方便不影响蛋白活性等优点。本实验选用大肠杆菌表达系统以及His标签作为目的蛋白的纯化标签,所得到的重组蛋白可用于后续检测方法的研究。
[1]Siegert R,Shu HL,Slenczka W,et al.On the etiology of an unknown human infection originating from monkeys[J].Dtsch Med Wochenschr,1967,92(51):2341–2343.
[2]Centers for Disease Control and Prevention(CDC).Outbreak of Marburg virus hemorrhagic fever—Angola,October 1,2004–March 29,2005[J].MMWR Morb Mortal Wkly Rep,2005,54(12):308–309.
[3]World Health Organization(WHO).Marburg haemorrhagic fever–fact sheet Geneva[EB/OL].(2009-06-03). http ://www.who.int/csr/disease/marburg/factsheet/en/index.html.
[4]Towner JS,Pourrut X,Albarinn~o CG,et al.Marburg virus infection detected in a common African bat[J/OL].PLoS ONE,2007,8(2):e764.http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0000764.
[5]Swanepoel R,Smit S B,Rollin PE,et al.Studies of reservoir hosts for Marburg virus[J].Emerg Infect Dis,2007,13(2):1847–1851.
[6]Heinz F,Viktor E,Valentina A,et al.Biosynthesis and role of filoviral glycoproteins[J].J Gen Virol.2001,82(12):2839-2848.
[7]Sancheza A,Trappiera S G,Stroherb U,et al.Variation in the Glycoprotein and VP35 Genes of Marburg Virus Strains[J].Virol,2004,240(1):138-146.
[8]Peterson A T,Bauer J T,Mills J N.Ecological and geographic distribution of fi lovirus disease[J].Emerging Infectious Diseases.2004,10(1):40-47.
[9]Grolla A,Lucht A,Dick D,et al.Laboratory diagnosis of Ebola and Marburg hemorrhagic fever.Bull Soc Pathol Exot,2005,98(3):205–209.
[10]唐以杰,陈清池.利用大肠杆菌获取重组蛋白的研究进展[J].广东教育学院学报,2001,21(2):60-63.

