猪传染性胃肠炎病毒与猪呼吸道冠状病毒荧光RT-PCR鉴别检测方法建立与应用
王慧珊 ,高志强 ,王金宝 ,张鹤晓 ,乔彩霞 ,吴亚琼 ,邢佑尚 ,朱淑芬
(1. 青岛农业大学动物科技学院,山东 青岛,266109;2. 北京出入境检验检疫局,北京 通州,101113;3. 山东省农业科学院,山东 济南,250100;4. 山东农业大学,山东 泰安,271018)
猪传染性胃肠炎(TGE)是由猪传染性胃肠炎病毒(TGEV)引起的一种高度接触传染性肠道疾病,临床上以病猪呕吐、严重腹泻和失水为主要特征,不同品种、年龄的猪只都可感染发病,尤以两周龄以内仔猪、断奶仔猪易感性最强,致死率高,可达100%[1]。该病是一种世界性疾病,给畜牧业生产带来巨大的经济损失,早发现、早确诊对该病的防治意义重大。要做到早确诊就需要快速、敏感、特异的诊断方法。
目前,检测TGEV的常规方法主要有病毒分离鉴定、病毒中和试验、免疫荧光抗体试验、电镜观察、免疫电镜观察、ELISA方法[2]、核酸探针杂交技术[3]、普通RT-PCR技术[4]、多重RT-PCR技术等。这些方法在过去对猪传染性胃肠炎的防制和诊断上起到了重要的作用,但是这些技术要么操作繁琐,周期长,要么灵敏性差,只能进行定性检测而不能定量分析。实时荧光定量RT-PCR技术具有高敏感性、高特异性、高精确定量和方便快捷等优点,非常适用于病毒感染的检测,尤其是感染早期检测。为此我们建立了针对TGEV的TaqMan荧光定量RT-PCR检测方法,为TGEV感染的早期诊断及流行病学调查提供了一种简便、快速、高效、敏感、特异的方法。
猪呼吸道冠状病毒(PRCV)和TGEV在结构上非常相似,同源性达96%以上,被认为是TGEV的自然突变株[5]。在基因结构上,相比TGEV,PRCV只是S基因缺失了B、C两个抗原位点,只针对保守基因N基因建立检测方法可能会对PRCV造成错检。因此,本研究除针对保守基因设计引物探针,同时针对PRCV S基因的缺失位点设计引物探针来进一步区分PRCV和TGEV。
1 材料与方法
1.1 病毒株
灭活的猪传染性胃肠炎病毒标准株Purdue P115、蓝耳病病毒核酸、猪伪狂犬病毒核酸、猪呼吸道冠状病毒核酸,均由本实验室保存;猪链球菌2型分离株C55606核酸,由中国兽医药品监察所提供。
1.2 主要试剂及仪器
Trizol,购自Invitrogen公司;Taq DNA聚合酶、M-MLV反转录酶, dNTP、RNA酶抑制剂等购自Promega公司。
主要仪器有台式冷冻高速离心机(Eppendorf Centrifuge 5417R);荧光定量 PCR仪(Roche Light CyclerⅡ)。
1.3 引物与探针的设计和合成
从GenBank登录的TGEV分离株获得不同基因型代表毒株的序列,利用DNAMAN基因分析软件对其进行同源性分析,选择序列中高度保守的区域作为荧光定量RT-PCR扩增的区域,利用Oligo6.3软件设计引物和探针。本实验针对保守基因N基因设计一对引物与Taqman探针,目的片段大小为144bp,同时针对S基因的B、C位点设计另一对引物与探针来区分TGEV与PRCV,目的片段为125 bp。
P1(N): CTGAAAGGTGGTTCTTCTAC
P2(N : CATTATTAGCACCACGACTA
Probe(N):5'FAM-CCTTGGCAACCCAGACAA CTCC-TAMRA 3'
P1(S):TCTGCTGAAGGTGCTATTAT
P2(S):GAAGGACATATAGGGAACTTAT
Probe(S):5'FAM-CACTCACTACCCCAATTGC AAGTC-TAMRA 3’
引物和探针均由大连宝生物工程有限公司合成。
1.4 病毒RNA的提取
按照Trizol(Invitrogen公司)说明书从TGEV细胞培养物中提取总RNA。
1.5 荧光RT-PCR反应条件的优化
1.5.1 引物和探针浓度的优化
将引物浓度从 0.1 μM 至 0.8 μM 以 0.1 μM 间隔递增,探针浓度从 0.025 μM 至 0.2 μM 以 0.025 μM 递增。对引物和探针不同浓度的配比进行比较。
1.5.2 Mg2+浓度的优化
应用筛选好的引物探针,将Mg2+的浓度从1.5 mM至6.0 mM以0.5 mM间隔递增。对不同Mg2+浓度条件下的扩增进行比较。
1.5.3 其它条件的优化
应用筛选好的引物探针和Mg2+的浓度,进一步对Taq DNA聚合酶用量,多种逆转录酶,循环参数等条件进行优化。
1.6 灵敏度试验
将 提 取 的 RNA(8.97lgTCID50/0.01mL)作101~1010倍稀释,进行TGEV荧光RT-PCR检测,测定检测极限。同时用常规RT-PCR检测方法对其进行检测,比较两种检测方法的灵敏性差异。
1.7 标准曲线的建立
对不同稀释度TCID50病毒RNA按最佳条件进行荧光RT-PCR测定,并用去离子水作为阴性标准,对所获得的Ct值作为定量参数对不同稀释度的对数值做线性回归。
1.8 特异性试验
利用本实验所建立的定量RT-PCR检测方法对猪传染性胃肠炎病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪呼吸道冠状病毒和猪链球菌同时进行检测,设立阴、阳性对照,验证方法的特异性。
1.9 重复性试验
对3个不同浓度TCID50病毒核酸用所建立的检测方法分别检测3次,根据其Ct值求出变异系数,以验证方法的可重复性和稳定性。
1.10 临床送检样品的检测
对山东、辽宁等地3个猪场送检的39份粪便样品进行处理,提取RNA,应用荧光定量RT-PCR方法检测。同时用常规RT-PCR方法进行检测,并对结果和流行状况进行分析。
2 结果
2.1 反应条件的优化结果
经过多次重复试验优化,建立反应体系:5×RTPCR buffer 5 μL,引 物 P1(N,10 μM)0.5 μL,引 物P2(N,10 μM)0.5 μL,探针 Probe(N, 10 μM)0.3 μL,dNTP(2.5 μM)2μL,M-MLV 反 转 录 酶 0.5 μL,RNA 酶抑制剂 0.25 μL,Taq酶 0.25 μL,RNA 模板10 μL,补水至 25 μL。对于进一步鉴别 TGEV 与 PRCV的检测方法,建立反应体系:5×RT-PCR buffer 5 μL,引物 P1(S,10 μM),引物 P2(S,10 μM)各 0.75 μL,探 针 Probe(S,10 μM)0.4 μL,dNTP(2.5 μM)2 μL,M-MLV 反转录酶 0.5 μL,RNA 酶抑制剂 0.25 μL,Taq 酶 0.25 μL,RNA 模板 10 μL,补水至 25 μL。
2.2 荧光定量RT-PCR反应参数的优化
从多次重复性试验中发现,该检测方法最适循环参数为 42℃ /30 min,94℃ /3 min;94℃ /10 s,55℃/10 s,60℃/30 s;45个循环,60 ℃时收集荧光。
鉴别TGEV与PRCV的检测方法最适循环参数为 42℃ /30 min,94℃ /3 min;94℃ /10 s,54℃ /10 s,60℃/30 s;45个循环,60℃时收集荧光。
2.3 灵敏度试验
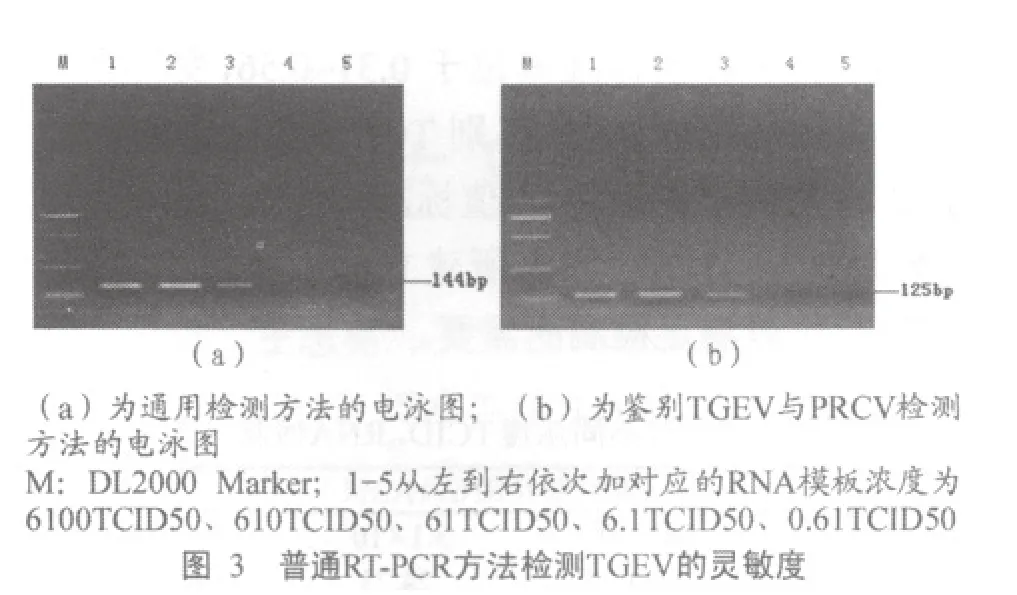
将病毒RNA进行10倍系列稀释,两个荧光定量RT-PCR检测方法结果显示检测极限均可达0.61TCID50。图1为传染性胃肠炎病毒的灵敏度检测结果。图2为鉴别TGEV与PRCV的检测方法的灵敏度结果。而普通RT-PCR检测结果通过2.5%琼脂糖凝胶电泳显示,前三个稀释度为阳性,即检测极限为61TCID50,(图3)。由此可见荧光定量RT-PCR方法比普通RT-PCR方法敏感性约高100倍。
2.4 标准曲线的建立
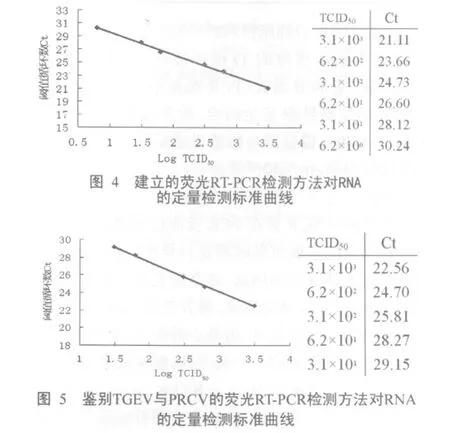
通过测定每一稀释度病毒RNA的Ct值,进而与原浓度的对数值线性回归作图。结果在所测定的浓度范围内,样品的浓度与对应的Ct值呈现明显的线性相关关系,其回归曲线的斜率为-3.354 4,截距为32.928,相关系数R2为0.9965。鉴别TGEV与PRCV的检测方法也呈现良好的线性相关关系,回归曲线斜率为-3.348,截距为34.173,相关系数R2为0.998 9。说明建立的检测方法相关性良好,可以用于病毒RNA的定量检测(图 4、图 5)。
2.5 特异性试验
利用本实验所建立的定量RT-PCR检测方法对猪传染性胃肠炎病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪呼吸道冠状病毒、猪链球菌进行检测,结果TGEV与PRCV呈现阳性,其他均为阴性。再对其呈现阳性的用鉴别TGEV和PRCV的检测方法进行进一步检测,结果仅TGEV呈阳性,而PRCV则呈阴性。
2.6 重复性试验
对不同浓度TCID50病毒核酸用所建立的检测方法重复检测3次,结果如表1,对通用检测方法不同试验获得的Ct值标准差位于0.31~0.56,变异系数为1.0%~2.3%;如表2,对鉴别TGEV和PRCV的检测方法,不同试验获得的Ct值标准差位于0.4~0.5,变异系数为1.3%~1.9%,证实所建立的方法重复性、稳定性良好,可以满足检测的需要。
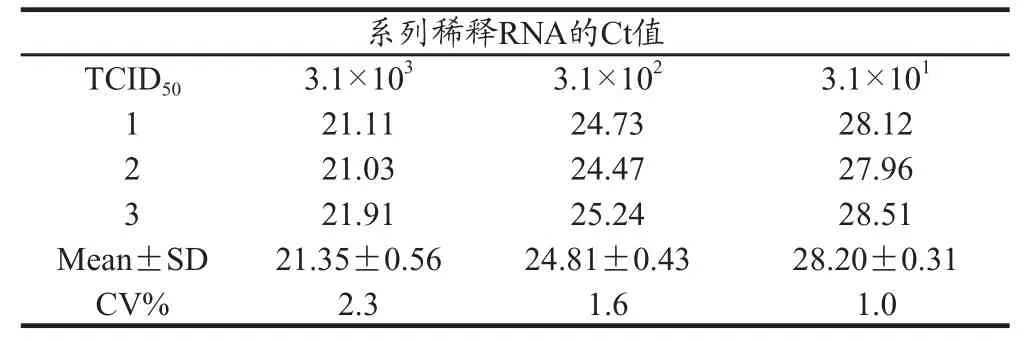
表1 TGEV对不同浓度TCID50RNA检测的重复性
2.7 建立方法对临床样品的检测结果
对3个猪场送检的39份样品进行荧光定量RTPCR检测,并和普通RT-PCR检测结果进行了对比,两种方法检测结果完全吻合,检测结果的阳性率为20.5%(8/39)。说明国内猪场里感染猪传染性胃肠炎病毒比较普遍,情况较严重。
3 讨论
荧光定量PCR是在PCR反应过程中通过连续监测荧光信号的强弱来即时测定特异性产物的量,并据此推断目的基因的初始量。这是近几年一种新型的核酸定性定量技术,灵敏度高,特异性好,又具有可实时监测、速度快、操作简单、污染少等优点,是当前病毒、细菌检测技术发展的一个新方向。根据采用的荧光材料不同,荧光定量PCR分为SYBR Green I染料法、TaqMan探针法、分子信标法、杂交探针法等[6]。其中,SYBR Green I染料与任何双链DNA都可结合,容易产生非特异性荧光,而TaqMan探针法具有高特异性,与分子信标法等相比设计相对简单,且重复性好,因此被普遍使用,本研究也使用本方法。
本试验以TGEV N基因为靶基因序列设计了检测TGEV的特异性引物和探针序列,建立了用于快速检测TGEV的TaqMan探针荧光定量RT-PCR方法。但由于TGEV与PRCV具有很高的同源性,针对N基因为靶基因的检测方法区别不出TGEV与PRCV,因此又建立了针对PRCV的缺失区域为靶基因的进一步的检测方法,在检测中,第一步检测结果呈阳性时则进行第二步检测,来区分TGEV与PRCV,提高了检测TGEV的准确性。本方法的检测敏感性达到0.61TCID50,与常规RT-PCR检测方法相比,灵敏度高100倍,且假阳性低,不易污染,扩增与检测一步完成,不需要对产物进行电泳等后期处理,操作更简便。
利用本试验建立的TaqMan探针荧光定量RTPCR检测方法,可以对猪传染性胃肠炎病毒感染发病猪早期进行快速检测、流行病学调查和实时监测,具有重要的临床实用意义。
[1] Straw B E,Daiiaire S,Mengeling W I,et a1. Diseases of Swine[M].8th. Iowa:Iowa State University Press,1999:295-325.
[2] Carman S, Josephson G. Field validation of a commercial blocking ELISA to differentiate antibody to transmissible gastroenteritis virus(TGEV)and porcine respiratory coronavirus and to identify TGEV-infected swine herds [J]. Vet Diagn Invest,2002,14(2):97-105.
[3] Ba I, Jackwood D J, Benfield D A. Differentiation of transmissible gastroenteritis virus from porcine respiratory coronavirus and other antigenically related coronaviruses by using cDNA probes specifi c for the 5 region of the S glycol-protein gene[J]. J Clin Microbiol,1991,29(1):215-218.
[4] 贾赟,胡传伟,简中友,等.检测猪传染性胃肠炎病毒RTPCR方法的建立[J].检验检疫科学,2006,16(4):12-15.
[5] CHAE C, KIM O, MIN K, et al. Seroprevalence of porcine respiratory coronavirus in selected Korean pigs [J]. Prev Vet Med,2000,46(4):293-296.
[6] 阳成波,印遇龙,黄瑞林,等.实时定量RT-PCR的原理及方法[J].免疫学杂志,2003,19(3): 145-150.

