染色体3p区抑癌基因在非小细胞肺癌中的甲基化状况与临床意义
宋海珠 易俊 张有为 王锐 陈龙邦
DNA甲基化是表观遗传学的一种调控机制,抑癌基因启动子区域CpG岛的异常高甲基化,使染色质螺旋程度增加,基因转录受到抑制,与肿瘤发生密切相关[1]。肺癌,以非小细胞肺癌(non-small cell lung cancer,NSCLC)为主,是世界范围内癌症致死的首要原因。研究NSCLC特异的DNA甲基化将为揭示其发病机制提供线索并可能作为潜在的生物标记。
染色体3p区等位基因缺失是肺癌发生中较频繁和早期的事件之一,其中3p12-13、3p14.2、3p21.1-21.2、3p21.3和3p24-26等被证实是缺失的热点区域,提示在这些区域存在多个抑癌基因[2,3]。本实验以改良的甲基化特异性聚合酶链反应(methylation specific PCR, MSP)检测78例NSCLC组织中3p区抑癌基因DLEC1(deleted in lung and esophageal cancer 1)、RASSF1A(Ras associated domain family member 1)、hMLH1 (mutL homolog 1)、RARβ(retinoic acid receptor β)和FHIT(fragile histidine triad gene)的甲基化状况,并分析与临床病理特征的关系。
1 材料与方法
1.1 标本 78例NSCLC组织标本(癌组织及癌旁>5 cm处或切缘处正常组织)源自2007年11月-2008年7月于南京军区南京总医院心胸外科行手术治疗者。所有患者均经病理检查确诊,术前未行放射治疗或化学治疗,其中男58例,女20例,年龄35岁-80岁,中位年龄59岁。根据国际抗癌联盟(Universal Integrated Circuit Card, UICC)第7版指南进行分期,其中I期25例,II期33例,III期19例,IV期1例(脑转移)。
1.2 DNA提取 采用QIAamp DNA Mini Kit试剂盒(德国Qiagen公司)提取组织DNA。操作严格依照说明书进行。
1.3 亚硫酸氢盐修饰 采用EZ DNA Methylation-GOLD Kit(D5006)试剂盒(美国Zymo Research)。组织DNA经分光光度计测定浓度后取1 μg进行修饰。最后以10 μL M-Elution Buffer洗脱DNA,-80oC保存。经此步后,DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U)。
1.4 采用MSP法检测基因启动子区甲基化状况 各引物序列及反应条件见表1。PCR反应体系25 μL,其中10×PCR buffer 2.5 μL (含Mg2+,终浓度为1.5 mmol/L),dNTP mixture 2.5 μL(终浓度250 μmol/L),上下游引物各2 μL(30 pmol),修饰后的DNA模板5 μL,灭菌去离子水10.85 μL,Taq酶0.15 μL(日本Takara公司)。正常人外周血淋巴细胞DNA作为非甲基化阳性对照,过量CpG(SssI)甲基化酶(美国New England Biolabs 公司)修饰的淋巴细胞DNA作为甲基化阳性对照,ddH2O代替DNA作为阴性对照。
1.5 采用RT-PCR检测DLEC1基因的表达 采用Trizole一步法进行组织RNA的抽提,3 μL RNA样品用1%琼脂糖凝胶电泳检测RNA的完整性。RNA定量后取2 μg进行逆转录反应(first strand cDNA kit, Takara),之后以25 μL反应体系进行体外PCR扩增。DLEC1及DAPDH引物见表1。PCR产物于2%琼脂糖凝胶中电泳,在图像扫描仪下观察,用SmartView生物电泳图像分析系统处理,并用同一样品的GAPDH扩增产物作为内参照进行校正,得出目的条带与内参照条带的吸光度比值。
1.6 免疫组织化学法检测DLEC1基因的表达 石蜡包埋切片经脱蜡、水化、抗原修复后,EnVision二步法检测DLEC1蛋白表达,兔抗人DLEC1单抗(Sigma公司,1:200稀释)4 °C孵育过夜,PBS冲洗,二抗(Dako, Ely, UK)室温孵育30 min,DAB显色,苏木素复染。实验同时以PBS代替一抗作空白对照。DLEC1蛋白表达定位于细胞浆,为黄-棕黄色颗粒,采用半定量积分法判定结果。于高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个),具体标准如下:(1)阳性细胞数0-5%为0分,6%-25%为1分,26%-50%为2分,>50%为3分;(2)阳性强度无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将(1)(2)两者积分相加,癌组织总分低于相应正常组织者为低表达。
1.7 统计学方法 采用SPSS 12.0软件进行统计分析,结果以Mean±SD或百分比表示。DLEC1表达差异采用配对t检验;率的比较采取χ2检验或Fisher确切概率法;甲基化指数(methylation index, MI),定义为每个样本发生甲基化的位点与检测的总位点的比值,组间差异比较行方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织甲基化状况 DLEC1、RASSF1A、RARβ和hMLH1在78例NSCLC肿瘤组织中的甲基化频率分别为41.03%、39.74%、30.77%和16.67%,而在相应正常组织中为3.85%、7.69%、8.97%和5.13%,差异均具有统计学意义(表2)。联合检测这4个基因甲基化在肿瘤组织中的阳性率达到69.23%,正常组织中为16.67%(P<0.001)。FHIT基因在所检测的40例样本中,无论癌组织还是正常组织均无甲基化。典型MSP结果见图1。
2.2 DNA甲基化与临床病理特征的相关性 DLEC1基因甲基化与NSCLC临床分期(I/II vs III/IV: 19/58 vs 13/20;P=0.011)和淋巴结转移(N0 vs N1/N2/N3: 13/54 vs 19/34;P=0.019)有关,在不同年龄、性别、分化程度、肿瘤大小和是否吸烟的患者之间,DLEC1启动子异常甲基化检出率无差异。而RASSF1A、RARβ、hMLH1基因甲基化以及平均甲基化指数与临床病理特征无关联(表3)。
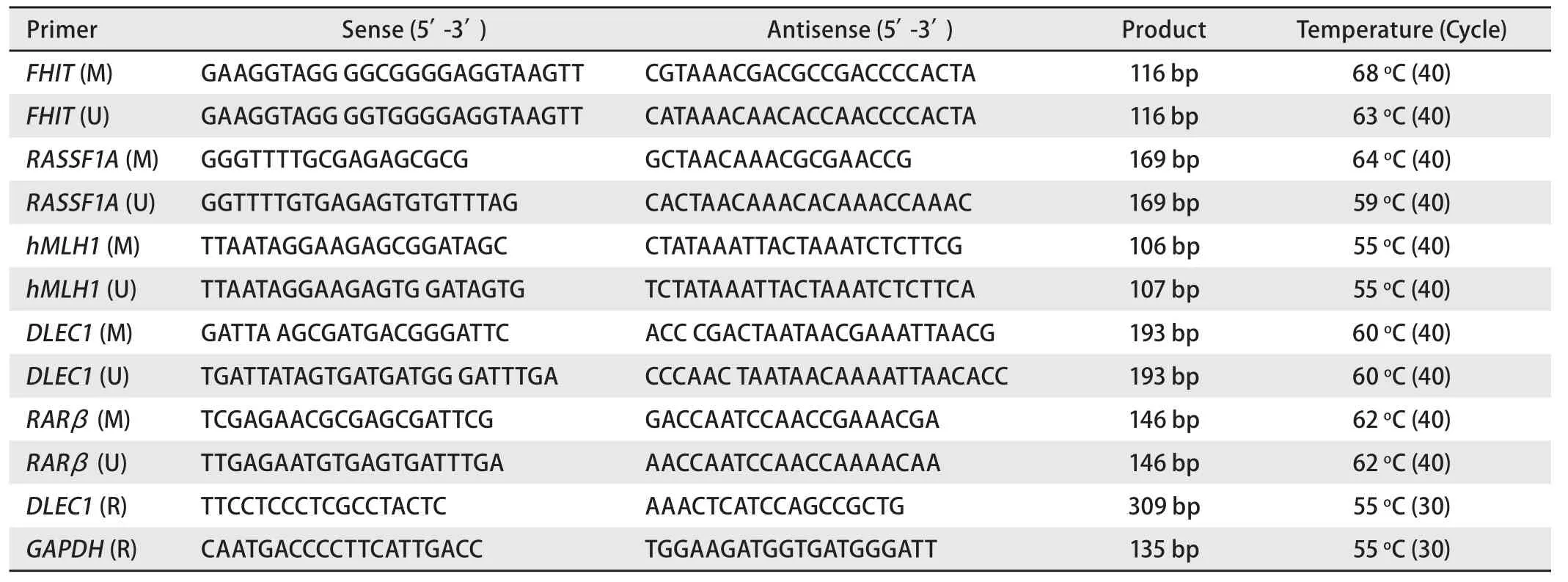
表1 引物序列Tab 1 List of primer sequences
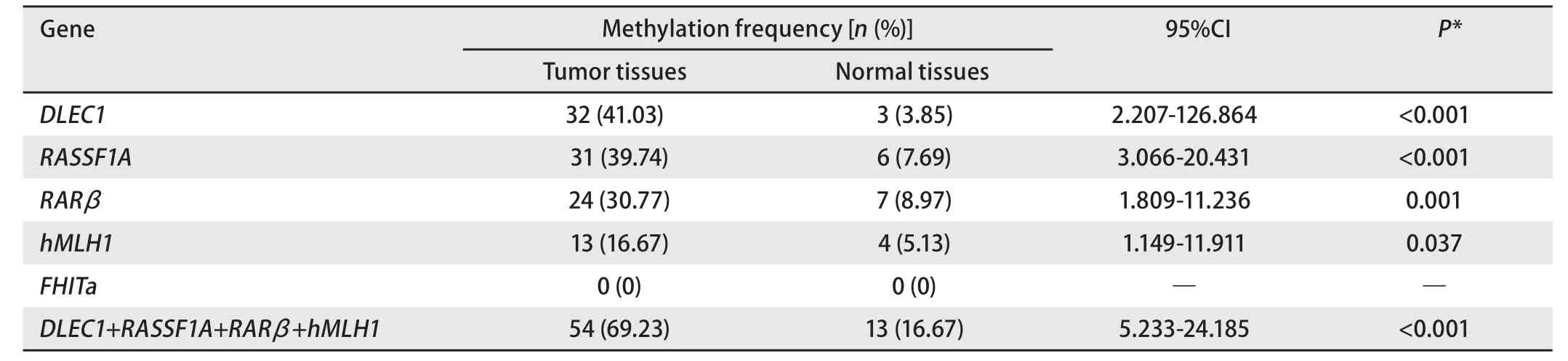
表2 非小细胞肺癌组织和相应正常组织甲基化差异 (n=78)Tab 2 Methylation profiles in NSCLC tissues and matched normal tissues (n=78)
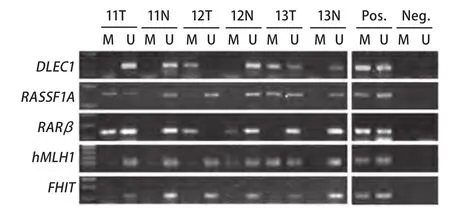
图1 MSP法检测肿瘤组织和正常组织甲基化的结果(病例11-13)。 T:肿瘤组织;N:正常组织;M:甲基化;U:未甲基化;Pos:阳性对照;Neg:阴性对照。Fig 1 Representative MSP profiles in matched NSCLC and adjacent normal lung tissues (cases 11-13). T: tumor tissues; N: normal tissues;M: methylation; U: unmethylation; Pos: positive control; Neg: negtive control.
2.3 DLEC1基因表达状况 新型抑癌基因DLEC1在78例NSCLC组织中的表达通过RT-PCR(图2)和免疫组化(图3)鉴定。与相应正常组织相比,44例(56.41%)肿瘤组织的DLEC1基因在mRNA和蛋白水平均表达下调或缺失;并且,在32例甲基化的肿瘤组织中,28例表现出DLEC1下调或缺失,表明DLEC1基因失活与启动子高甲基化密切相关(表4,P<0.001)。
3 讨论
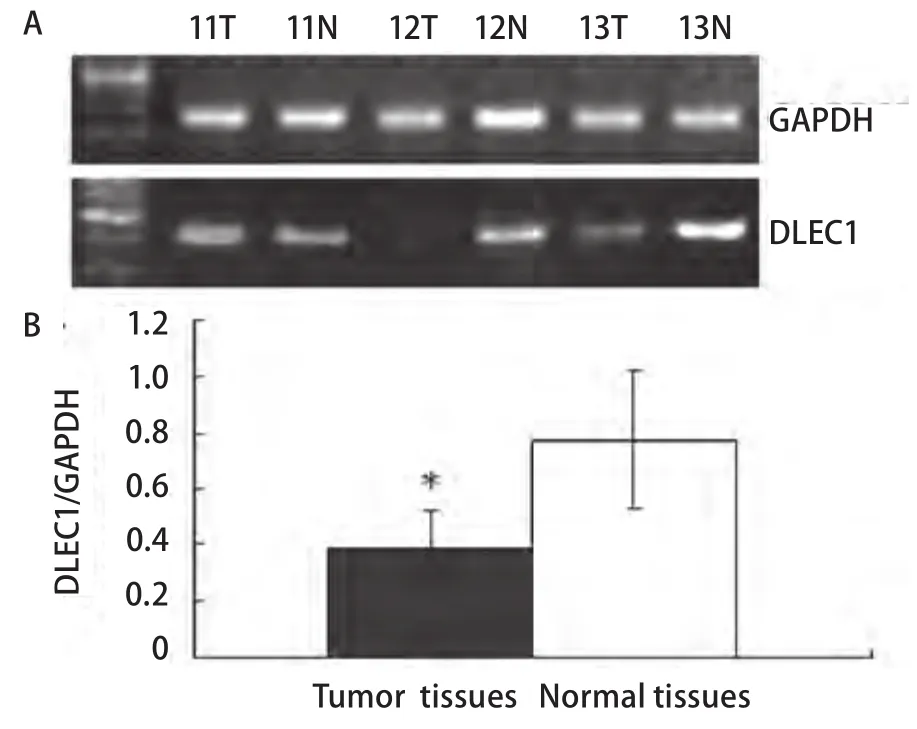
图2 DLEC1在非小细胞肺癌中的mRNA表达。A:典型PCR电泳结果(病例11-13);B:肿瘤组织中DLEC1平均吸光度比值低于相应正常组织。*P<0.001。Fig 2 mRNA expression levels of DLEC1 in NSCLC tissues determined by RT-PCR.A: Typical gel electrophoresis results in three matched pairs (cases 11-13) of tumor(T) and their adjacent normal lung tissues (N); B: Histogram of the relative mRNA expression level of DLEC1 in NSCLC and their adjacent normal tissues. *P<0.001.
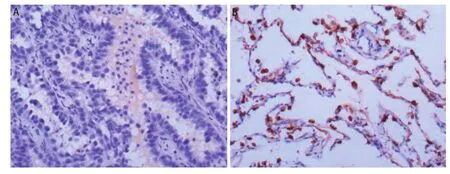
图3 DLEC1在非小细胞肺癌中的蛋白表达(病例12,EnVision法,×200)。A:腺癌组织呈阴性表达;B:正常肺组织阳性表达。Fig 3 Protein expression levels of DLEC1 in NSCLC determined by immunohistochemical staining (case 12, EnVision, ×100). DLEC1 protein was silenced in adenocarcinoma tissues (A), while widely expressed in adjacent normal lung tissues (B).
NSCLC的发生是多步骤的过程,涉及癌基因的激活和抑癌基因的失活。除了基因水平上的突变、缺失等,表观遗传学的改变,特别是DNA的5'CpG岛区域异常甲基化是导致抑癌基因失活的主要原因之一。由于表观遗传学的改变常发生于遗传学改变之前,因此在NSCLC发生的早期就可能检测到抑癌基因异常甲基化[4],这对于肿瘤的早期诊断具有重要意义。
3号染色体短臂(3p)被认为是多个抑癌基因“停泊”的港口,本研究在78例NSCLC组织中检测5个典型的3p区抑癌基因甲基化情况,包括位于3p21.3-22的DLEC1,3p21.3的RASSF1A、hMLH1,3p24的RARβ和3p14.2的FHIT。结果发现,DLEC1、RASSF1A、RARβ和hMLH1在癌组织的甲基化频率依次为41.03%、39.74%、30.77%和16.67%,均显著高于相应正常组织。并且,69.23%的肿瘤组织至少发生这四者之中一个位点的甲基化,而正常组织仅为16.67%。其中,DLEC1是新近在肺癌、食管癌和肾癌中鉴定的候选抑癌基因,转染DCEC1基因到肿瘤细胞株中明显抑制细胞克隆形成及体内致瘤性[5,6],但其抑癌作用的机制尚不明确;RASSF1A是Ras激活信号传导通路的负向调节因子,可阻断Ras生长效应信号由胞外传向胞内[7];RARβ是维甲酸(retinoic acid, RA)受体,参与抑制维甲酸介导的细胞增殖和分化[8];hMLH1属于错配修复基因,对维护基因组的稳定性起着重要的作用[9]。它们在NSCLC中的异常甲基化均有报道,本实验进一步证实其在中国人群中的普遍性,可能是NSCLC发病的重要机制。
值得注意的是,FHIT基因参与DNA修复及细胞凋亡抑制,在NSCLC中的表达下调及启动子高甲基化亦有诸多报道[8,10],但在本实验检测的40例样本中,FHIT在癌组织和正常组织均无异常甲基化。这可能与样本异质性有关,除甲基化之外,尚有其它因素如微卫星不稳定(microsatellite instability, MSI)和杂合性缺失(loss of heterozygosity, LOH)等导致FHIT基因失活[11]。
进一步的分析表明,DLEC1基因甲基化与NSCLC临床分期和淋巴结转移相关,提示DLEC1启动子甲基化还参与肿瘤演进,可能作为潜在的预后指标。但RASSF1A、RARβ、hMLH1基因甲基化以及包括DLEC1在内的四者平均MI与NSCLC临床病理特征无关联,表明3p区抑癌基因甲基化是一个相对独立的危险因素,在总体水平上仍是NSCLC发生中的早期事件,可作为NSCLC早期诊断的潜在标记物。
新型抑癌基因DLEC1包含37个外显子,长约59 kb,编码一个含有1,755个氨基酸的蛋白,这个蛋白与已知的所有蛋白都没有相近的同源序列[5],其在人类正常组织中广泛表达,而在大多数肿瘤组织和细胞系中表达下调。目前的研究[6,12-15]表明启动子高甲基化可能是导致DLEC1基因失活的重要原因,如DLEC1在大部分肝癌细胞系和70.6%(48/68)的原发肝癌中表现出高甲基化,而在临近正常肝组织中仅为10.3%(7/68),去甲基化药物5-Aza-dC处理可使肝癌细胞系恢复DLEC1表达[6];鼻咽癌中,71%(30/42)的原发肿瘤检出DLEC1高甲基化,且所有DLEC1表达沉默的肿瘤细胞系均为高甲基化,而DLEC1充分表达的鼻咽部上皮细胞均为未甲基化[13]。在肺癌组织中,Seng等[16]也发现,38.9%(93/239)的
NSCLC中存在DLEC1高甲基化,并与患者临床分期、淋巴结转移和不良预后有关。本研究进一步证实,56.41%(44/78)的NSCLC组织中,DLEC1基因在mRNA和蛋白水平均表达下调或缺失,并且,DLEC1基因失活与启动子高甲基化密切相关,有助于进一步揭示其在NSCLC发生发展中的作用。
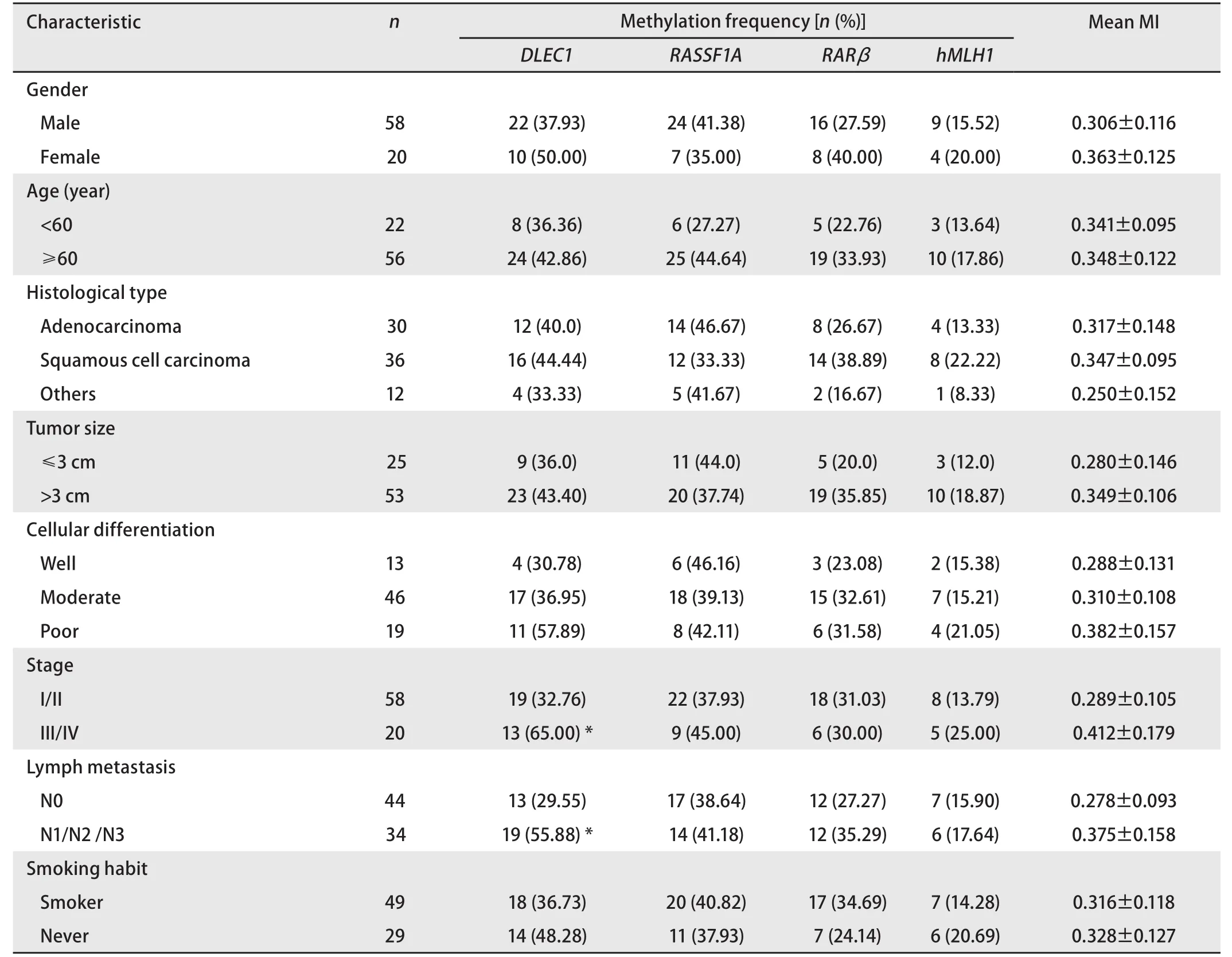
表3 3p区抑癌基因甲基化与非小细胞肺癌患者临床病理特征的关系Tab 3 Association between the DNA methylation in NSCLC specimens and clinicopathological features
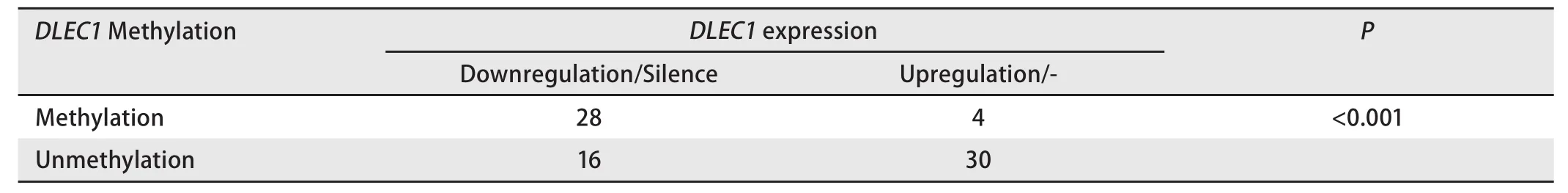
表4 DLEC1基因在非小细胞肺癌中的表达与启动子甲基化的关系Tab 4 DLEC1 downregulation in NSCLC tissues was associated with promoter methylation
总之,本研究证实3p区抑癌基因甲基化是NSCLC发生中的重要分子事件,新型抑癌基因DLEC1基因失活与启动子高甲基化有关。

