HIF-1α、COX-2和E-cadherin在肺腺癌的表达及临床意义
谷松涛 秦建文
实体肿瘤缺氧是一种普遍现象,肿瘤为适应低氧而发生一系列生物学改变,广泛存在于大多数实体肿瘤中的低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)是这一系列改变的关键调控因子。肿瘤细胞通过高表达HIF-1α对其下游基因进行调控以适应低氧环境,促进肿瘤生长转移。有临床实验[1]证明环氧化酶-2在多种恶性肿瘤中有高表达。近来在胃癌的研究[2]中发现环氧化酶-2(cyclooxygenase-2, COX-2)受HIF-1α的调控,COX-2可能是HIF-1α下游目的基因,是肿瘤适应低氧的促进生存转移的重要途径,但尚缺乏肺腺癌的临床报道。上皮型钙粘附分子(E-cadherin)的缺失与肺腺癌侵袭转移有关,多项研究提示肺腺癌组织E-cadherin表达下降,同时在卵巢癌的研究中[3]发现HIF-1α和E-cadherin表达水平高度相关,而在肺腺癌中E-cadherin的表达是否也同时受HIF-1α的调控目前尚未见明确的报道。本研究联合检测三者在肺腺癌中的表达情况,探讨其与临床病理因素的关系及其可能存在的内在联系。
1 对象和方法
1.1 对象 45例肺腺癌来自天津市胸科医院2006年9月-2007年10月胸外科住院患者手术切除标本。经病理明确证实,且不伴有其它疾病,术前均未行放化疗。男性28例,女性17例,平均年龄62.8岁±6.8岁。临床分期根据1997年第八届国际肺癌大会公布的TNM分类标准,I期20例,II期10例,III期15例。淋巴结转移阳性22例,阴性23例。高分化14例,中分化12例,低分化19例。正常对照组10例正常肺组织来自同期胸科医院非肿瘤患者手术切除的正常肺组织,且经病理证实。
1.2 方法
1.2.1 主要试剂 HIF-1α鼠抗人单克隆抗体sc-53546,购于SANTA CRUZ公司。COX-2兔抗人单克隆抗体ZA-0515、E-cadherin鼠抗人单克隆抗体ZM-0092、二步法免疫组化检测试剂盒(PV-9000)、DAB显色试剂盒、APES防脱片胶工作液均购于北京中杉金桥试剂公司。
1.2.2 主要仪器 石蜡切片机(德国Leica公司)、Olympus光学显微镜、医用微波炉。采用二步法免疫组化检测,步骤按试剂盒说明书操作。
1.3 结果判定 随机选择5个高倍视野,计数1,000个肿瘤细胞,计算阳性细胞百分率,HIF-1α和COX-2阳性细胞百分率≥10%为阳性表达,E-cadherin阳性细胞百分率≤70%为表达下降,>70%为正常表达。HIF-1α蛋白染色阳性细胞标准为胞浆或胞核内可见棕黄色颗粒。COX-2蛋白染色阳性细胞标准为胞浆内出现棕黄色颗粒。E-cadherin蛋白染色阳性细胞标准为胞膜可见棕黄色颗粒。
1.4 统计学方法 采用SPSS 13.0软件包进行统计,免疫组化结果为计数资料采用χ2检验。P<0.05有统计学差异。
2 结果
2.1 HIF-1α的蛋白表达与临床病理资料的关系 10例正常对照组均未见HIF-1α的表达。45例肺腺癌HIF-1α的阳性表达率为60%(27/45)。在肺腺癌组不同性别、年龄之间HIF-1α的表达无统计学差异(χ2=1.28, P>0.05;χ2=0.13, P>0.05)。HIF-1α的蛋白表达与患者是否吸烟无关(χ2=1.5, P>0.05)。淋巴结转移阳性组HIF-1α的阳性表达率(68.2%)与淋巴结转移阴性组(52.2%)相比差异无统计学意义(χ2=1.2, P>0.05)。HIF-1α阳性表达与肺腺癌的分化程度、术后分期无关(χ2=2.92, P>0.05; χ2=3.4,P>0.05)。肿瘤最大直径>2 cm组HIF-1α的阳性表达率(69.7%)明显高于≤2 cm组(33.3%),差异有统计学意义(χ2=4.85, P<0.05)(表1,图1)。
2.2 COX-2的蛋白表达与临床病理资料的关系 10例正常对照组均未见COX-2的表达。45例肺腺癌COX-2的阳性表达率为40%(18/45)。不同性别、年龄组之间COX-2的表达无差异(χ2=0.57, P>0.05; χ2=0.95, P>0.05)。COX-2的蛋白表达与患者是否吸烟无关(χ2=1.5, P>0.05)。COX-2表达在不同分化程度组之间无差异(χ2=0.16, P>0.05)。淋巴结转移阳性组COX-2的阳性表达率(63.7%)与淋巴结转移阴性组(17.3%)相比差异有统计学意义(χ2=10.0,P<0.01)。肿瘤最大直径>2 cm组COX-2的阳性表达率(51.5%)明显高于≤2 cm组(8.3%),差异有统计学意义(χ2=6.84, P<0.01)。COX-2阳性表达率在术后分期I期组为15%明显低于II期和III期组(60%),具有明显的统计学差异(χ2=9.34, P<0.01)。COX-2的表达与HIF-1α的表达有关,HIF-1α阳性表达组COX-2的阳性表达率(51.8%)明显高于HIF-1α表达阴性组(14.3%),差异具有统计学意义(χ2=3.95, P<0.05)(表2、表3,图2)。

图1 HIF-1α蛋白的表达。A:正常支气管粘膜上皮细胞HIF-1α蛋白表达阴性(SP, ×100);B:肺腺癌切片相邻正常支气管粘膜上皮细胞HIF-1α阳性表达(SP, ×100);C, D:HIF-1α在肺腺癌的阳性表达,腺癌细胞胞浆和胞核可见棕黄色颗粒(SP, ×400)。Fig 1 Expression of HIF-1α Protein. A:negative expression in normal bronchial epithelium cells (SP, ×100); B: positive expression in normal bronchial epithelium cells next to the lung adenocarcinoma (SP,×100); C, D: positive expression in the lung adenocarcinoma cells of which there are many brown particles in the cytoplasm and cytoblast (SP, ×400).

表1 HIF-1α的蛋白表达与临床病理资料的关系Tab 1 Correlation between HIF-1α expression and clinicopathological factors in 45 patients with lung adenocarcinoma
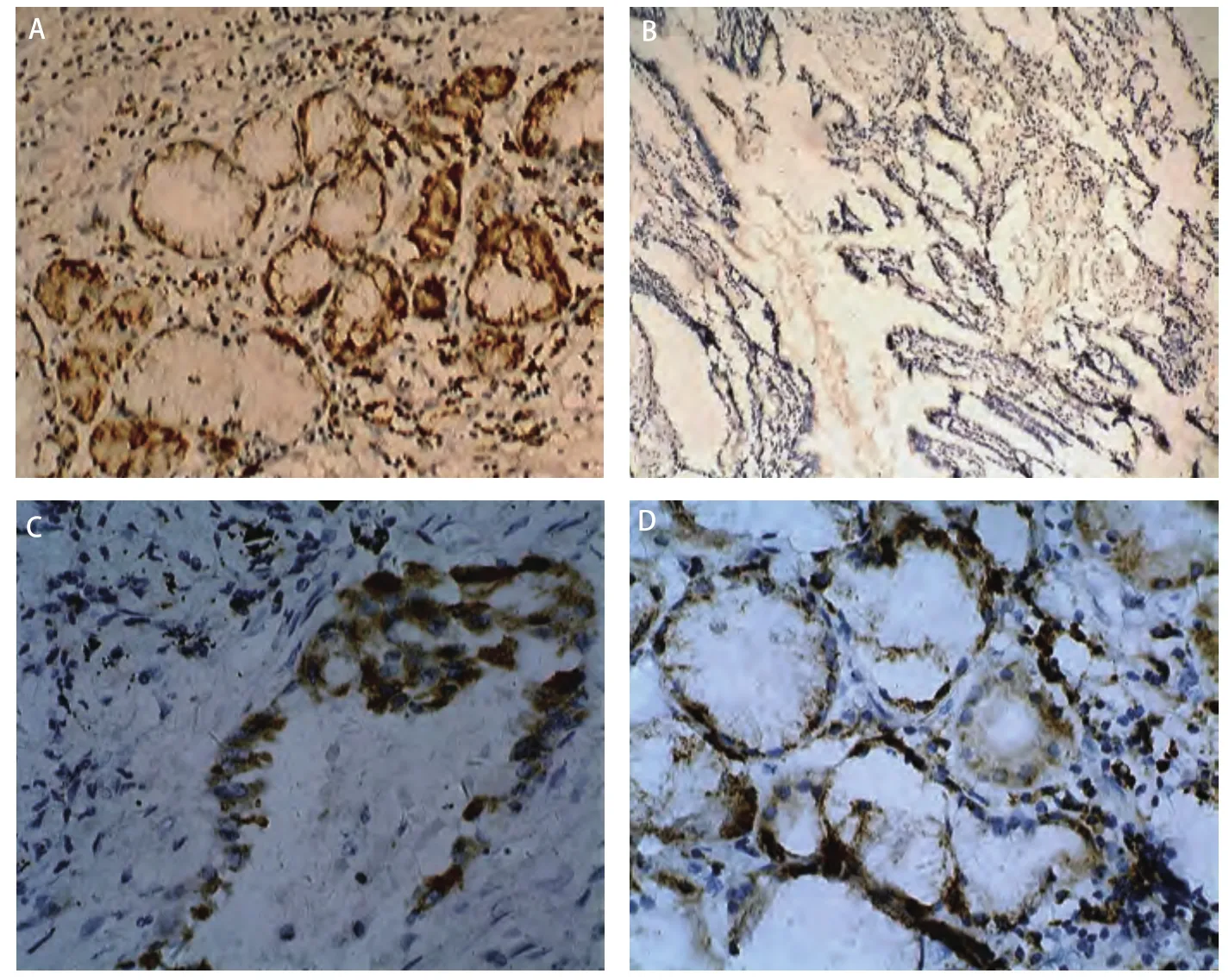
图2 COX-2蛋白的表达。A:COX-2蛋白在肺腺癌的阳性表达,胞浆棕黄色的颗粒(SP,×100);B:COX-2在正常支气管粘膜上皮细胞的阴性表达(SP,×100);C, D:COX-2在肺腺癌阳性表达(SP,×400)。Fig 2 Expression of COX-2 protein. A: positive expression in the lung adenocarcionoma of which there are many brown particles in the cytoplasm (SP, ×100); B: negative expression in normal bronchial epithelium cells (SP, ×100); C, D: positive expression in the lung adenocarcionma (SP, ×400).

表2 COX-2的蛋白表达与临床病理资料的关系Tab 2 Correlation between COX-2 expression and clinicopathological factors in 45 patients with lung adenocarcinoma

图3 E-cadherin蛋白的表达。A:E-cadherin在正常支气管粘膜上皮细胞的正常表达,胞膜可见棕色颗粒沉着(SP,×100); B: E-cadherin在正常支气管粘膜上皮细胞的正常表达(SP,×400);C:E-cadherin蛋白在高分化腺癌的表达(SP,×100);D:E-cadherin蛋白在中分化腺癌的表达(SP,×100);E:E-cadherin蛋白在低分化腺癌的表达(SP,×100);F:E-cadherin蛋白在肺腺癌相邻正常支气管粘膜上皮的表达(SP,×100)。Fig 3 Expression of E-cadherin protein. A:positive expression in normal bronchial epithelium cells of which there are many brown particles in the cell membrance(SP, ×100); B: positive staining in normal bronchial epithelium cells (SP,×400); C: expression in the lung welldifferentiated adenocarcinoma (SP, ×100); D: expression in the lung moderatedifferentiated adenocarcinoma (SP, ×100);E: expression in the lung poor-differentiated adenocarcinoma (SP, ×100); F: expression in normal bronchial epithelium cells next to the lung adenocarcinoma (SP, ×100).
2.3 E-cadherin的蛋白表达与临床病理资料的关系 10例正常对照组均见E-cadherin的阳性表达。45例肺腺癌E-cadherin的阳性表达率为48.9%(22/45)。不同性别、年龄组之间E-cadherin的表达无差异(χ2=1.08, P>0.05;χ2=1.84, P>0.05)。E-cadherin的蛋白表达与患者是否吸烟无关(χ2=2.78, P>0.05)。肿瘤最大直径>2 cm组E-cadherin的阳性表达率(45.4%)与≤2 cm组(60%)相比差异无统计学意义(χ2=2.07, P>0.05)。E-cadherin表达在不同分化程度组之间差异具有统计学意义(χ2=7.15, P<0.05),随着分化程度下降表达率降低(71.4%, 58.3%, 26.3%)。淋巴结转移阳性组E-cadherin的阳性表达率(30.4%)与淋巴结转移阴性组(65.2%)之间的差异有统计学意义(χ2=5.02, P<0.05)。E-cadherin阳性表达率在术后分期I期组为60%,II期组为50%,III期组为33.3%,三者之间差异无统计学意义(χ2=2.45, P>0.05)。E-cadherin的表达与HIF-1α的表达无关(χ2=0.24, P>0.05)(表3、表4,图3)。

表3 HIF-1α表达与COX-2和E-cadherin表达的关系Tab 3 Correlation among HIF-1α, COX-2 and E-cadherin
3 讨论
HIF-1α最早是1992年由Semenza和Wang在低氧的肝细胞癌株Hep3B细胞核提取物中发现的一种核转录因子,其由HIF-1α和HIF-1β两个亚基单位组成,其转录活性主要由HIF-1α的表达水平和稳定性决定[4]。它调控着下游众多基因如血管内皮生长因子、胰岛素样生长因子、内皮素-1,促红细胞生成素等的转录和表达,是低氧诱导基因转录信息传递的最主要途径[5]。低氧是实体瘤发展过程中的普遍现象,而HIF-1α是关键调控因子。HIF-1α蛋白表达受细胞内氧浓度的精确调控。大量的体外实验显示,在5%的氧含量(50 mmHg)时HIF-1α被激活,随着氧浓度减少到0.1%-0.2%,其活性逐渐增加,在无氧时消失。肿瘤细胞通过高表达HIF-1α对其下游基因进行调控以适应低氧环境,促进肿瘤生长转移[6]。一般情况下,HIF-1α在正常组织及良性病变组织中无表达或仅有弱阳性表达,而在一些癌前病变组织、癌组织中过量表达[7]。本研究得到了相似的结论,肺腺癌组HIF-1α的阳性表达率明显高于对照组,同时我们也发现随着肿瘤直径的增大HIF-1α的表达阳性率相应增高,提示细胞缺氧发生在癌前病变之前,持续肿瘤发生的全过程,而HIF-1α异常表达可能是癌变过程的早期行为。
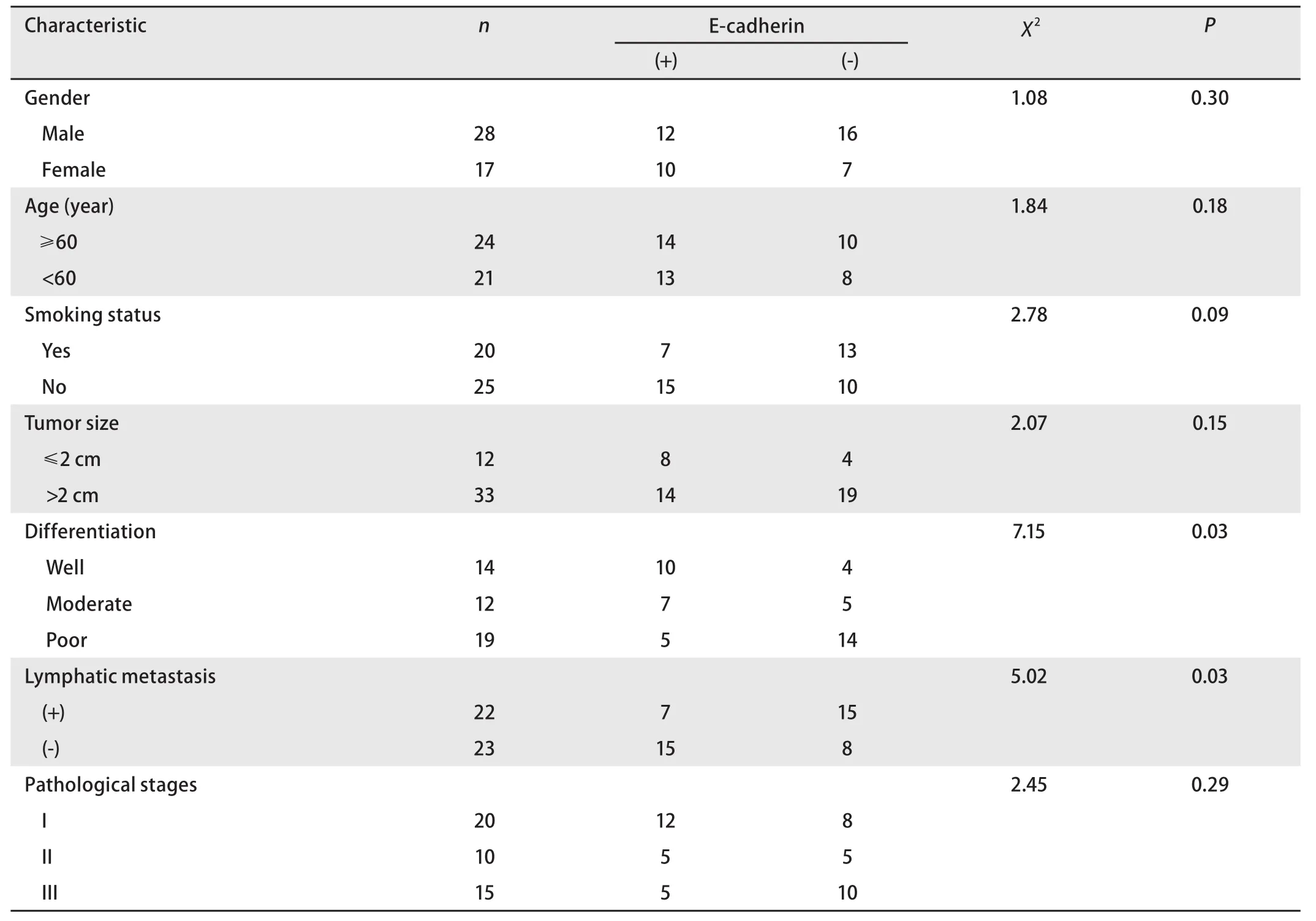
表4 E-cadherin的蛋白表达与临床病理资料的关系Tab 4 Correlation between E-cadherin expression and clinicopathological factors in 45 patients with lung adenocarcinoma
环氧合酶是花生四烯酸合成前列腺素的限速酶,是一种膜结合蛋白,有COX-1和COX-2两种同工酶。COX-1在大多数组织中持续低浓度表达,参与机体生理功能的调节;而COX-2是一种诱导型酶,除部分中枢神经系统及肾脏组织外在正常组织中通常不表达,但在某些病理条件下表达上调。近年来,流行病学、动物实验、临床试验等多方面的证据表明,COX-2与肿瘤的发生和发展有关[8]。COX-2可以通过促进细胞异常增殖、抑制细胞凋亡等机制参与调控肿瘤生长、浸润转移及血管形成等诸多病理过程。本研究显示,与非肿瘤患者的正常肺组织相比,肺腺癌组织中COX-2的表达阳性率明显升高,COX-2阳性表达与患者肿瘤的大小、淋巴结转移情况和临床分期有关,提示COX-2参与了肺腺癌的发生、浸润和转移,是肺腺癌发生的一个早期事件和预后不良的指标,其促进肺腺癌发生和发展的机制可能为:①促进肿瘤细胞增殖;②抑制细胞凋亡;③促进肿瘤淋巴管的形成[9];④刺激血管因子产生,促进血管内皮细胞游走和血管形成[10,11];⑤参与致癌物的代谢[12];⑥增强肿瘤细胞的侵袭力[13]。
E-cadherin是一类介导细胞与细胞间互相粘附的钙依赖性跨膜糖蛋白,它广泛存在于上皮细胞中,通过胞浆连环素与细胞骨架蛋白连接,以维护上皮细胞的形态和结构的完整性[14]。E-cadherin表达异常是导致细胞间粘附下降的重要原因。而肿瘤细胞间的粘附下降是导致肿瘤发生、发展的重要原因之一。体外细胞培养提示当肿瘤细胞E-cadherin表达下调或功能障碍时,可导致肿瘤细胞具有侵袭性生长的特点,并容易脱离原发部位向局部淋巴结或远处转移[15,16]。目前有关E-cadherin与肺腺癌发生、侵袭转移及预后的关系报道极少。本研究显示E-cadherin异常表达与肺癌区域淋巴结转移有关,有区域淋巴结转移的肿瘤组织异常表达率明显高于无转移者,并且发现E-cadherin表达与肺腺癌细胞的分化程度有关,随着分化程度下降表达率降低。以上说明E-cadherin不仅与肺腺癌区域淋巴结转移有关,是判断肺腺癌淋巴结转移的一个重要指标,而且与肺腺癌的恶性程度有关。因此E-cadherin可能是临床判断肺腺癌淋巴结转移、癌细胞分化程度及评估预后的一个较好指标。
有学者[17]在肝癌和非小细胞肺癌的研究中发现,COX-2和HIF-1α表达呈正相关性。Csiki等[18]研究发现在A549等多种肺癌细胞株中,HIF-1α可以通过直接结合COX-2启动子上的HRE反应元件上调COX-2的表达,推测两者在癌细胞的发生、发展过程中具有协同作用。本研究得出了相似的结果,HIF-1α阳性表达组COX-2的阳性表达率明显高于HIF-1α表达阴性组,提示COX-2的表达与HIF-1α的表达有关。由此可见COX-2可能是HIF-1α的下游目的基因,受HIF-1α的调控。众所周知,恶性肿瘤细胞增殖异常迅速,不可避免地造成了低氧的微环境,此时作为急性缺氧的分子标志HIF-1α表达相应增高并同时诱导下游COX-2基因的表达,并可能通过这一下游路径诱导血管生成,改善低氧的微环境,从而促进肿瘤的发生、侵袭与转移。而较早提出HIF-1α与E-cadherin之间的关联是在卵巢癌[3]中:免疫组化提示核染色的HIF-1α与E-cadherin的缺失高度相关,且体外实验提示了其内在关联,但通过本研究,我们未能得到相似的结论,研究结果显示肺腺癌组织中E-cadherin与HIF-1α的表达无统计学意义。分析原因可能与样本含量相对较少有关,这还有待于做进一步更大样本的深入研究分析。
总之,恶性肿瘤的形成和转移是一个多基因、多因子共同作用的结果。通过这个研究提示我们,HIF-1α可能通过调控COX-2的表达,对肿瘤的生长转移起促进作用;虽然未发现E-cadherin和HIF-1α的相关性,尚需更大样本的研究,但有一点可以肯定,HIF-1α、COX-2和E-cadherin均参与了肺腺癌细胞的发生、浸润和转移。联合检测HIF-1α、COX-2和E-cadherin将有助于临床评估病情和判断预后。而且近年来,肺腺癌的靶向治疗已经作为研究的热点,有些靶向治疗药物已在临床上得到了应用并收到了很好的治疗效果。随着研究的深入,HIF-1α、COX-2和E-cadherin相互关系的进一步阐明,多靶点治疗可能会为肺腺癌综合治疗提供一个新的武器,从而有助于抑制肿瘤细胞增殖,减少复发和转移,改善患者的生活质量。

