Survivin shRNA重组慢病毒构建及对A549细胞增殖的影响
武丽红 王金河 王茜 贾懂懂 梁建琴
Survivin又名BIRC5,其是一种凋亡抑制蛋白,是凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族的成员,其通过抑制caspase活化而抑制凋亡或程序性细胞死亡。Survivin蛋白通常在人类胚胎组织和肿瘤细胞中高表达[1],同时其表达受细胞周期的调控,仅在G2/M期高表达[2]。RNAi是在转录水平上控制基因表达的新技术[3]。本研究通过利用shRNA以慢病毒为表达载体沉默Survivin基因,研究其对A549细胞增殖的影响,从而为肺癌的基因治疗提供思路。
1 材料与方法
1.1 材料 慢病毒系列质粒——核心质粒pLL3.7以及包装质粒pVSVG、pRSV-REV、pMDLg/pRRE均为本实验室保存;293T细胞、Hela细胞和人肺癌细胞A549由协和医科大学基础医学细胞中心提供;限制性内切酶HpaI、XhoI、XbaI、NotI和T4连接酶购自New Englang Biolabs;StarFect High-efficiency Transfection Reagent购自GenStar;超滤离心管购自Millopore;总RNA提取试剂盒购自LC Sciences;Titan One Tube RT-PCR kit购自Roche;Survivin antibody、GAPDH、tubulin均购自Santa Cruz;mouse-HRP购自北京中杉金桥生物有限公司;ECL购自GE;流式细胞仪型号为Cytomics FC 500 Beckman Coulter。
1.2 方法
1.2.1 Survivin shRNA重组慢病毒的构建及鉴定 根据homo spacies Survivin mRNA序列利用在线软件设计2个19 bp的靶基因序列,分别为5′GACCACCGCATCTCTACA3′和5′GGCTGGCTTCATCCACTGC3′;Control靶序列为5′GCGAATTTAGGATAATCTC3′。在设计的寡核苷酸序列中,5′端为HpaI酶切位点,3’端为XhoI酶切位点,中间为9个碱基的loop结构:TTCAAGAGA。序列由Invitrogen公司合成。寡核苷酸退火后与经HpaI、XhoI线性化的pLL3.7质粒连接,转化DH5α经氨苄青霉素(Amp)平板筛选。挑取单克隆菌落质粒小提,XbaI、NotI酶切鉴定同时送Invitrogen公司测序。
1.2.2 细胞培养及转染 293T细胞、Hela细胞和人肺癌细胞A549培养在DMEM培养基中(含10%胎牛血清和1%双抗——青霉素与链霉素)。转染293T细胞前24 h接种适量细胞至转染时细胞密度60%为宜(6 cm培养皿)。转染前1 h-4 h更换新鲜培养基,细胞均于37oC含5%CO2的恒温培养箱内培养。取10 μg DNA(pLL3.7:pVSVG:pRSV-REV:pMDLg/pRRE=3:1:1:1)加入PBS至200 μL,轻轻混匀,室温放置;取8 μL StarFect加入PBS至总体积200 μL,轻轻混匀,室温放置5 min;将稀释的StarFect逐滴加入稀释的DNA溶液中,轻轻混匀,室温放置15 min;将上述混合液逐滴加入培养基中,轻轻混匀。置于37oC含5%CO2的恒温培养箱内培养,48 h后收集病毒(转染后6 h换新鲜培养基)。
1.2.3 Survivin shRNA病毒收集及滴度测定 转染6 cm×6 cm培养皿,48 h后收集培养基,0.45 μm滤膜过滤,收集上清加入到超滤离心管中,5,000 rpm离心,过滤至终体积为200 μL,-80oC保存备用。感染病毒12 h-24 h前接种4×105个Hela细胞于6孔板中,并置于37oC含5%CO2的恒温培养箱内培养。分别用DMEM培养基将病毒按1×10-1、1×10-2、1×10-3、1×10-4进行梯度稀释,同时加8 μg/mL的聚凝胺。吸去上清,分别加入不同稀释度的病毒液体,每个浓度重复1次,同时设置不加病毒的阴性对照。48 h后观察GFP的荧光表达率,选取荧光表达率1%-10%的稀释度计算病毒滴度。病毒滴度=接种细胞数×稀释度×荧光细胞百分比。
1.2.4 RT-PCR与Western blot A549细胞感染48 h后按照总RNA提取试剂盒说明书提取RNA,并进行RTPCR。Survivin引物序列:Forward: 5′CCCTGCCTGGCAGCCCTTTC3′,Reverse: 5′CTGGCTCCCAGCCTTCCA3′,扩增长度为188 bp。GAPDH引物序列:Forward: 5′AGAAGGCTGGGGCTCAGGTG3′;Reverse: 5′AGGGGCCATGGACAGTCTTC3′,扩增长度为258 bp。PCR扩增条件为:95oC 1 min,94oC 1 min,57oC 30 s,72oC 30 s,30个循环;72oC 10 min。取PCR产物3 μL进行2%琼脂糖凝胶电泳检测。图像采用Quantity One软件分析灰度值。
A549细胞感染48 h后提取总蛋白,考马斯亮蓝G250法测定蛋白浓度后进行12%SDS-PAGE。72 V转膜2 h,一抗Survivin和tubulin 4oC过夜,洗膜后室温二抗1 h。ECL显影。
1.2.5 MTT与流式细胞术 将A549细胞以每孔1,000-10,000个细胞接种到96孔板,每孔体积200 μL。细胞分为PBS组、实验组与阴性对照组;病毒悬液按照1×10-2稀释度加入。每组设3个平行。第2天时加病毒,置培养箱中培养24 h、48 h、72 h。每孔加Mヰ溶液(5 mg/mL,用PBS配制,pH7.4)20 μL。继续孵育4 h。弃去培养基,每孔加150 μL DMSO,脱色摇床振荡10 min,使结晶物充分溶解。选择490 nm(570 nm)波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。实验重复3次。
收集感染病毒48 h的A549细胞于离心管中,1,000 rpm离心3 min,弃上清液,轻弹细胞沉淀物。用5 mL PBS重悬细胞,离心洗1遍,弃上清液,重复同样操作1次。轻弹细胞沉淀物,约0.2 mL-0.3 mL。固定:用细滴管将以上细胞悬液迅速注入4oC预冷的70%酒精中,轻轻混匀,4oC冰箱保存至少24 h。洗去固定剂:1,000 rpm离心3 min,去上清,轻轻弹起细胞沉淀物,加PBS后将细胞悬液轻轻混匀。1,000 rpm离心3 min。RNA酶消化:去上清,取0.5 mL细胞悬液,加入RNAse A,终浓度为50 μg/mL,37oC孵育30 min。将样品管插入冰浴中,停止RNAse A的消化作用。碘化丙啶(PI)染色:冷却后每个样品加入PI至终浓度为50 μg/mL,在室温中避光染色至少2 h。用300目(孔径约40 flm-50 flm)尼龙网过滤后,即可上机测量。
1.2.6 统计学分析 采用SPSS 11.5统计软件进行分析。3次独立实验的数据采用Mean±SD表示,实验组与对照组的组间差异比较采用t检验分析,P<0.05为有统计学差异。
2 结果
2.1 重组慢病毒质粒鉴定 将质粒用XbaI、NotI酶切。因插入片段的影响,重组质粒与未重组质粒约有50 bp的差异(图1)。测序结果显示质粒构建成功。
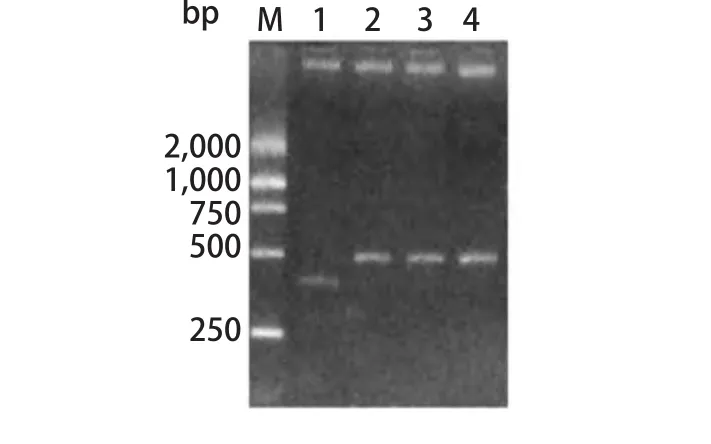
图 1 重组质粒双酶切结果Fig 1 Double enzyme cutting result of recombinant plasmids. M: Marker; 1: pll3.7; 2: pll3.7-Control; 3: pll3.7-Survivin1; 4: pll3.7-Survivin2.
2.2 滴度测定 质粒转染293T细胞,48 h后荧光显微镜下观察到转染效率>90%(图2A)。Hela细胞感染慢病毒后在1×10-1、1×10-2、1×10-3中观察到有绿色荧光,慢病毒的滴度约为108pfu/mL。图2B为1×10-2稀释度感染Hela细胞的效果。

图 2 转染效率及病毒滴度检测结果。A:荧光检测转染的293T细胞(左)和明场观察(右);B:荧光检测感染Hela细胞(左)和明场观察(右)。Fig 2 Results of transfection efficiency and virus titer. A: 293T cell shot by fluorescent light (left) and light (right); B: Hela cell shot by fluorescent light (left) and light (right).
2.3 干扰效果测定 RT-PCR结果显示shRNA组中pLL3.7-Survivin2基因含量明显降低(图3A),说明在慢病毒的介导下,shRNA使A549细胞中Survivin mRNA的表达量明显减少。同样Western blot的结果也证实了Survivin蛋白减少的现象(图3B)。
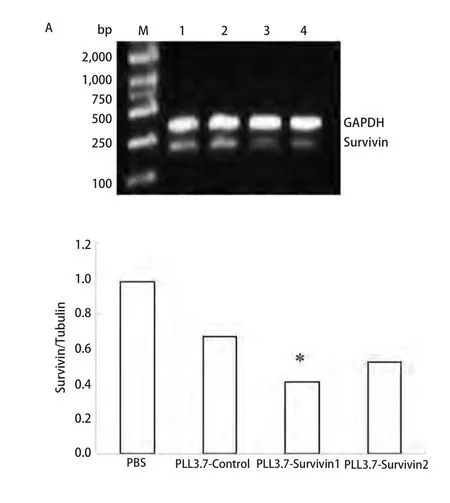

图 3 RT-PCR及Western blot检测结果。A:RT-PCR检测Survivin mRNA的表达,柱状图为相对内参GAPDH的灰度值;与Control组相比,*P<0.05。B:Western blot检测Survivin表达量。与Control相比,*P<0.05。Fig 3 Results of RT-PCR (A) and Western blot (B). A: The result of Survivin mRNA RT-PCR, anlysis of expression compare with GAPDH;*P<0.05, vs Control. B: The result of Survivin expression by Western blot. 1: PBS; 2: pLL3.7-Control; 3: pLL3.7-Survivin1; 4: pLL3.7-Survivin2.
2.4 Survivin shRNA对A549细胞增殖的影响 A549细胞感染慢病毒不同时间之后,MTT法检测细胞增殖。表1显示Survivin shRNA对细胞的增殖均起到了一定程度的抑制,且抑制率具有时间依赖性。流式细胞术结果显示感染pLL3.7-Survivin后处于G2-M期的细胞明显增多,但并没有明显的凋亡峰出现(图4)。

表 1 pLL3.7-Survivin对细胞增殖的抑制作用Tab 1 Inhibitory effect of pLL3.7-Survivin on cell proliferation
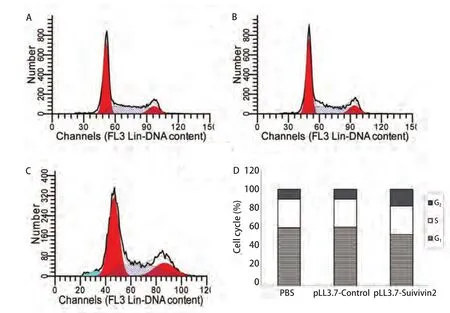
图 4 流式细胞术检测细胞周期。Fig 4 Results of flow cytometry. A:PBS; B: pLL3.7-Control; C: pLL3.7-Suivivin2; D: results of cell cycle.
3 讨论
Survivin大小为16.5 kDa,在体内以二聚体形式存在,是凋亡抑制蛋白家族成员。其主要在细胞周期的G2/M期表达。Survivin与活化的caspase3和caspase7结合,使caspase聚合体分离从而抑制其活性,进而保护了细胞周期调节因子如p21,从而抑制细胞凋亡[4]。Survivin可使p21与Cdk4解离,导致Cdk4活化,细胞进入增殖周期进而大量细胞无限生长,从而有利于肿瘤的发生[5]。Suvivin在细胞分裂中起重要作用,它的表达与细胞的周期变化相协调[6,7]。Survivin在G1期开始表达增加,G2/M期达到峰值。有丝分裂期间Survivin作为染色体乘客复合体的一部分发挥动粒微管的调节作用。Survivin在有丝分裂中期和后期作用于中心体和纺锤体维持稳定性,确保姐妹染色体单体的准确分离。如果从系统中去除Survivin,动粒微管系统不能正确形成,从而细胞停止分裂,最终导致细胞死亡。在细胞分裂期间Survivin也结合到有丝分裂器的微管,通过与周期依赖蛋白激酶1(cyclin-dependent protein kinase 1, CDK1)作用,Survivin的Thr34发生磷酸化,从而稳定蛋白并抑制分裂细胞的凋亡[7,8]。Survivin在正常成年分化组织中不表达或低表达,而在人类恶性肿瘤组织中表达极高[9-11],故针对Survivin的基因治疗具有很好的靶向性、特异性和安全性[12]。
近几年来,慢病毒载体因其独特的优势,逐渐成为表达载体中的热点。慢病毒通常是由HIV去除env、vif、vpr、vpu、nef等毒性基因改造而来。复制缺陷型载体由VSVG代替HIV的包膜进行包装,具有单复制周期、安全、宿主范围广的优点[13]。
本实验通过设计Survivin干扰靶序列,构建重组质粒,并将pLL3.7-Survivin转染293T细胞后利用Hela细胞检测病毒的滴度并感染A549细胞,RT-PCR和Western blot检测干扰效果明显;MTT与流式细胞术分析显示细胞受阻于G2/M期。这为研究RNAi介导的肺癌基因治疗打下了基础。

