CD82/KAI1和HIF-1α在非小细胞肺癌中的表达及其与血管生成拟态的关系
武世伍 承泽农 俞岚 宋文庆 陶仪声
CD82/KAI1基因是一个新的肿瘤转移抑制基因,该基因位于染色体11p11.2,编码产物为细胞膜糖蛋白,属于4次跨膜蛋白超家族(transmembrane 4 superfamily,TM4SF)家族成员,广泛表达于多种组织。其表达与多种肿瘤的演进和预后及胚胎的植入密切相关[1,2]。缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,是应答缺氧应激的关键基因,它的活性对肿瘤细胞凋亡、转移及血管生成等生物学行为起着重要作用。血管生成拟态(vasculogenic mimicry, VM)是Yue[3]发现的一种独特的肿瘤血液供应方式,即是一种由肿瘤细胞变形并形成可输送血液的管道结构,对缓解肿瘤缺氧起重要作用。VM的存在与疾病进展和预后不良相关。本研究通过检测160例非小细胞肺癌(non-small cell lung cancer, NSCLC)病例标本CD82/KAI1、HIF-1α的表达和VM,旨在寻找能预测NSCLC患者局部浸润、淋巴结转移及术后生存率的指标。
1 材料与方法
1.1 一般资料 收集蚌埠医学院第一附属医院病理科2003年1月-2005年4月存档石蜡包埋NSCLC组织标本160例(术前未行放、化疗)和正常肺组织标本20例,所有病例均有完整的临床、病理及随访资料,入选病例随访至患者死亡或截至2010年4月,随访时间为3个月-84个月。其中男性130例,女性30例;从大体类型看,中央型120例,周围型40例;鳞癌116例(高分化17例,中分化71例,低分化28例),腺癌44例(高分化4例,中分化32例,低分化8例)。年龄26岁-82岁,中位年龄59.6岁,≥60岁者86例,<60岁者74例;肿瘤长径D≥3.0 cm者145例,D<3.0 cm者15例;按淋巴结有无转移,有转移76例,无转移84例。根据UICC2002版pTNM病理分期标准进行分期,其中I期患者31例,II期患者43例,III期患者34例,IV期患者52例。对照组正常肺组织20例取自肺癌肿块>5.0 cm的肺组织,病理HE染色证实为正常肺组织。
1.2 试剂 鼠抗人CD82/KAI1单克隆抗体(克隆号:G-2)、鼠抗人HIF-1α单克隆抗体(产品编号:SC-53546)购自Santa Cruz公司;鼠抗人CD34单克隆抗体(产品编号:MAB-0034,克隆号QBEnd/10)、ElivisionTMplus试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发公司。PAS染色液为蚌埠医学院第一附属医院病理科配制。
1.3 实验方法
1.3.1 采用免疫组织化学ElivisionTMplus法 将石蜡标本以4 μm厚连续切片、烤干,于二甲苯溶液及不同浓度的乙醇中脱蜡至水洗。免疫组化染色操作步骤按试剂盒说明书进行。采用已知阳性片作对照,以PBS液代替一抗作空白对照。
1.3.2 CD34和PAS套染 CD34染色,DAB显色后,流水冲洗1 min终止显色反应,PAS染色按照《临床技术操作规范——病理学分册》说明进行。
1.3.3 微血管密度(microvessel density, MVD)计数 CD34主要表达在血管内皮细胞的细胞浆和胞膜,从而可以通过CD34的阳性表达来进行MVD计数,参照修改过的Weidner[4]法来计数。
1.4 结果判定 CD34和CD82/KAI1均以细胞膜和细胞浆出现棕黄色颗粒为阳性;HIF-1α蛋白以细胞核内和胞浆有棕黄色细颗粒为阳性。采取二次计分法:每例标本随机计数5个高倍视野(×400),计数每个高倍视野中阳性细胞所占百分比并计分。首先将染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再将阳性细胞百分比计分,0分为阴性,1分为阳性细胞为<10%,2分为11%-50%,3分为51%-75%,4分为>75%。用染色强度得分和细胞数得分的乘积作为判断表达结果,若积分≤1为阴性,>1为阳性。免疫组化结果由高年资病理医师读片评定。
1.5 统计分析 采用SPSS 17.0统计软件进行数据分析。CD82/KAI1、HIF-1α和VM表达阳性组与阴性组生存分析用Kaplan-Meier法,组间比较用Log-rank检验,多因素分析采用Cox回归多因素模型,在NSCLC组织中,CD82/KAI1、HIF-1α的表达和VM与正常肺组织、各临床及病理因素的相关性采用χ2和Spearman等级相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC中存在VM HE染色光镜下可见由肿瘤细胞围成的管道样结构,无内皮细胞衬覆,管腔内不见坏死的肿瘤细胞及炎症细胞。经CD34与PAS双重染色,管腔呈现CD34阴性但PAS阳性的结构,即VM(图1A,图1B);此外,还能见到网络状的VM。160例NSCLC标本中,36.9%(59/160)可见由CD34阴性的肿瘤细胞围成的管道样或网络状的结构,而PAS阳性,一层PAS阳性物质将肿瘤细胞和管腔分开。正常肺组织中未见有VM现象。
2.2 NSCLC中的VM与临床病理的关系 VM阳性在患者的性别、年龄、组织学类型等之间的差异无统计学意义(P>0.05)。随着NSCLC的分化越差,VM的阳性越强,差异有统计学意义(P<0.01),pTNM分期I期-II期VM阳性率为4.1%(3/74),III期-IV期VM阳性率为65.1%(56/86),VM组的pTNM分期与无VM组的pTNM分期相比差异有统计学意义(P<0.01),且VM组的患者更易发生淋巴结转移(P<0.01)(表1)。
2.3 NSCLC中CD82/KAI1的表达及其与临床病理的关系CD82/KAI1主要定位于NSCLC癌细胞膜,胞浆也有一定表达,呈棕黄色。正常肺组织中CD82/KAI1阳性颗粒主要位于细胞浆和膜(图1F)。在NSCLC中,CD82/KAI1的阳性率为37.5%(图1C,图1D,图1E),较正常肺组织的表达率(19/20)明显减少(P<0.01)。CD82/KAI1的表达与患者性别、年龄及组织学类型无相关性(P>0.05)。随着NSCLC的分化越差,CD82/KAI1的表达越低,差异有统计学意义(P<0.01);CD82/KAI1的阳性表达与淋巴结转移有关(P<0.01);I期-II期肿瘤中CD82/KAI1的阳性率为66.2%(49/74),III期-IV期肿瘤中CD82/KAI1的阳性率为12.8%(11/86),两者之间差异具有统计学意义(P<0.01)(表1)。
2.4 NSCLC中HIF-1α的表达及其与临床病理的关系 HIF-1α主要表达于NSCLC癌细胞核,棕黄色,在胞浆中也有少量表达。对照组未见有HIF-1α表达(图1J),在NSCLC中HIF-1α蛋白阳性表达率为48.8%(图1G,图1H,图1I),其表达与NSCLC的分化程度、淋巴结转移及临床分期有关,即随着HIF-1α表达越高,肿瘤的分化越差、临床分期越晚、更易发生淋巴结转移(表1)。
2.5 NSCLC中CD82/KAI1、HIF-1α的表达和VM情况以及它们的关系 在VM阳性组的病例中,CD82/KAI1阳性率为3.4%(2/59);在CD82/KAI1阳性表达的病例中,VM的阴性率为96.7%(58/60),差异有统计学意义。Spearman相关分析显示, CD82/KAI1在NSCLC中的表达与VM呈负相关(r=-0.539, P<0.01)。从表2可以看出,CD82/KAI1与HIF-1α的表达呈负相关(r=-0.704, P<0.01),HIF-1α的表达与VM 呈正相关(r=0.654, P<0.01)。
2.6 MVD与CD82/KAI1、HIF-1α、VM的关系 Spearman相关分析显示,CD82/KAI1的表达与MVD呈负相关(r=-0.596, P<0.01);VM的阳性与MVD呈正相关(r=0.747, P<0.01);HIF-1α的表达与MVD呈正相关(r=0.716, P<0.01)(表2)。
2.7 多因素分析 将病理组织分化(分为高分化组、中分化组与低分化组),年龄(分为≥60岁组与<60岁组)、pTNM分期(分为I期+II期组与III期+IV期组)、肿瘤直径(分为≥3.0 cm组与<3.0 cm组)、肿瘤位置(分为中央型组与周围型组)、淋巴结转移(分为有转移组与无转移组)、性别(男性组与女性组)、VM(分为阳性组与阴性组)、MVD(因为MVD的均值为22.42±12.8,故以MVD<22为阴性,MVD≥22为阳性);CD82/KAI1(分为表达阳性组与阴性组)和HIF-1α(分为表达阳性组与阴性组)等因素引入Cox模型进行多因素分析,结果显示:CD82/KAI1与HIF-1α的表达和VM及pTNM分期是影响NSCLC患者预后的独立因素(表3)。
2.8 生存分析 本组病例总的5年生存率为26.9%。Kaplan-Meier生存分析显示VM阳性组与阴性组5年生存率分别为1.7%(1/59)和41.6%(42/101),差异有统计学意义(P<0.01,图2A);CD82/KAI1阳性组与阴性组5年生存率分别为68.3%(41/60)和2.0%(2/100),差异有统计学意义(P<0.01,图2B);HIF-1α阳性组与阴性组5年生存率分别为3.8%(3/78)和48.8%(40/82),差异有统计学意义(P<0.01,图2C);MVD≥22和MVD<22的5年生存率分别为2.9%(2/69)和45.1%(41/91),差异有统计学意义(P<0.01,图2D)。
3 讨论
部分高侵袭性肿瘤存在一种不依赖血管内皮细胞,而是由肿瘤细胞通过自身变形和细胞外基质重塑直接围成的管道样结构,并可与宿主静脉相通,以获取血供,即血管生成拟态-VM[5]。VM的提出不仅对传统的血管生成理论提出了挑战,同时也是对肿瘤血管形成理论的重要补充。Folberg等[6]在葡萄膜黑色素瘤中定义了几种形态的VM,即有的呈直的或平行排列的或十字交叉的直线型、有或无分支的弧形、封闭的环形、网络状等结构,这些结构都呈现PAS阳性而CD34阴性。后来在肝癌[7]、卵巢癌[8]、前列腺癌[9]及双分化肿瘤[10]等高度恶性肿瘤中都报道有VM的存在。

图 1 VM、CD82/KAI1和HIF-1α在NSCLC中的阳性染色以及对照组中的染色。A、B:NSCLC中VM阳性染色(黑箭头所示为VM结构,红箭头所示为血管,A和B为低分化鳞癌,ElivisionTM×400);C、D、E:NSCLC中CD82/KAI1表达阳性,主要表达于细胞膜和细胞浆(C为中分化鳞癌,D为低分化鳞癌,E为高分化鳞癌,ElivisionTM×400);F:对照组中CD82/KAI1表达阳性,主要表达于细胞浆和细胞膜(为正常支气管腺,ElivisionTM×400);G、H、I:NSCLC中HIF-1α表达阳性,主要表达于细胞核和细胞浆(G为低分化腺癌,H为中分化鳞癌,I为中分化腺癌,ElivisionTM×400);J:对照组中HIF-1α表达阴性(正常肺组织,ElivisionTM×100)。Fig 1 Positive staining of VM, CD82/KAI1 and HIF-1α in NSCLC and staining in the control group. A,B: positive staining of VM in NSCLC (black arrow is VM, red arrow is vessel, A and B are poor differentiation squamous carcinoma, ElivisionTM×400); C,D, E: positive staining of CD82/KAI1 in membrane and plasma of NSCLC (C is mediate differentiation squamous carcinoma, D is poor differentiation squamous carcinoma, E is well differentiation squamous carcinoma, ElivisionTM×400); F: positive staining of CD82/KAI1 in plasma and membrane of the control group (normal bronchial glands, ElivisionTM×400); G, H, I: positive staining of HIF-1αin nuclei and plasma of NSCLC (G is poor differentiation adenocarcinoma, H is mediate differentiation squamous carcinoma, I is mediate differentiation adenocarcinoma, ElivisionTM×400); J:negative staining of HIF-1α in the control group (J is normal lung tissue, ElivisionTM×100). VM:vasculogenic mimicry;HIF-1α:hypoxia inducible factor-1α;NSCLC:non-small cell lung cancer.
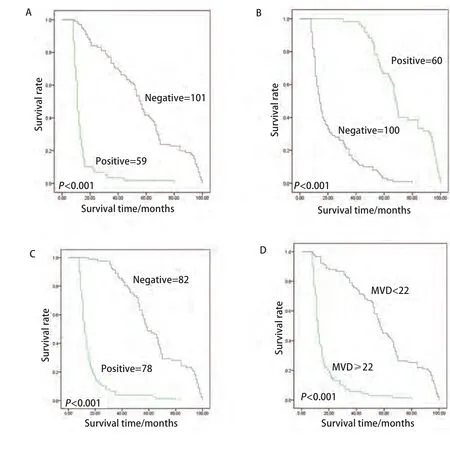
图 2 VM、CD82/KAI1、HIF-1α和MVD阳性组与阴性组NSCLC患者生存曲线。A:VM阳性组与阴性组NSCLC患者生存曲线;B:CD82/KAI1表达阳性组与阴性组NSCLC患者生存曲线;C:HIF-1α表达阳性组与阴性组NSCLC患者生存曲线;D:MVD≥22组与<22组NSCLC患者生存曲线。MVD:microvessel density。Fig 2 Survival curves of NSCLC patients with positive or negative group VM,CD82/KAI1, HIF-1α and MVD. A: survival curves of NSCLC patients with positive or negative VM group; B: survival curves of NSCLC patients with positive or negative CD82/KAI1 expression; C: survival curves of NSCLC patients with positive or negative HIF-1αexpression; D: survival curves of NSCLC patients with MVD≥22 group or<22 group.
本研究在59例NSCLC中发现了符合具有VM标准的结构,证实NSCLC中有VM的存在。VM结构由肿瘤细胞围成,肿瘤细胞与血流之间仅有一层PAS阳性物质相隔,无血管内皮细胞屏障,导致了肿瘤患者具有转移早、转移率高、患者临床预后差,死亡率高等特点。本研究也显示VM与肿瘤分化程度、淋巴结转移与否及临床分期等密切相关。即有VM的肿瘤具有更差的分化、更低的临床分期以及更易发生淋巴结转移。
HIF-1α基因位于14号染色体,编码826个氨基酸。当细胞缺氧时,HIF-1α在细胞核内高表达。HIF-1α可通过调控多种靶基因表达以逃避或适应相对缺氧环境,参与肿瘤生长、浸润和转移[11]。本研究结果显示,HIF-1α表达高的肿瘤,具有分化差、临床分期晚和易发生淋巴结转移等特点。且HIF-1α和MVD的表达及VM相互之间具有正相关性,这说明缺氧可能会参与肿瘤的血管与VM的形成。缺血和缺氧是恶性肿瘤发展过程中的普遍现象,当肿瘤细胞缺氧时,HIF-1α会上调VEGF表达[12],诱导新生血管形成,可以暂时缓解肿瘤细胞的缺血、缺氧状态。当新生血管的血供还不能够满足肿瘤细胞营养需求时,这时某些具有可塑性的肿瘤细胞就会变形,形成具有VM形态的结构以获得足够供氧,所以具有VM结构的肿瘤细胞周围没有坏死。本研究结果与国内外文献[13-16]报道一致。同时文献[15]还报道,抑制HIF-1α的表达可以阻断VM的形成,这说明缺氧很可能是诱导肿瘤细胞形成VM的一个重要始动因素。
CD82/KAI1基因首先发现于前列腺癌细胞,曾被认为是前列腺癌特异性的转移抑制基因,命名为KAI1基因[17],后来对该基因的定位及DNA全长序列测序证明,其与CD82基因完全相同,故又将其命名为CD82/KAI1基因,属于TM4SF家族。在肿瘤中CD82/KAI1基因的异常形式表现为基因突变、等位基因缺失和表达水平的改变等,其中表达水平与肿瘤侵袭、转移关系密切。本研究发现CD82/KAI1蛋白在肿瘤组织中的表达水平比在正常组织中明显降低,差异具有统计学意义;并且随着肿瘤分化越低、临床分期越晚,其表达水平也越低,差异有统计学意义;在伴有淋巴结转移的肿瘤中其表达水平也较没有淋巴结转移的肿瘤明显降低,与文献[18,19]报道一致。提示CD82/KAI1基因表达异常与NSCLC的发生、发展及侵袭、转移密切相关。CD82/KAI1表达异常使CD82/KAI1正常功能减弱或丧失,从而失去抑制肿瘤转移的功能。
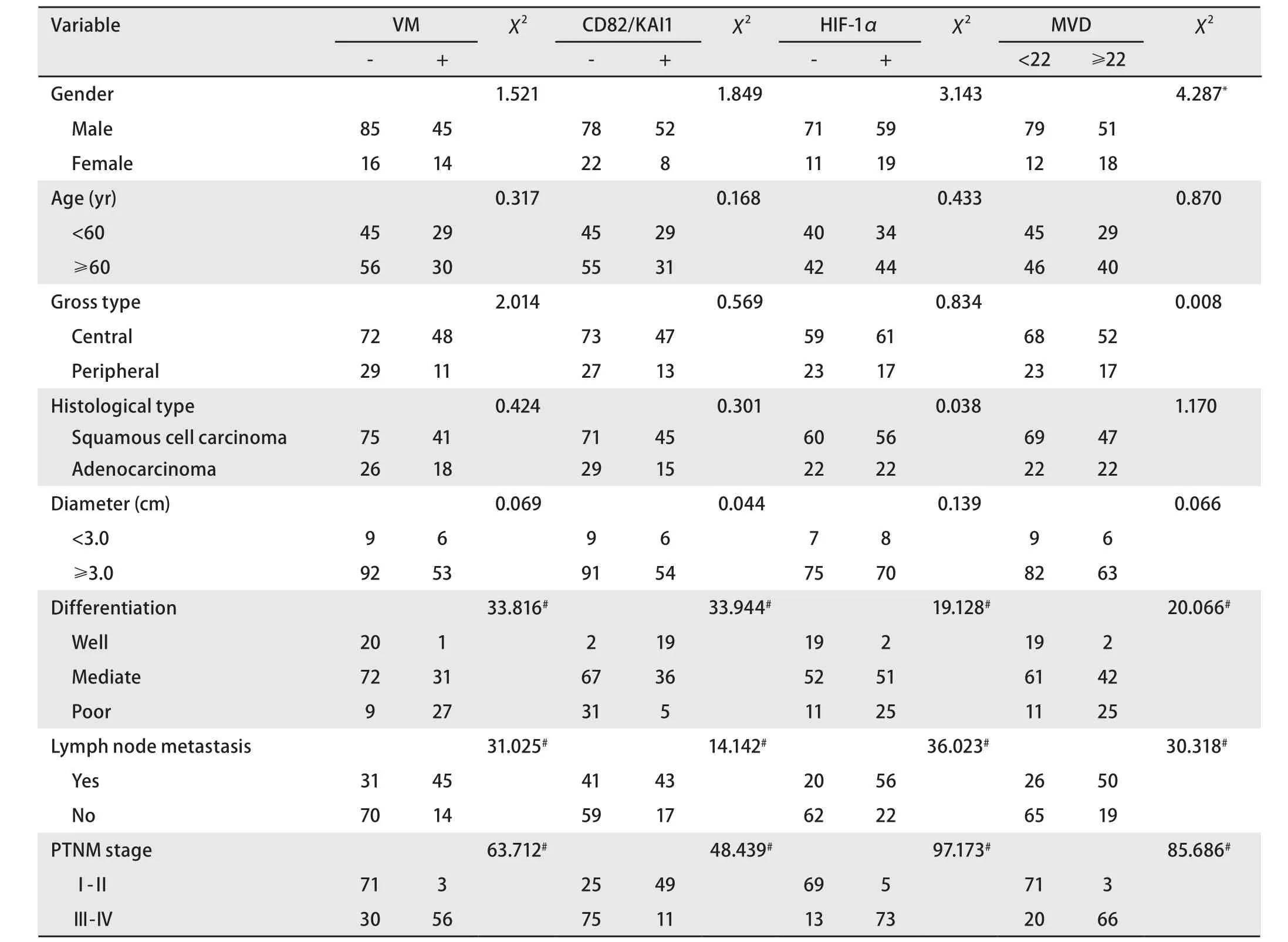
表 1 NSCLC中VM、CD82/KAI1、HIF-1α和MVD的表达与临床病理因素的关系Tab 1 Correlation of VM and CD82/KAI1 and HIF-1αand MVD expression to clinicopathologic characteristics in NSCLC
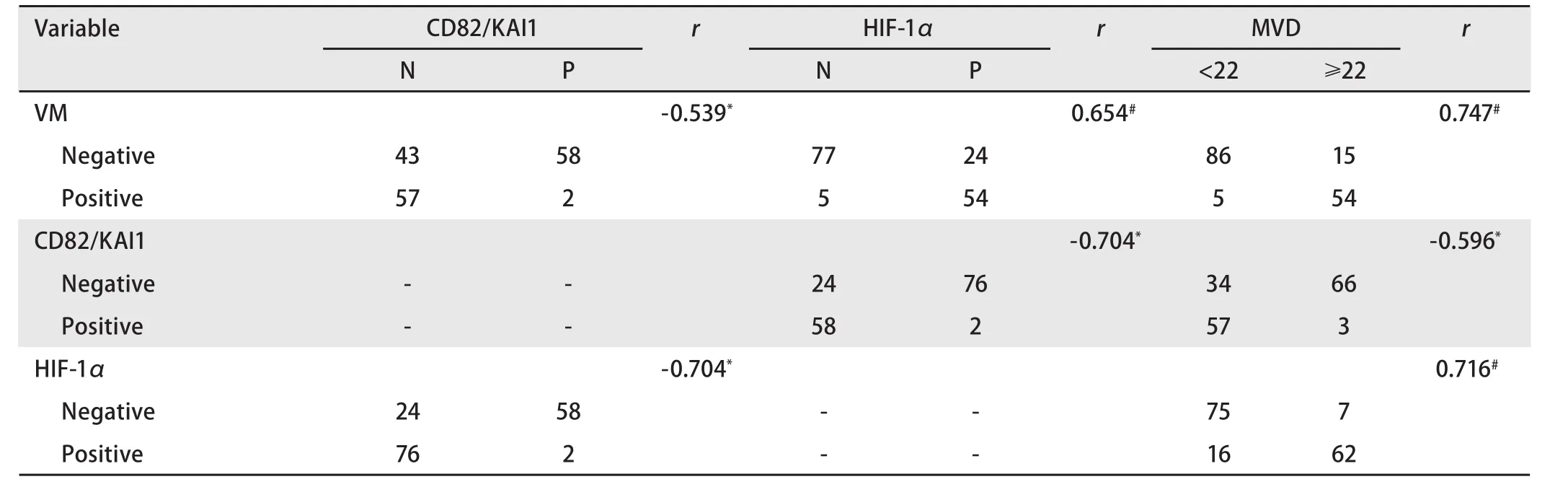
表 2 NSCLC中VM、CD82/KAI1、HIF-1α和MVD各因素之间的相互关系Tab 2 The expression of VM and CD82/KAI1 and HIF-1α and MVD, and their relationship in NSCLC

表 3 160例NSCLC患者多因素分析Tab 3 Multivariate survival analysis of 160 patients with NSCLC
本研究多因素分析显示HIF-1α和CD82/KAI1的表达情况、VM和pTNM分期是影响NSCLC的独立预后因素,而MVD并非NSCLC的独立预后因素。pTNM分期作为术后治疗的标准已为人们所重视,因此寻找新的可以反映肿瘤细胞生物学行为并对pTNM分期起到一定补充作用的分子标记物显得更为重要。进一步的生存分析显示VM、HIF-1α和MVD阳性组的5年生存率明显低于阴性组,提示VM、HIF-1α和MVD阳性组的NSCLC患者的生存时间比较短,比其阴性组预后差,这与文献[21,22]报道一致。CD82/KAI1阳性组与阴性组的5年生存率分别为66.7%和3.0%,差异有统计学意义,即CD82/KAI1阳性表达组的生存时间高于阴性表达组,这与其他学者研究结果相同[19-20]。
本研究中,VM和HIF-1α在对照组20例正常肺组织中均不存在,而在NSCLC中表达于部分肺癌细胞,差异明显;并且随着肿瘤的进展,VM、HIF-1α和MVD的阳性率增多。对CD82/KAI1蛋白与VM、HIF-1α、MVD的表达进行相关性分析,发现癌组织中随着CD82/KAI1表达率的降低,VM、HIF-1α和MVD的阳性率明显增多,呈负相关。提示CD82/KAI1蛋白的表达与VM、HIF-1α、MVD的阳性率可能存在一定联系。随着肿瘤的快速进展,肿瘤组织会发生缺血缺氧,缺氧会诱导新生血管及VM形成;而此时CD82/KAI1表达降低导致癌细胞间的粘附力减弱,移动性增强、细胞分化低[20];而具有VM结构的肿瘤细胞与管腔仅间隔一层PAS阳性物质,此时粘附力降低的肿瘤细胞在血流的冲击下,很容易脱离原发灶而发生淋巴结转移甚至远处转移[20]。
综上所述,CD82/KAI1基因表达降低可能是NSCLC发生侵袭、转移的分子基础,血管生成和血管生成拟态可能是NSCLC发生侵袭、转移的关键事件。因此,CD82/KAI1、VM、HIF-1α和MVD可作为评估NSCLC转移和预后的指标。

