α-干扰素联合脂多糖对白血病细胞株U937细胞周期的影响及其机制研究
王晓桃,林文远,陈蓓莉,刘健,唐爱林,莫东华
α-干扰素 (interferon-α,IFN-α)能够抑制肿瘤细胞的生长,增加自然杀伤 (NK)细胞及其他免疫活性细胞的功能,具有广谱的抗肿瘤活性,目前已被广泛应用于血液系统肿瘤的治疗。Toll样受体 (Toll-like receptors,TLRs)是一类介导天然免疫反应并桥接或触发适应性免疫的模式识别受体(pattern recognition receptor,PRR),TLRs可分布于各种肿瘤细胞,如结肠癌、乳腺癌、前列腺癌细胞[1]。如TLR1-9在U937细胞表达,且TLR8激动剂ssRNA40/LyoVec能明显抑制U937细胞的生长[2]。人类TLR8天然或合成的配体能逆转急性髓系白血病 (acute myelogenous leukemia,AML)患者Treg细胞的免疫抑制作用,进而增强抗瘤免疫功能[3]。这些研究提示TLR8配体可能在AML患者的免疫治疗中具有重要作用。而作为TLRs主要外源性配体的内毒素脂多糖 (lipopolysaccharide,LPS),需与其受体TLR4结合后通过信号转导的级联反应方能产生效应。因此,IFN-α+LPS能否协同阻滞白血病细胞的增殖及其机制需要进一步研究。本研究旨在探讨LPS在体外能否增强IFN-α抑制U937细胞增殖、促进细胞凋亡、阻滞细胞周期的作用及可能机制。为IFN-α协同TLR激动剂或TLR配体佐剂免疫治疗白血病提供理论依据。
1 材料与方法
1.1 细胞 人AML细胞株U937(上海细胞所)自外室购进后复苏后使用。
1.2 主要试剂与仪器 24孔、96孔培养板 (美国Corning公司);RPMI-Medium1640干粉、胎牛血清 (FBS)(天津血液病研究所);四甲基偶氮唑蓝 (MTT)、二甲亚砜 (DMSO)溶液 (北京SABC公司产品);AnnexinV/碘化丙锭 (PI)试剂盒 (德国 Bender公司);Trizol试剂 (Invitroge公司产品);Western blotting化学发光试剂盒 (美国SantaCruz公司),βactin Maker(Fermantas公司),β-actin小鼠抗人单抗,CyclinA2、CyclinD1兔抗人单抗 (SantaCruz公司);山羊抗小鼠IgG、山羊抗兔IgG、兔抗山羊IgG(美国SantaCruz公司)。荧光抗体 (美国SantaCruz公司)。自动酶标读数仪 (国产DG-3022);Fluor ChemTM8900凝胶成像系统 (美国Alpha Innotech公司);流式细胞仪 (美国BD公司)。
1.3 细胞传代培养 AML细胞株U937从外室引进后,常规离心弃上清,复苏后的细胞在含体积分数10%的加热灭活的胎牛血清 (10%FBS) 及100 Μ/ml青霉素、100 μg/ml链霉素的RPMI1640的培养基中,置于37℃、饱和湿度、体积分数为5%的CO2孵箱中培养,每3 d更换培养基并传代一次。本实验用的细胞均处于对数生长期。
1.4 MTT法检测各组白血病细胞的增殖实验 根据处理细胞的药物不同将实验组分为单用100 ng/ml IFN-α组、单用100 ng/ml LPS组,按上述剂量1∶1组成IFN-α+LPS组共3组;对照组则为不加任何药物处理细胞即空白对照组。按实验组的药物剂量处理U937细胞株,混匀后取0.1 ml加入96孔平底培养板中,使细胞浓度为5×105/ml,每组重复8孔,对照组加入等体积培养液,每孔最终体积为200 μl。给药后置37℃含5%CO2的培养箱中培养,每3 d更换1次培养液。在终止培养前4 h每孔加入20 μl浓度为5 mg/ml的MTT,继续培养4 h后,2 000 r/min离心10 min,弃上清液,加150 μl/孔DMSO终止培养,使结晶溶解。置酶联免疫检测仪下测吸光度值(A),计算其细胞生长抑制率〔细胞生长抑制率 (%) =(l-A处理组/A对照组) ×100%〕,如为对照组,则以第一孔为参照值,其余孔与其对照即可。
1.5 Annexin V FITC/PI双染色法流式细胞仪检测细胞凋亡率实验分组同1.4。将人AML细胞株U937 0.1 ml置于10%FBS培养基中培养过夜,调节细胞密度至5×106/ml,按实验分组再在含10%FBS的RPMI1640培养基中共同培育24 h后,收集细胞约5×105个,用Binding Buffer洗1次,100 μl Binding Bμffer重悬,加5 μl Annexin V -FITC,避光孵育20 min,再加10 μl PI(PI浓度为1mg/ml)避光室温下孵育15 min,Binding Buffer洗涤、重悬,立即用流式细胞仪检测,每个样品至少检测1×105个细胞。利用Cell Quest功能软件进行参数获取和数据分析。每组样品重复3次。
1.6 流式细胞仪检测细胞周期 实验分组同1.4。将人AML细胞株U937在无血清培养液培养24 h,使细胞生长周期同步化,调节细胞密度至1×106/ml,按实验分组再在含10%FBS的RPMI1640培养基中共同培育48 h后,600~800 r/min离心收集细胞,用PBS洗涤2次,DNA-Prepstain染液染色,用流式细胞仪检测,每份样品约5 000个细胞,用DNA Multi Cycle软件进行统计学拟合分析各组细胞周期时相。每组样品重复3次,取均数。
1.7 Western blotting检测CyclinA2和CyclinD1蛋白质表达实验分组同1.4。将对数生长期的U937细胞,调节细胞浓度至5×105~1×106个/ml。按实验分组再在含10%FBS的RPMI1640培养基中共同培育24 h后,每组分别收集1×107个细胞,1 200 r/min,4℃离心5 min,用冰冷的PBS洗涤3次,再按1 200 r/min,4℃,离心5 min,弃上清液,加入100 μl的细胞裂解液和 1 μl DTT(1 mol/L),10 μl PMSF(17.4 ng/ml)裂解细胞,加热变性后置于4℃保存。取25 ml蛋白样品进行SDS-PAGE电泳,将凝胶中的蛋白转移到硝酸纤维素膜上,用封闭液 (质量浓度0.05脱脂奶粉,体积分数 0.001 Tween 20,Tris硼酸缓冲液溶解,pH 7.6)封闭2 h,转移至含约10 ml 7%牛奶,1/2 000一抗的培养皿中孵育4 h,置入含10 ml 7%牛奶,1/3 000二抗的TBST液,室温反应1 h,洗膜3次,ECL化学发光,X线片曝光显影。(用β-actin作为内参照蛋白)。将各条带进行灰度扫描并与β-actin条带校正后计算各处理组平均值。
1.8 统计学方法 采用SPSS 15.0统计软件进行数据分析,计量资料以 (±s)表示,多均数比较用单因素方差分析,两均数比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IFN-α+LPS对白血病细胞株U937细胞增殖的抑制作用和凋亡作用 不同药物与白血病细胞株U937作用48 h后,抑制率及凋亡率各组间比较差异均有统计学意义 (F值分别为42.11和56.43,P<0.05)。IFN-α组、LPS组及IFN-α+LPS组的抑制率和凋亡率均较对照组明显增高,差异有统计学意义 (P<0.05);IFN-α+LPS组与IFN-α、LPS组比较,差异均有统计学意义 (P<0.05),而IFN-α组与LPS组比较差异无统计学意义 (P>0.05,见表1)。
2.2 IFN-α+LPS对U937细胞周期的影响 IFN-α组、LPS组及IFN-α+LPS组的U937 G1期比例增加、S期和G2期比例减少,而对照组中S期比例偏高、G1期和G2期比例偏少,组间差异有统计学意义 (F=31.62,P<0.05,见图2)。IFN-α组、LPS组及IFN-α+LPS组的G1期细胞较对照组明显增高 (P<0.05);IFN-α+LPS组G1期细胞明显高于IFN-α、LPS两组,差异均有统计学意义 (P值分别为0.02和0.05)。
2.3 IFN-α+LPS对CyclinA2、CyclinD1蛋白质的影响 用western blotting方法检测3组中U9370细胞株 CyclinA2、CyclinD1蛋白质水平的变化情况,结果如图3所示。独立进行3次重复实验,将各条带进行灰度扫描并经β-actin条带校正后计算各组的平均值,然后用SPSS 15.0软件进行统计学分析。结果表明,IFN-α+LPS组CyclinA2蛋白表达量显著下调,CyclinD1蛋白表达量显著上调,组间差异有统计学意义 (F值分别为56.18和38.42,P<0.05),IFN-α组、LPS组及IFN-α+LPS组与对照组比较差异均有统计学意义 (P<0.05),IFN-α+LPS组与IFN-α组、LPS组比较差异有统计学意义(P<0.05,见表3)。
表1 α-干扰素和 (或)脂多糖与U937细胞作用48 h后的抑制率和凋亡率 ( ± s,%)Table 1 The rate of cells inhabtion and apoptosis after IFN-α and/or LPS affection U937 cell lines

表1 α-干扰素和 (或)脂多糖与U937细胞作用48 h后的抑制率和凋亡率 ( ± s,%)Table 1 The rate of cells inhabtion and apoptosis after IFN-α and/or LPS affection U937 cell lines
0.07±0.03 0.08±0.04 IFN-α组 0.37±0.05 0.31±0.04 LPS组 0.30±0.07 0.25±0.05 IFN-α+LPS组组别 抑制率 凋亡率对照组0.69±0.04 0.51±0.13
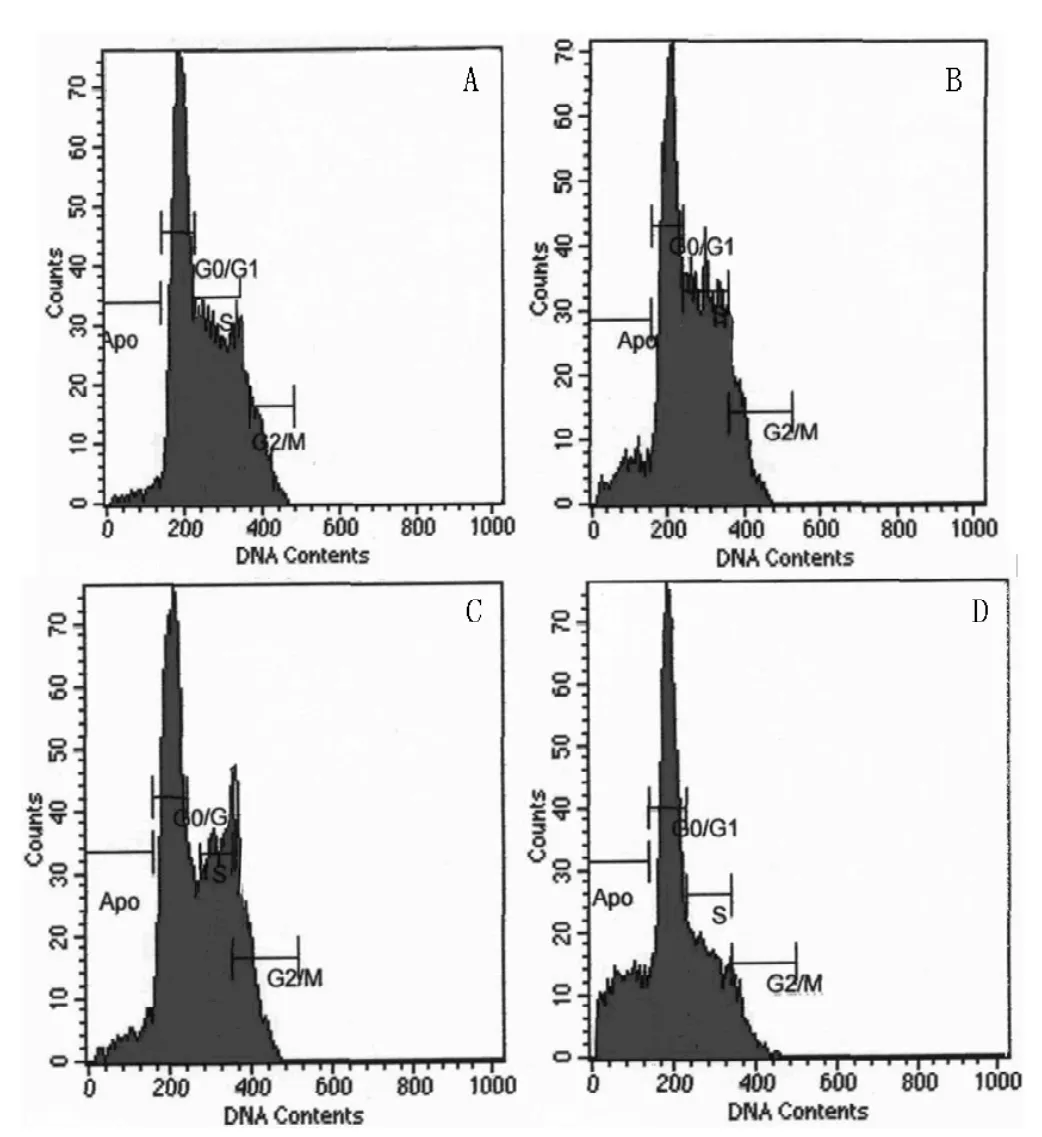
图2 流式细胞仪检测U937细胞周期的改变Figure 2 The change of cell cycle phase induced by IFN-α and/or LPS in cell lines U937
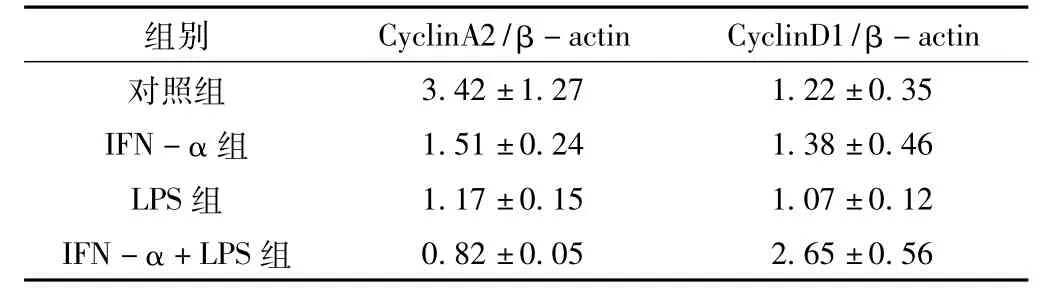
表3 α-干扰素和/或脂多糖对U937对CyclinA2、CyclinD1蛋白质表达的影响Table 3 The expressing of CyclinA2 and CyclinD1 induced by IFN - αand/or LPS in cell lines U937
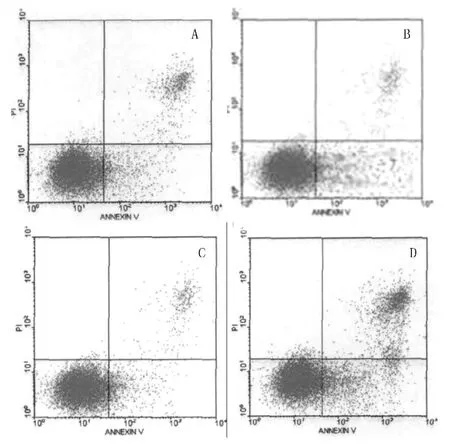
图1 Annexin V FITC/PI双染色法流式细胞仪检测U937细胞凋亡的结果Figure 1 Cell apoptosis of U937 lines analyzed by FCM with AnnexinⅤ/PI double labeling method
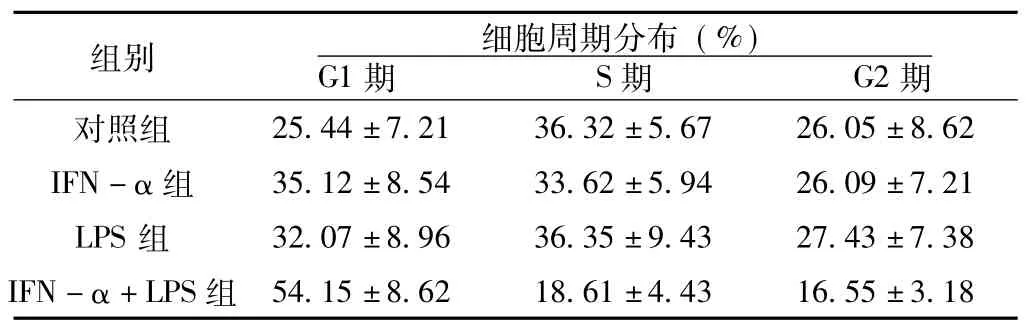
表2 α-干扰素和 (或)脂多糖对U937细胞细胞周期分布的影响Table 2 Cell cycle after IFN-α and/or LPS affection U937 cell lines
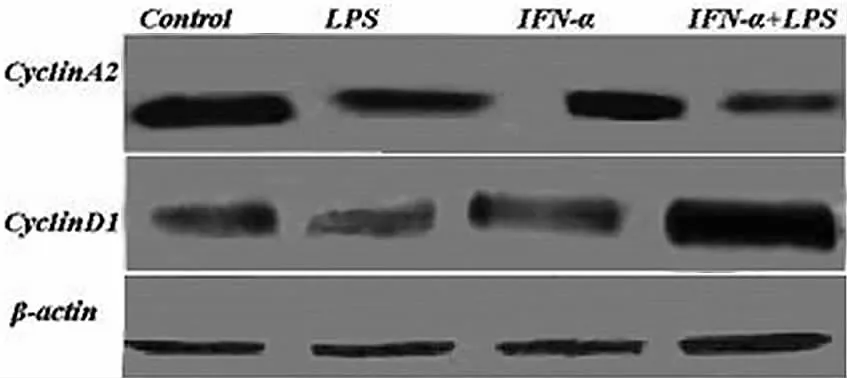
图3 Western blotting检测U937 CyclinA2、CyclinD1蛋白质表达Figure 3 The expression of CyclinA2 and CyclinD1 protein induced by IFN-αand/or LPS in cell lines U937
3 讨论
IFN-α是一种非常有效的抗肿瘤细胞因子,已经广泛用于恶性血液病的治疗并有显著效果[3]。其治疗急性白血病的机制主要是通过调节宿主免疫学反应的活性作用或通过对肿瘤细胞增殖的直接抑制作用发挥抗白血病效应[4]。本研究也证实了IFN-α较对照组而言,能显著抑制细胞增殖、增加G1期细胞的比率、减少S期细胞的比率、增强白血病细胞凋亡。LPS是革兰阴性细菌的细胞壁组成成分,其受体是TLR4。有研究报道TLR1-8在AML细胞株U937细胞均有表达,且运用TLR8激动剂ssRNA40/LyoVec能显著抑制U937细胞增殖、阻滞细胞于G1期,但无明显的促凋亡作用[5]。本研究发现100 ng/ml LPS较对照组而言,能显著抑制U937细胞增殖,增加G1期细胞的比率,减少S期细胞的比率,增加细胞凋亡率。这与Manfred学者报道单用LPS能较弱地抑制白血病细胞增殖、增加细胞凋亡相一致[6]。本研究中将两者以1∶1处理白血病细胞株U937,发现两者联合后较单用其中一种,其白血病细胞的增殖抑制率、细胞凋亡率及G1期细胞均有显著地提高。这与Manfred等[6]学者报道IFN-α联合LPS能明显增强白血病细胞的凋亡相一致。这可能是LPS与U937细胞作用后,与TLR受体结合,通过MyD88依赖通路,募集IL-1R相关蛋白激酶 (IRAK),经由信号分子肿瘤坏死因子受体相关因子6(TRAF6)、p-转化生长因子激活的蛋白激酶 (TAKl)、TAKl结合蛋白1和2(TAB1,TAB2)进入下游信号转导,经p38、ERK等促分裂原活化的蛋白激酶 (MAPK)途经活化激活蛋白-1(AP-1),诱导细胞因子如IL-1、IL-6、TNF-α、干扰素的表达[3],从而增强IFN-α的抗白血病效应,也可能通过Fas相关死亡结构域蛋白 (FADD)依赖的途径促使白血病细胞的凋亡、阻滞细胞于G1期[7]。
细胞周期分为G1、S、G2、M四个时期,存在G1-S和G2-M期两个细胞周期检测点。其中CyclinD1是Gl期运行的主要参与者,CyclinA2是S期DNA复制的必需条件,具有调节DNA合成及促进细胞进入有丝分裂的双重作用[7]。本研究用IFN-α和 (或)LPS处理细胞后,白血病细胞株U937表达周期素CyclinA2蛋白的细胞数较对照组均显著减少,而表达周期素CyclinDl蛋白的细胞数较对照组明显增加。提示IFN-α能有效地通过调控CyclinA2和CycllnDl的表达,减少进入S期和M期细胞的比例,抑制细胞DNA的复制合成和细胞有丝分裂,使细胞更多地滞留于Gl期,无法进入S期,从而抑制细胞增殖,启动细胞凋亡或衰老,最终走向死亡,达到抑制白血病细胞增殖的目的。将两者以1∶1处理白血病细胞株U937,发现两者联合后较单用其中一种有显著地改变。其机制可能是LPS与U937细胞作用后,激活TLRs的表达,介导天然免疫反应并桥接或触发适应性免疫,促使大量的炎症因子如IL-2、IL-8、CCL2、IFN-α及细胞间黏附分子的表达,增强IFN-α的作用,而IFN-α可直接刺激抑癌基因P53的表达,p53可以激活p21等基因的转录,p21是一种CKI分子,它能与S-cdk复合物结合,从而抑制CyclinA2蛋白的表达,阻滞细胞于G1期;也可能是干扰素与干扰素受体结合后,激活JAK-STAT途径,促使G1-cdk的蛋白激酶活性增加,增强 CycllnDl蛋白的表达[8]。
综上,IFN-α与LPS联合使用可协同增强抗白血病作用,这可为IFN-α协同TLR激动剂或TLR配体佐剂的使用为临床免疫治疗白血病提供坚实的理论依据。
1 Schmitt A,Li L,Giannopoulos K,et al.Quantitative expression of Toll-like receptor-2, -4 and-9 in dendritic cells generated from blasts of patients with acute myeloid leukemia [J].Transfusion,2008,48(5):861-870.
2 熊芳,王兴兵,张佳华,等.Toll样受体在U937细胞的表达及其作用研究 [J].中国实验血液学杂志,2007,15(3):449-452.
3 Huang B,Zhao J,Unkeless JC,et al.TLR signaling by tumor and immune cells:a double edged sword[J].Oncogene,2008,27(2):218-232.
4 Lee WH,Liu FH,Lee YL,et al.Interferon - alpha induces the growth inhibition of human T-cell leukaemia line Jurkat through p38alpha and p38beta[J].J Biochem,2010,147(5):645-650.
5 Lion E,Smits EL,Berneman ZN,et al.Acute myeloid leukemic cell lines loaded with synthetic dsRNA trigger IFN-gamma secretion by human NK cells[J].Leuk Res,2009,33(4):539-546.
6 Manfred L,Marco B,Daniel S,et al.Caspase-8 dependent apoptosisinduction in malignant myeloid cells by TLR stimulation in the presence of IFN - alpha[J].Leukemia Research,2008,31(12):1729-1741.
7 Ramadevi Mani S,Lakshmi BS.G1 Arrest and caspase-mediated apoptosis in HL-60 cells by dichloromethane extract of Centrosema pubescens[J].Am J Chin Med,2010,38(6):1143 -1159.
8 Akira S.Toll-like receptor signaling[J].J Biol Chem,2003,278(40):38105-38118.

