CO2浓度与N素形态对白桦幼苗NO-3-N代谢的影响
单莉莉,郑 红,张 健,庄 凯,刘婷岩
(东北林业大学林学院,哈尔滨 150040)
CO2浓度升高时,植物可通过提高养分利用效率、增加根系质量以及提高根系吸收能力等途径增加N素的吸收[1-5],也可以通过改变硝酸还原酶(NR)活性影响N素吸收[6]。NR活性与植物NO-3-N代谢关系密切,其活性受CO2浓度、供应N形态影响。多数研究认为,升高CO2能够提高植物的NR活性[4,7-11],NR活性随底物NO-3-N浓度增加而升高[12-18],但研究CO2浓度和N形态共同作用对植物NR活性的影响较少,仅见于对番茄等(Lycopersicun esculenturn Mil1)的研究,CO2浓度升高显著提高了5种N形态配比下番茄NR活性,亦改变了不同N形态比例下NR活性的变化规律[17]。升高CO2和供应不同N形态比例对NR活性的影响在木本植物中是否也具有这样的现象,是否也改变了NR活性在不同供N形态比例下的变化规律?这是本研究要探讨的问题。随着大气CO2浓度和土壤NO-3-N比例的增加,植物N代谢能力增强,N素尤其是NO-3-N吸收增加,对缓解N沉降带来的土壤及地下水体污染等具有重要的现实意义。
本研究设定五种NO-3-N/NH+4-N比例(100/0、75/25、50/50、25/75、0/100),比较正常CO2浓度 (380μmol·mol-1)和 CO2浓度倍增处 理 (760μmol· mol-1) 下,白 桦 (Betula platyphylla)幼苗根系和叶片NR活性、叶片NO-3-N浓度及可溶性蛋白含量的变化。本研究旨在了解升高CO2对木本植物NO-3-N代谢在不同N形态比例下的影响规律,为今后研究不同土壤环境条件下CO2浓度升高对木本植物NO-3-N代谢的影响提供理论依据。
1 材料与方法
1.1 材料与实验设计
在东北林业大学帽儿山试验林场,选取饱满的白桦种子,经催芽处理后,于春季播种于苗床,进行统一的浇水和施肥管理。实验开始前选取生长较一致的1年生白桦幼苗,移植到温室内经过1个月的沙培处理,然后移栽在CO2人工气候箱 (Pervical,PGC-9/2)内进行水培实验。
水培实验设计2个因子,CO2浓度和NO-3-N/NH+4-N比例。CO2浓度设为正常浓度(380μmol· mol-1) 和 倍 增 浓 度 (760μmol·mol-1)。在供 N量相同的情况下 (总 N浓度为8.0 mmol·L-1),NO-3-N/NH-4-N比例设为:100/0、75/25、50/50、25/75、0/100五个水平,共10个处理,每个处理设3个重复。不同NO-3-N/NH+4-N比例营养液大量元素组成见表1,微量元素组成参照连兆煌的方法[19]。
水培实验所用容器大小为8 L,每个容器内栽植6株幼苗。培养前将幼苗用蒸馏水清洗干净然后移栽,培养开始时先以Hoagland营养液培养7 d,而后移入不同NO-3-N/NH+4-N比例的营养液中培养40 d。人工气候箱光照时间为14 h/d,温度模拟室外温度变化控制为15~25℃,相对湿度白天85%,晚上90%。营养液每4 d更换1次,每天用0.1mmol·L-1的 KOH 或 HCl将 pH 值调至6.0±0.2,早晚各通气15 min。
1.2 生化指标测定
NR活性参照张志良和瞿伟菁的方法测定[20],植物体NO-3-N及可溶性蛋白含量参照李合生的方法测定[21]。
1.3 数据处理
用SPSS11.0进行方差分析和多重比较,用SigmaPlot10.0作图。
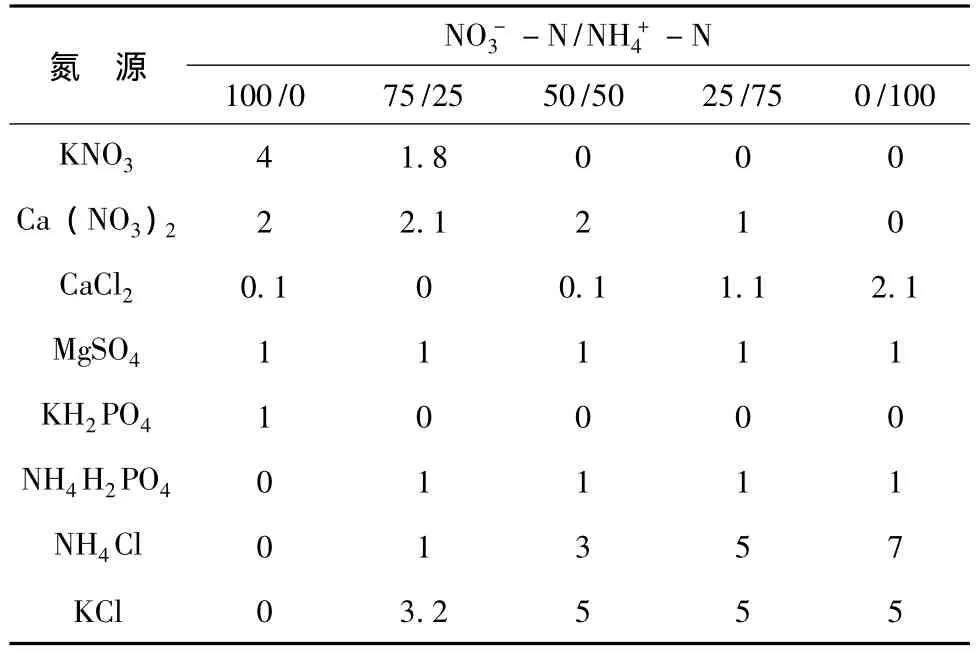
表1不同NO3--N/NH4+-N(%/%)比例的营养液组成 (mmol·L-1)Tab.1 Nutrient solution composition(mmol·L -1)at different NO3--N/NH4+-N ratios
2 结果与分析
2.1 CO2浓度与NO-3-N/NH+4-N对NR活性的影响
硝酸还原酶 (Nitrate reductase,NR)活性一般随底物NO-3-N 浓度增加而升高[15-16]。与此相似,在正常CO2浓度和倍增CO2浓度下白桦幼苗根系的NR活性均随营养液NO-3-N供应比例的增加而提高(如图1所示),NR活性在NO-3-N/为100/0时最高 (0.64,1.93μmol·h-1·g-1FW),在NO-3-N/NH+4-N为0/100时最低(0.12,0.14 μmol·h-1·g-1·FW),N 形态对NR活性的影响极显著 (p<0.001)。CO2浓度倍增时,白桦幼苗根系的NR活性增加,与正常CO2浓度相比,增加15%~200%。其中,当NO-3-N/NH+4-N≥50/50时,倍增CO2处理显著高于正常CO2浓度处理 (p<0.05)。经检验,CO2浓度与的交互作用对白桦幼苗根系的NR活性的影响显著 (p<0.001)。
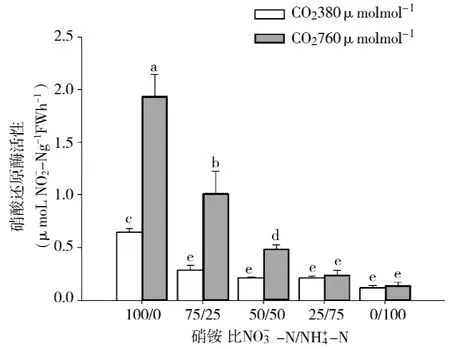
图1CO2浓度及NO-3-N/NH+4-N对白桦幼苗根系NR活性的影响Fig.1 Effect of CO2concentration and NO-3-N/NH+4-N ratios on NRA in root of birch seedlings
两种CO2浓度处理,白桦幼苗叶片NR活性表现出与根系相同的趋势,亦随营养液NO-3-N供应比例的增加而提高 (如图2所示),N素形态对NR活性的影响极显著 (p<0.001)。倍增CO2浓度处理,白桦幼苗叶片的NR活性与正常CO2浓度相比增加41%156%。其中,当NO-3-N/NH+4-N≥75/25时,倍增CO2处理显著高于正常CO2浓度处理(p<0.05)。经检验,CO2浓度与NO-3-N/NH+4-N的交互作用对白桦幼苗叶片NR活性的影响显著 (p<0.001)。此外,白桦幼苗叶片NR活性普遍高于根系NR活性,这说明NR主要分布在白桦幼苗的叶片部位,叶片是NO-3还原的主要场所。
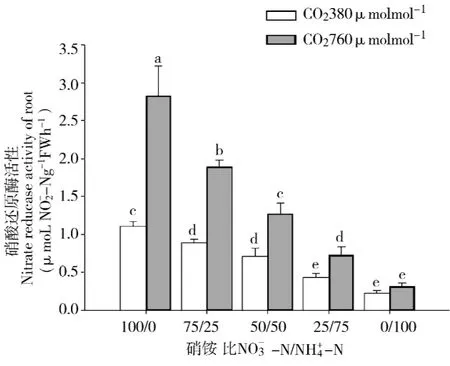
图2 CO2浓度及NO-3-N/NH+4-N对白桦幼苗叶片NR活性的影响Fig.2 Effect of CO2concentration and NO-3-N/NH+4-N ratios on NRA in foliage of birch seedlings
2.2 CO2浓度与NO-3-N/NH+4-N对NO-3-N浓度的影响
白桦幼苗叶片浓度与营养液比例及CO2浓度有关。正常CO2浓度处理,白桦幼苗叶片浓度在各种营养液供应时差异不显著 (p>0.05),但有随营养液NO-3-N比例增加而增加的趋势。倍增CO2处理,白桦幼苗叶片NO-3-N浓度随营养液NO-
3-N比例增加而显著增加,且增加程度不断加大,均明显高于正常CO2浓度处理 (p<0.001)(如图3所示),在NO-3-N/NH+4-N为75/25、50/50及25/75时,NO-3-N浓度相差不大(p>0.05),其它两种比例NO-3-N浓度差异则很显著 (p<0.001)。经检验,CO2浓度倍增与的交互作用对白桦幼苗N浓度的影响显著 (p<0.001)。
2.3 CO2浓度与NO-3-N/NH+4-N对可溶性蛋白含量的影响
叶片中可溶性蛋白含量的高低也会反映植株的N素代谢水平。由图4可知,两种CO2浓度处理,白桦幼苗叶片的可溶性蛋白含量随营养液NH+4-N比例的增加有下降的趋势。正常CO2浓度处理时的可溶性蛋白含量在各种NO-3-N/NH+4-N营养液中差异不明显 (p>0.05),倍增CO2促进了白桦幼苗叶片的可溶性蛋白含量,当NO-3-N/NH+4-N为100/0时,可溶性蛋白含量明显高于正常CO2浓度处理 (p<0.05),其它比例时的可溶性蛋白含量相差不大,均不显著高于正常CO2浓度处理 (p>0.05)。经检验,CO2浓度倍增与N/NH+4-N的交互作用对白桦幼苗叶片可溶性蛋白含量的影响不显著 (p>0.05)。
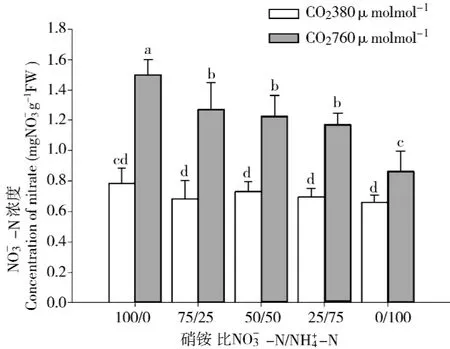
图3 CO2浓度及NO3--N/NH4+-N对白桦幼苗NO3--N浓度的影响Fig.3 Effect of CO2concentration and NO3--N/NH4+-N ratios on concentration of NO3--N of birch seedlings
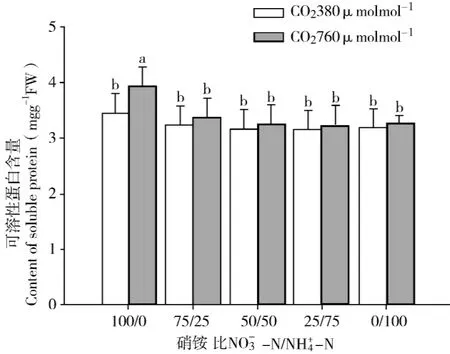
图4 CO2浓度及NO3--N/NH4+-N对白桦幼苗可溶性蛋白的影响Fig.4 Effect of CO2concentration and NO3--N/NH4+-N ratios on soluble protein of birch seedlings
3 讨论
植物N素代谢能力主要反应在代谢酶上。其中,NR是植物N素同化过程中的关键酶,也是典型的底物诱导酶,其活性一般随底物NO-3-N浓度增加而升高[15-16]。本研究中白桦幼苗根系和叶片NR活性均呈现此趋势,NH+4-N的存在可能降低NR的活性[22]。升高CO2能够提高小麦幼苗叶片的NR活性[9],不同程度地提高了水稻各生育期叶片的NR活性[10],增强了火炬松 (Pinus taeda)根系、美洲枫香 (Liquidambar styraciflua)叶片及根系的NR活性,同时美洲枫香叶片NR活性较根系NR活性提高了30%[4]。本研究也表明,CO2浓度倍增促进了白桦幼苗根系和叶片的NR活性,在不受NH+4-N影响的情况下,对NR活性的促进作用尤为明显,同时叶片NR活性高于根系NR活性45%以上。这可能是由于CO2浓度升高直接作用于NR合成的初始阶段,通过调节酶的合成促进酶的活性[8],且本试验白桦幼苗叶片暴露在高浓度的CO2中,比根系更易受到CO2浓度升高的影响。但也有不同结论,升高CO2降低了火炬松叶片的NR活性[4],明显抑制玉米的NR活性[23]。上述差异可能与植物种类、植株部位以及植物的生长时期等有关。
植物叶片浓度一般随营养液比例的增加而增加[13-14,24],且与叶片 NR 活性存在一定的对应关系[14]。本研究中,白桦幼苗叶片亦呈现此种规律,CO2浓度倍增时这种规律性更加明显。正常CO2浓度的叶片NO-3-N浓度与叶片NR活性相关性不大 (r=0.43),这种NO-3-N与NR活性存在的非一致性,可能是造成NO-3-N在植物体积累的一个重要原因[25]。CO2浓度倍增后叶片NO-3-N浓度与叶片NR活性呈正相关 (r=0.83),这可能是CO2浓度倍增时白桦吸收的-N已经在体内聚集,体内较高的NO-3-N浓度可以诱导NR活性的增加[12]。
植物体内的可溶蛋白既是N素吸收同化的产物,又是植物体内可转运N的贮存物。CO2浓度升高影响了植物叶片可溶性蛋白的含量,FACE条件增加了水稻顶叶的可溶蛋白含量[26]。本研究也表明,CO2浓度倍增处理的叶片可溶性蛋白含量要高于正常CO2浓度处理。这可能是升高CO2时,光合增强导致了碳水化合物合成及转化增多,从而引起可溶性蛋白含量变化[27]。有研究表明,可溶性蛋白含量与叶片NR活性存在显著的正相关性[12,28],本研究中白桦幼苗也表现出了这种相关性(r=0.67)。
倍增CO2明显增强了白桦幼苗NO-3-N代谢能力,根系和叶片NR活性、叶片NO-3-N浓度和可溶性蛋白含量均较正常CO2浓度有所提高。CO2浓度升高,植物NO-3-N代谢能力增强,进而可以增加NO-3-N吸收,这对缓解N沉降带来的土壤及地下水体污染等具有重要的现实意义,亦为今后研究不同土壤环境条件下CO2浓度升高对木本植物NO-3-N代谢的影响提供了重要的理论依据。
】
[1] Bassirirad H.Kinetics of nutrient uptake by roots:responses to global change[J].New Phytologist,2000,147(1):155 -169.
[2] BassiriRad H,Gutschick V P,Lussenhop J.Root system adjustments:regulation of plant nutrient uptake and growth responses to elevated CO2[J].Oecologia,2001,26(3):305 -320.
[3] Rothstein D E,Zak D R,Pregitzer K S,et al.Kinetics of nitrogen uptake by Populus tremuloides in relation to atmospheric CO2and soil nitrogen availability[J].Tree Physiology,2000(20):265 -270.
[4] Constable J H,Bassirirad H,Lussenhop J,et al.Influence of elevated CO2and mycorrhizae on nitrogen acquisition:contrasting responses in Pinus taeda and Liquidambar styraciflua[J].Tree Physiology,2001(21):83 -91.
[5] Zerihun A,Bassirirad H.Interspecies variation in nitrogen uptake kinetic responses of temperate forest species to elevated CO2:potential causes and consequences[J].Global Change Biology 2001(7):211-222.
[6] Natali S M,Sanudo-Wilhelmy S A,Lerdau M T.Effects of elevated carbon dioxide and nitrogen fertilization on nitrate reductase activity in sweetgum and loblolly pine trees in two temperate forests[J].Plant and Soil,2009,314(1):197 -210.
[7] 徐智广,邹定辉,鑫 张,等.CO2和硝氮加富对龙须菜(Gracilaria lemaneiformis)生长、生化组分和营养盐吸收的影响[J].生态学报,2008,28(8):3752 -3759.
[8] Gordillo L,Niell F,Figueroa F L.Non -photosynthetic enhancement of growth by high CO2level in the nitrophilic seaweed Ulva rigida C.Agardh(Chlorophyta)[J].Planta,2001(213):64 -70.
[9]宋淑英,许育彬,李世清,等.CO2倍增对不同氮水平下小麦幼苗根系及叶片NR活性的影响[J].西北植物学报,2010,30(11):2203-2209.
[10]王 亮,朱建国,朱春梧,等.高浓度CO2条件下水稻叶片氮含量下降与氮代谢关键酶活性的关系[J].中国水稻科学,2008,22(5):499-506.
[11] Mercado J M,Javier F,Gordillo L,et al.Effects of different levels of CO2on photosynthesis and cell components of the red alga Porphyra leucosticta[J].Journal of Applied Phycology,1999,11(5):455-461.
[12]李 霞,阎秀峰,刘剑锋.氮素形态对黄檗幼苗生长及氮代谢相关酶类的影响[J].植物学通报,2006,23(3):255 -261.
[13]汪建飞,董彩霞,越 谢,等.铵硝比和磷素营养对菠菜生长、氮素吸收和相关酶活性的影响[J].土壤学报,2006,43(6):954-960.
[14]董海荣,李金才,李存东.不同NH4+/NO3-比例的氮素营养对棉花氮素代谢的影响[J].应用生态学报,2004,15(4):728-730.
[15]李彩凤,马凤呜,赵 越,等.氮素形态对甜菜氮糖代谢关键酶活性及其产物的影响[J].作物学报,2003,29(1):128 -132.
[16]田霄鸿,王朝晖,李生秀.不同氮素形态及配比对蔬菜生长和品质的影响[J].西北农业大学学报,1999,16(2):199 -206.
[17]李 娟,周健民.水培条件下CO2与NH4+/NO3-配比对番茄幼苗生育的影响[J].农业工程学报,2006,22(7):138-142.
[18] Rothstein D E,Cregg B M.Effects of nitrogen form on nutrient uptake and physiology of Fraser fir(Abies fraseri)[J].Forest Ecology and Management,2005(219):69 -80.
[19]连兆煌.无土栽培原理与技术[M].北京:中国农业出版社,1992:59.
[20]张志良,瞿伟菁.植物生理学实验指导(第三版)[M].北京:高等教育出版社,2003:41-43.
[21]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000:123-125,184 -185.
[22] Mengel K,Robin P,Salsac L.Nitrate reductase activity in shoots and roots of maize seedlings as affected by the form of nitrogen nutrition and the pH of the nutrient solution[J].Plant Physiology,1983(71):618-622.
[23] Purvis A,Peter D,Hageman R H.Effect of carbon dioxide on nitrate accumulation and nitrate reductase induction in corn seedlings[J].Plant Physiology,1974(53):934 -941.
[24]黄东风,李卫华,邱孝煊.不同硝、铵态氮水平配施对小白菜生长及硝酸盐累积的影响[J].土壤通报,2010,41(2):394-398.
[25] Datta R,Sharma R.Temporal and spatial regulation of nitrate reductase and nitrite reductase in greening maize leaves[J].Plant Sci.,1999(144):77 -83.
[26]胡 健,王余龙,杨连新,等.开放式二氧化碳浓度提高对武香粳14叶片硝酸还原酶活力的影响[J].应用生态学报,2006,17(11):2179-2184.
[27] Kozlowski T T,Kramer P J,Pallardy S G.The Physiological Ecology of Woody Plants[M].NewYork:Academic Press,1991:45 -78.
[28] Hageman R H,Flesher D.Nitrate reductase activity in corn seedlings as affected by light and nitrate content of nutrient media[J].Plant Physiology,1960,35(5):700 -708.

