神经型钙黏附蛋白在大肠腺癌组织中的表达及意义
韩黎丽,刘 宇 ,邓文英,陈小兵,李 宁,罗素霞
(1郑州大学基础医学院,郑州 450000;2郑州大学附属肿瘤医院)
cadherin家族是由一系列结构和功能相似的单链跨膜糖蛋白组成,按其最初来源分为上皮型、神经型和胎盘型3种,主要参与介导钙离子依赖的同型细胞间的黏附。研究发现,神经型钙黏附蛋白(N-cadherin)可促使癌细胞从癌组织块上脱离及癌细胞与内皮或基质成分黏附,在肿瘤形成的过程中有助于血管形成及上皮细胞—间质细胞的迁移,从而使肿瘤细胞更加富于侵袭性,易于转移[1~3]。2001~2005年,我们采用免疫组织化学的方法检测了98例大肠腺癌组织以及10份癌旁组织中N-cadherin表达情况,并分析其表达与临床病理的关系。
1 材料与方法
1.1 临床资料 98份大肠癌组织标本(观察组),患者男63例,女35例;年龄32~76岁,平均56.3岁。均经手术病理检查证实诊断。组织学分级:Ⅰ级(高分化)34例,Ⅱ级(中等分化)38例,Ⅲ级(低分化)26例。根据2003版美国肿瘤联合会(AJCC)和国际抗癌联盟(UICC)大肠癌TNM临床分期标准,Ⅰ期15例,Ⅱ期49例,Ⅲ期34例。术前均未接受放、化疗或其它特殊治疗。对照组为10例正常大肠上皮组织(取自手术切除标本的两残端,距癌组织3 cm以上),经病理证实为分化良好的腺上皮及少量固有层成分。
1.2 N-cadherin检测 N-cadherin鼠抗人单克隆抗体均购自美国Abcam公司,工作浓度均为1∶110;PV-9000二步法免疫组织化学检测试剂盒、DAB显色增强剂购自北京中杉生物技术有限公司。两组标本甲醛固定,石蜡包埋,行HE染色。用已知表达N-cadherin的精原细胞瘤组织切片作阳性对照;以未经免疫的鼠IgG代替一抗作为阴性对照;以PBS代替一抗作为空白对照。染色结果由3名医师双盲评价,每例至少评价5个高倍镜视野,每个视野观察细胞数不少于200个。将胞质着色判为阳性,按阳性细胞所占百分比及着色深浅判定结果。细胞染色:细胞无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。按阳性细胞数百分比评分:0分,无阳性细胞;1分,阳性细胞<10%;2分,阳性细胞为10% ~50%;3分,阳性细胞>50%。取两项评分的乘积作为终评分:0分为阴性或弱阳性,1分为中度阳性,2分为强阳性,≥1分为阳性。
1.4 统计学方法 采用SPSS16.0统计软件。两个有序变量之间的联系用Spearman相关分析;分类变量之间的比较用χ2检验。检验水准α=0.05。
2 结果
2.1 N-cadherin表达 观察组N-cadherin阳性率为71.4%,对照组未见N-cadherin表达(P<0.01)。
2.2 N-cadherin的表达与大肠腺癌临床病理特征的关系 见表1。
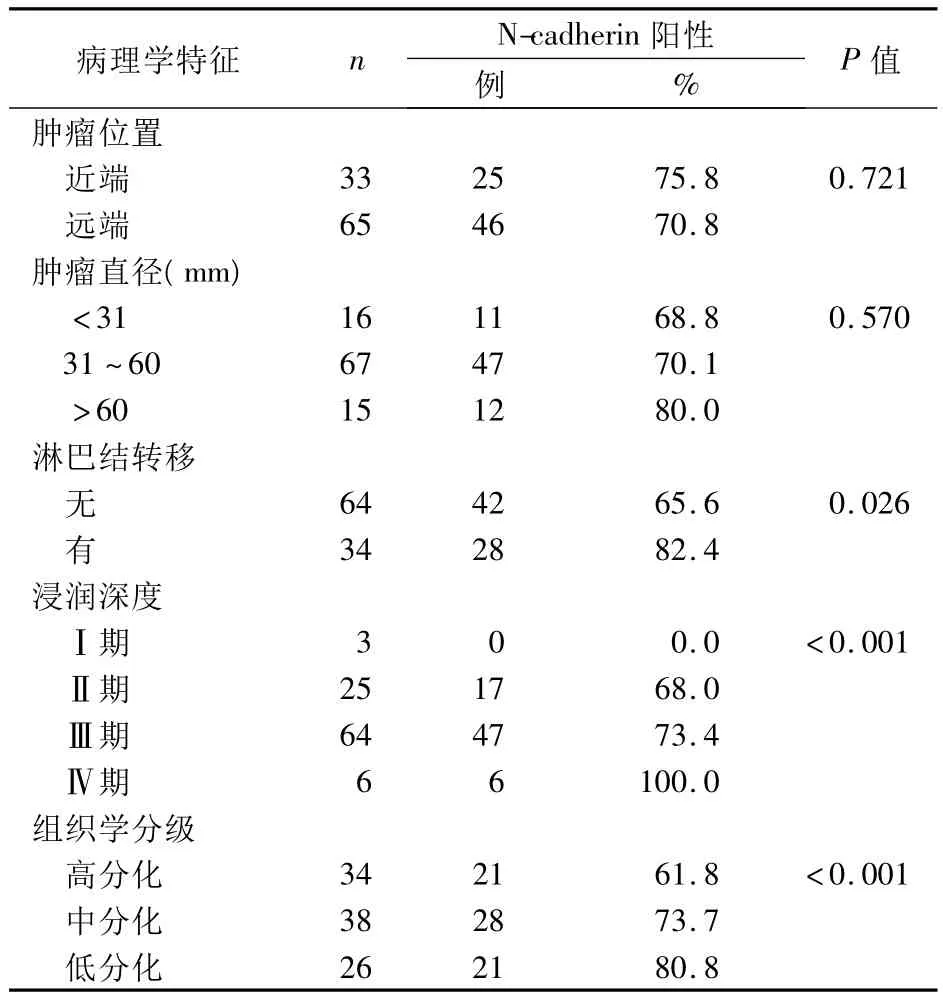
表1 N-cadherin表达与大肠腺癌临床病理特征的关系
3 讨论
N-Cadherin 基因定位于 18q11.2[4],表达相对分子质量约120 kD的单链跨膜糖蛋白。研究发现,N-cadherin蛋白在胚胎的发育以及多种生物学过程(消化道形成、神经突触的形成以及调节垂体后叶的活动)中起重要作用[5~7],被认为是一种潜在的促癌基因。
本研究发现,N-cadherin在大肠腺癌细胞的胞质均有不同程度表达。其表达水平与大肠腺癌患者年龄、性别、肿瘤位置、肿瘤大小、浸润深度以及淋巴结转移情况无关,但与肿瘤的TNM分期以及组织学分级呈正相关,即肿瘤的临床分期越高,肿瘤细胞的分化程度越低,N-cadherin的表达越高。其促进肿瘤侵袭及转移的可能机制:①使表皮生长因子受体(EGFR)的作用持续增强[8]。EGFR是一种具有酪氨酸激酶特性的生长因子受体,当表皮生长因子与之结合后可刺激细胞的分裂和增殖,从而促进肿瘤形成。②直接作用于成纤维细胞生长因子受体,调节肿瘤细胞的侵袭和转移[9]。③增加恶性T细胞瘤对上皮细胞的黏附力,使其更容易发生转移[10]。④激活MAPKERK信号转导系统,诱导MMP-9表达,促进肿瘤血管的形成,使肿瘤易于生长和转移。
综上所述,N-cadherin参与了大肠腺癌的浸润和转移,有望成为大肠癌治疗的新靶点。
[1]Suyama K,Shapiro I,Guttman M,et al.A signaling pathway leading to metastasis is controlled by N-cadherin and the FGF receptor[J].Cancer cell,2002,2(4):301-314.
[2]Jaggi M,Nazemi T,Abrahams NA,et al.N-cadherin switching occurs in high Gleason grade prostate cancer[J].The Prostate,2006,66(2):193-199.
[3]Nagi C,Guttman M,Jaffer S,et al.N-cadherin expression in breast cancer:correlation with an aggressive histologic variant--invasive micropapillary carcinoma[J].Breast Cancer Res Treat,2005,94(3):225-235.
[4]Tran NL,Nagle RB,Cress AE,et al.N-cadherin expression in human prostate carcinoma cell lines.An epithelial-mesenchymal transformation mediating adhesion with stromal cells[J].Am J Pathol,1999,155(3):787-798.
[5]Garcia-Castro MI,Vielmetter E,Bronner-Fraser M.N-cadherin,A cell adhesion molecule involved in establishment of embryonic left right asymmetry[J].Science,2000,288(5468):1047-1051.
[6]Tanaka H,Shan W,Phillips G,et al.Molecular modification of N-cadherin in response to synaptic activity[J].Neuron,2000,25(13):93-107.
[7]Rubinek T,Yu R,Hadani M,et al.The cell adhesion molecules N-cadherin and neural cell adhesion molecule regulate human growth hormone:a novel mechanism for regulating pituitary hormone secretion[J].J Clin Endocrinol Met,2003,88(8):3724-3730.
[8]Suyama K,Shapiro I,Guttman M,et al.A signaling pathway leading to metastasis is controlled by N-cadherin and the FGF receptor[J].Cancer Cell,2002,2(7):301-314.
[9]Wheelock MJ,Johnson KR.Cadherin-mediated cellular signaling[J].Curr Opin Cell Biol,2003,15(5):509-514.
[10]Makagiansar IT,Yusuf-Makagiansar H,Ikesue A,et al.N-cadherin involvement in the heterotypic adherence of malignant Tcells to epithelia[J].Mol Cell Biochem,2002,233(1-2):1-8.

