中华鲟软骨抗肿瘤活性的实验研究
吕宝军 谢小铭 谭 敏
1.中山大学附属第五医院普外II区,广东 珠海 519000;2.中山大学附属第五医院急诊科,广东 珠海 519000;3.中山大学附属第一医院微创外科,广东 广州 510080
自80年代开始,世界各国科学家,均深入研究了鲨鱼软骨的临床应用,并取得了令人瞩目的成就[1]。中华鲟昵称“水中熊猫”是一种在海洋中生长,在淡水中繁殖的大型海河洄游性软骨硬鳞鱼类,除了头部有几块膜化骨之外,全身都是软骨[2]。我们拟从中华鲟软骨分离得到中华鲟软骨活性制剂,通过体内体外实验对其抗肿瘤效应进行了初步的研究,为我国生物医药的发展及宝贵资源的发掘开辟了一条新路。
1 材料与方法
1.1 原料与试剂 中华鲟 (顺德市创世纪农业园馈赠)、Millipore超滤器 (5,000和100,000)(Amicon公司)、健康三级纯系 BALB/c-nu裸小鼠 (雌性、体重相近20±0.2g、约6-7周龄)(中山大学实验动物中心)、人结肠癌lovo细胞株 (中山大学实验动物中心)。
1.2 中华鲟软骨有效成分的抽提、分离和浓度的测定 剖取200g中华鲟软骨,将中华鲟软骨用组织粉碎机粉碎至匀浆,经400ml1M盐酸胍抽提48h,45% ~65%丙酮的分级沉淀,5,000分子量和100,000分子量的Millipore超滤器等步骤超滤得到中华鲟软骨溶液a(全成份)、中华鲟软骨溶液b(≥100,000分子量)、中华鲟软骨溶液c(5,000~100,000)三种溶液,通过Bradford法测定中华鲟软骨溶液蛋白质的浓度。
1.3 体外抑制血管生成作用的实验研究 (付生法[3])滤纸放入打孔器中制作直径1mm的滤纸片,高温高压消毒备用,将40只受精鸡蛋表面酒精消毒后放入37.8℃孵化箱,孵化至第7天时,暴露出绒毛尿囊膜,将已经消毒的滤纸小片放入中华鲟软骨溶液a、中华鲟软骨溶液b、中华鲟软骨溶液c中浸湿后,部分放入生理盐水中,分别选取10只鸡胚,依次用小镊子夹取a、b、c溶液以及生理盐水中的滤纸片放入绒毛尿囊膜血管较少的部位作为a组、b组、c组、生理盐水组,孵化2天后揭除透明胶带取膜制作标本,将制作的标本摄像血管计数,以给药点为中心,以半径间隔5mm将鸡胚绒毛尿囊膜划分为3个区域,计数各区域的主血管数的总和。
1.4 中华鲟软骨活性成分抑制荷结肠癌裸鼠肿瘤生长的体内实验 设8组,中华鲟软骨溶液a灌喂组和腹腔注射组、中华鲟软骨溶液b灌喂组和腹腔注射组、中华鲟软骨溶液c灌喂组和腹腔注射组、生理盐水灌喂组和腹腔注射组8组,每组10只,灌喂剂量0.2ml,腹腔注射同上,接种第二天开始每日一次共用药14天,人结肠癌lovo细胞悬液调整浓度为1×107/ml,每鼠右腋皮下接种0.2ml,用药14天后用颈椎脱臼处死小鼠,解剖并完整的分离出皮下瘤块,称瘤重,计算平均瘤重和抑瘤率。抑瘤率 (%)=对照组平均抑瘤率-试验组平均抑瘤率/对照组平均抑瘤率×100%。
2 结果
2.1 超滤所获得的中华鲟软骨粗溶液a、b、c的浓度分别是 12.389mg/ml、34.048mg/ml、0.221mg/ml,见表 1。

表1 中华鲟软骨溶液OD值与浓度的关系表
2.2 中华鲟软骨活性成分抑制血管生成的体外实验研究目前,公认的血管生长抑制模型有两种,即兔角膜诱生新生血管抑制模型和鸡胚绒毛尿囊膜血管生长抑制模型。我们应用后一种模型来检测软骨蛋白的活性,结果表明,生理盐水组血管生长良好,血管分支适中,中华鲟软骨溶液a、b、c与生理盐水对照相比,软骨对血管生成有明显的抑制作用,血管分支减少,尤其以溶液c抑制效果较显著,结果如表2、图1所示。计数各处理组及各区域的主血管数,a组平均主血管数为 (21.52±3.64),相对于生理盐水平均主血管数 (33.84±3.14)差异显著 (t=2.47,P<0.05);b组平均主血管数为 (28.41±2.13),与生理盐水组对照差异不显著 (t=2.03,P>0.05);c组平均主血管数为 (7.16±1.31),相对于生理盐水平均主血管数有统计学差异 (t=4.92,P<0.05)。
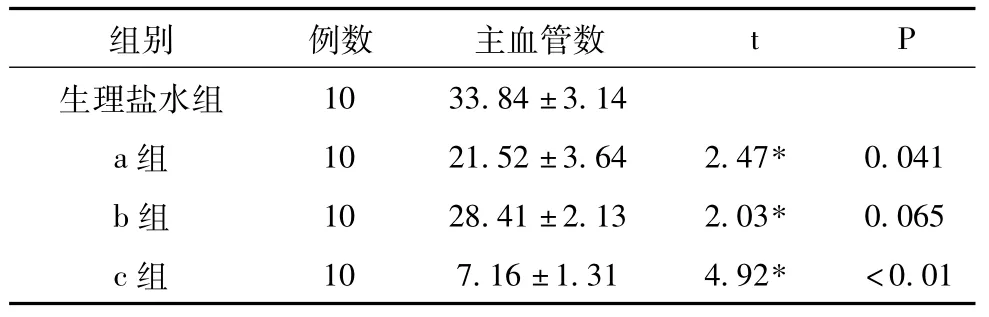
表2 三组中华鲟软骨溶液抑制血管生成的各区域的主血管数 (x±s条)
2.3 如表3所示,中华鲟软骨溶液a腹腔注射组和灌喂组的平均瘤重分别为 (0.41±0.06)、(0.53±0.03),相对于生理盐水注射组和灌喂组的平均瘤重 (0.52±0.08)、(0.56±0.04)腹腔注射组有所降低,且P<0.05有统计学意义。中华鲟软骨溶液c腹腔注射组和灌喂组的平均瘤重分别为 (0.31±0.09)、(0.53±0.05),相对于生理盐水注射组和灌喂组的平均瘤重,腹腔注射组有所降低并且P<0.01有统计学意义。中华鲟软骨溶液b腹腔注射组和灌喂组的平均瘤重分别为 (0.46±0.07)、(0.59±0.06),相对于生理盐水注射组和灌喂组的平均瘤重P>0.05无统计学意义。结果表明,中华鲟软骨溶液对荷lovo结肠癌裸鼠肿瘤的生长具有抑制作用。中华鲟软骨溶液a、溶液c以腹腔注射的方式对lovo结肠癌的生长具有一定得抑制作用,尤其以溶液c抑制效果较为显著。

表3 中华鲟软骨对荷lovo结肠癌裸鼠肿瘤生长的抑制效应
3 讨论
动物软骨是一种特殊的结缔组织,由软骨细胞、纤维和基质构成。软骨中含有大量的粘多糖、胺基糖及丰富的活性蛋白,其中有多种抗肿瘤有效成分,如血管生成抑制因子、抗入侵因子和肿瘤细胞因子等[4]。软骨血管抑制因子直接来源于动物组织,无明显的毒副作用,它与其他血管抑制剂不同,对人正常细胞无抑制作用,能够特异的抑制血管内皮细胞的增殖和迁移,与内皮生长抑制素相比,仅用1/10的量,具有明显高效的抑瘤率[5]。由于中华鲟人工繁殖和饲养的成功,与小牛软骨来源和鲨鱼来源的血管生成抑制因子相比,它的原料来源丰富。由于软骨是生物机体主要的无血管组织,多年来,人们希望从中提纯血管生成抑制因子,然而软骨组织含有丰富的酸性年多糖等生物大分子,使得从中提取上述活性物质尤其困难。血管生成是肿瘤持续生长和发生转移的必要前提,在生长初期,肿瘤细胞可以通过扩散从细胞间隙获得营养和氧气,但当肿瘤增至1-2mm3时,内部的细胞通过扩散不能获得足够的氧气和营养满足其继续生长和分裂的需要,肿瘤内部形成缺氧状态,这时缺氧作为一种环境信号启动了瘤细胞中血管内皮生长因子、碱性成纤维细胞生长因子等血管生成正调控因子的表达,使肿瘤具有了促血管生成表型。肿瘤内形成的血管提供了氧气和营养,也同时提供了肿瘤转移的通路。如果肿瘤血管生成被抑制,就切断了肿瘤生长所需的氧气和营养供应,同时也切断了肿瘤转移的重要通路,使肿瘤处于无症状休眠状态,再联合其他手段就有可能彻底治愈肿瘤,这就是通过抑制血管生成治疗肿瘤的理论基础[6]。
我们通过粗略地将中华鲟软骨分成几个组分,通过体外实验检验对比各组分抑制血管生成的作用,发现软骨c组分对血管的生成和肿瘤的增殖具有明显的抑制作用,证明了中华鲟软骨内含有高效的血管生成抑制成分。
由于中华鲟软骨中含有丰富的血管生成抑制因子,能够抑制肿瘤血管生成而抑制肿瘤的生长和转移,并且中华鲟软骨中含有丰富的酸性粘多糖,能够刺激机体免疫功能,增强机体抗肿瘤抗病能力。因此,我们认为中华鲟软骨制剂具有抗肿瘤作用,关键是应该建立合理的制备工艺,有效提取软骨抗肿瘤活性成分-血管生成抑制因子,同时剔除软骨中存在的抗肿瘤有害成分-血管生成刺激因子和肿瘤细胞生长刺激因子。因此,从中华鲟软骨中纯化制备血管生成抑制因子应用于抗血管生成新药的开发,具有重要意义。
[1]Mefly L,Simjee S,Smith SL.Induction of inflammatory cytokines by cartilage extracts[J].Int Immunopharmacol,2007,7(3):383 -391.
[2]吴立人.“保护中华鲟”的科技实践活动.生物学教学,2010,35(4):49-51.
[3]付生法,陆应麟,张朝山等.检测血管生长因子作用的鸡胚绒毛尿囊膜技术.军事医学科学院院刊,1993,17(4):294-296.
[4]尚俊英,谢裕安,杨帆,等.鲨鱼软骨低分子蛋白的提取及其抑制新生血管形成的初步研究.广西医学,2008,30(2):156-158.
[5]余新威,罗红宇,徐佳晶,等.赤魟软骨新生血管抑制组分的制备及其活性的初步研究.浙江海洋学院学报:自然科学版,2007,26(2):147-149.
[6]Rabbani-Chadegani A,Abdossamadi S,Bargahi A,et al.Identification of low-molecular-weight protein(SCP1)from shark cartilage with anti-angiogenesis activity and sequence similarity to parvalbumin.J Pharm Biomed Anal,2008,46(3):563-567.

