禾谷缢管蚜对三个小麦品种幼苗保护酶的影响
张廷伟, 刘长仲
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,兰州 730070)
禾谷缢管蚜对三个小麦品种幼苗保护酶的影响
张廷伟, 刘长仲*
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,兰州 730070)
[目的]研究禾谷缢管蚜对3个小麦品种幼苗保护酶的影响。[方法]采用室内人工接虫的方法,研究‘XM800’(高抗)、‘Selkirk Yr27’(中抗)和‘兰天 24号’(高感)3种不同抗蚜小麦品种受禾谷缢管蚜[Rhopalosiphum padi(L.)]为害初期幼苗体内SOD、POD、PPO等酶活性的变化。[结果]禾谷缢管蚜为害后,在一定时期内3个小麦品种的SOD、POD、PPO活性都呈上升趋势,且品种抗性越强,酶活力增加越明显;3个小麦品种之间SOD、POD、PPO活性差异显著(p<0.05)。[结论]3个小麦品种 SOD、POD、PPO活性变化的差异,基本反映了其田间抗蚜性的差异水平。
禾谷缢管蚜; 小麦幼苗; 保护酶; SOD; PPO; POD
植食性昆虫与植物协同进化的结果是植食性昆虫有其特定的取食范围,植物对昆虫具有防御能力,两者存在相互适应的现象。植物为抵抗昆虫的为害,在长期进化过程中形成了不选择性、抗生性和耐害性三种防御机制,其中起主导作用的是植物的抗生性[1-3]。近年来,已有许多研究工作证实害虫的胁迫能引起植物的生理应激反应[4-7],产生对昆虫有防御效应的次生代谢物质[8-12],同时,还可引起植物防御酶活力的变化[13-15]。目前大量的对植物保护酶活性变化的研究多集中在苜蓿[16-17]、黄瓜[18-19]、水稻[20]等作物,并且研究结果表明超氧化物歧化酶(SOD)、过氧化物酶(POD)以及多酚氧化酶(PPO)在植物的抗性过程中起着重要作用,然而当前对昆虫取食引起小麦保护酶变化的研究还比较少。
禾谷缢管蚜[Rhopalosiphum padi(L.)]是小麦苗期生产中的重要害虫之一,对小麦产量和品质以及粮食安全造成重大威胁。传统的小麦蚜虫防治方法是施用杀虫剂,但化学农药容易引起 “3R问题”不能作为解决小麦蚜虫危害的长久之计。因此,利用作物抗虫性防治害虫是理想方法,而优异的抗性资源是进行作物抗虫育种的基础。田间抗蚜性研究表明,小麦品种间对蚜虫的抗性存在显著差异[21],‘XM800’、‘Selkirk Yr27’和‘兰天 24 号’3个品种(品系)田间抗蚜性鉴定结果分别表现为高抗(HR)、中抗(MR)和高感(HS)。本试验在田间抗性鉴定的基础上,探讨了3个不同抗蚜小麦品种(品系)在禾谷缢管蚜为害后植株内超氧化物歧化酶(SOD)、过氧化物酶(POD)和多酚氧化酶(PPO)活性的差异,为小麦抗虫育种以及禾谷缢管蚜的持续控制提供理论依据。
1 材料与方法
1.1 试验处理
试验所用小麦‘XM800’、‘Selkirk Yr27’和‘兰天24号’田间表现分别为高抗、中抗和高感类型,种子由甘肃省农业科学院植物保护研究所提供,试验所用蚜虫是禾谷缢管蚜。将种子用浓度1%的双氧水浸种[22],在20℃恒温培养箱内处理24 h后播种于塑料杯中育苗,于室内阳光充足的地方培养(室温24±1℃)10 d后,选取长势相近的小麦接虫20头/株,以不接虫为对照。接虫后1、3、5 d分别剪取未接虫和接虫植株以备测定。试验重复3次。
1.2 酶活力测定
超氧化物歧化酶(SOD)酶液提取和测定参照张宪政的方法[23],以单位时间内抑制光化还原50%的氯化硝基四氮唑蓝(NBT)为一个酶活性单位(U)。过氧化物酶(POD)活性测定,采用愈创木酚法[24],将磷酸缓冲液、0.05 mol/L愈创木酚和2%H2O2按照2.9∶1∶1 的比例混合,在 37 ℃条件下保温,加入0.1 mL酶液,立即于37℃中保温15 min,然后迅速转入冰浴中,并加入2.0 mL质量分数为20%的三氯乙酸终止反应,摇匀后在470 nm比色。酶活性用每克鲜重叶片1 min内A470变化0.01为一个过氧化物酶活性单位。多酚氧化酶(PPO)酶液提取和测定采用薛应龙的方法[25],酶活性用每克鲜重叶片1 min内A495变化0.01为一个过氧化物酶活性单位。
1.3 数据处理
以上各试验处理所测得的试验数据,在Excel和SPSS16.0分析统计软件中利用Duncan新复极差法进行差异显著性检验。
2 结果与分析
2.1 小麦不同品种SOD活性的差异
由图 1可知,在接禾谷缢管蚜前,高抗品种‘XM800’的SOD活性最高,高感品种‘兰天24号’最低,中抗品种‘Selkirk Yr27’居中,方差分析表明3个小麦品种间SOD活性存在极显著差异(p<0.01)。接蚜后随刺吸胁迫时间的延长,3个小麦品种叶组织内SOD活性都呈上升趋势,但各品种的SOD活性仍然存在极显著差异(p<0.01)。品种抗性越强,接蚜后SOD活性增长越快。接蚜后第 1天,高抗品种SOD活性比对照增加17.02%,中抗品种增加9.98%,而高感品种仅增加5.15%;接蚜后第5天,高抗品种SOD活性比对照增加35.72%,中抗品种增加33.13%,高感品种增加27.71%。由表1可以看出,禾谷缢管蚜为害后3个小麦品种幼苗叶片SOD活性的变化量存在极显著差异(p<0.01),品种抗性越高,SOD活性比同期对照的变化量越大。

表1 禾谷缢管蚜为害后3个小麦品种幼苗叶片SOD活性的变化量1) U◦g-1

图1 禾谷缢管蚜为害后3个小麦品种幼苗叶片的SOD活性
2.2 小麦不同品种POD活性的差异
方差分析表明,在接禾谷缢管蚜前3个小麦品种间POD活性差异极显著(p<0.01)。由图2可以看出,接蚜后各小麦品种POD的活性都比接蚜前显著提高,在接蚜后1~5 d内,随着刺吸胁迫时间的延长,3个小麦品种叶组织内POD活性都呈上升趋势;接蚜后第3天和第5天,POD活性显著增强,而且高抗品种POD活性迅速增加,而高感品种POD活性增加缓慢。接蚜后第1天,高抗品种POD活性比同期对照增加19.85%,中抗品种增加3.05%,而高感品种仅增加1.43%;接蚜后第5天,高抗品种POD活性比同期对照增加75.21%,中抗品种增加70.87%,而高感品种仅为27.93%。禾谷缢管蚜为害后3个小麦品种幼苗叶片POD活性的变化量存在极显著差异(p<0.01,表2)。
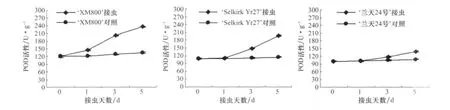
图2 禾谷缢管蚜为害后3个小麦品种幼苗叶片的POD活性
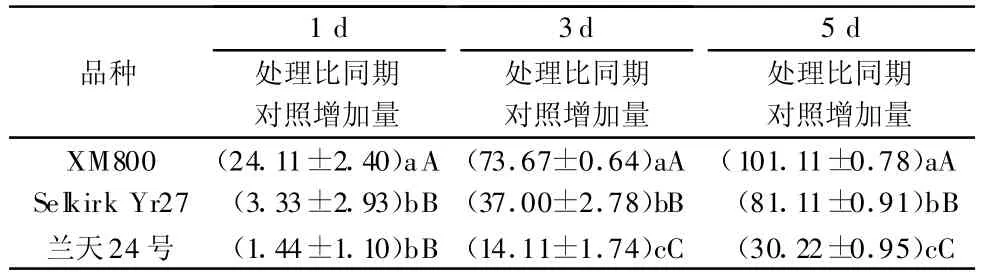
表2 禾谷缢管蚜为害后3个小麦品种幼苗叶片POD活性的变化量1) U◦g-1
2.3 小麦不同品种PPO活性的差异
由图3可知,接蚜前3个小麦品种PPO活性高抗品种‘XM800’最高,中抗品种‘Selkirk Yr27’次之,高感品种‘兰天24号’最低。接蚜后,处理组的PPO活性增加明显比对照组快,但不同抗性品种的增长率存在差异。接蚜后第1天,高抗品种PPO活性比同期对照增加16.4%,中抗品种增加5.11%,高感品种增加6.39%,高抗品种PPO活性增长率明显高于中抗品种和高感品种;第5天,高抗品种PPO活性比同期对照增加51.38%,中抗品种增加25.53%,而高感品种仅增加17.56%。禾谷缢管蚜为害后第1天和第3天,高抗品种‘XM800’的PPO活性变化量与中抗品种‘Selkirk Yr27’和高感品种‘兰天24号’存在极显著差异(p<0.01),而中抗品种‘Selkirk Yr27’和高感品种‘兰天24号’之间无显著差异;禾谷缢管蚜为害后第5天,3个品种间PPO活性变化量均存在极显著差异(p<0.01,表3)。
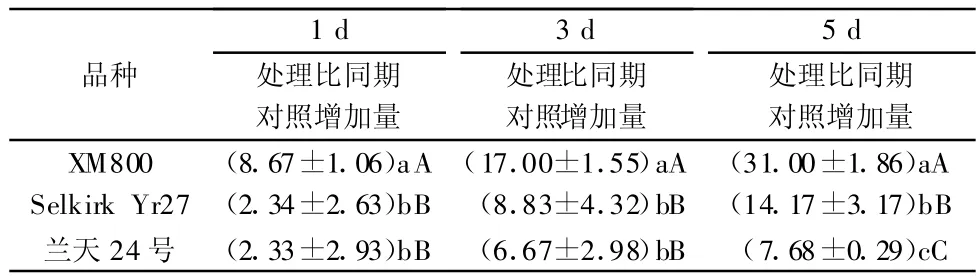
表3 禾谷缢管蚜为害后3个小麦品种幼苗叶片PPO活性的变化量1) U◦g-1

图3 禾谷缢管蚜为害后3个小麦品种幼苗叶片的PPO活性
3 讨论
一般情况下,细胞内的活性氧与保护酶系统之间保持着平衡[26]。逆境下可使植物体内正常氧代谢受干扰,导致植物体内氧自由基含量增加和积累,诱发或加速膜脂过氧化作用链式反应从而导致膜系统受损,引起细胞膜透性的增加及电解质的渗漏,最终导致细胞死亡和组织受到破坏,而超氧化物歧化酶(SOD)、过氧化物酶(POD)和多酚氧化酶(PPO)是植物对膜脂过氧化的酶促防御系统中重要的保护酶。SOD在细胞保护酶系统中的作用是清除超氧自由基,同时产生歧化性产物H2O2。POD在保护酶系统中主要是起到酶促降解H2O2的作用,从而使植物抵抗在逆境胁迫下代谢过程产生的有害物质对细胞的伤害,表现出一定的抗逆性[28]。有研究表明,POD、PPO与细胞壁合成有关,有利于刺吸式口器害虫为害后造成的细胞壁损伤的修复和未损伤的细胞壁进一步加厚,以防进一步刺吸为害;同时POD、PPO活性的升高使木质素的合成加快,进而促进植物体内抗蚜次生物质酚类化合物的合成,而PPO可把酚类物质氧化为毒性更强的醌,以提高抗性[14,17,28]。
本试验研究表明,在禾谷缢管蚜胁迫初期随着刺吸胁迫时间的延长,3个小麦品种幼苗叶片中SOD、POD、PPO活性都呈上升趋势。而且3个不同抗性的品种之间3种保护酶的上升幅度和变化量存在显著差异,高抗品种‘XM800’上升幅度最大,表明植株体抗性最强,即防御机制最强。3个小麦品种SOD、POD、PPO活性变化的差异,基本反映了其田间抗蚜性的差异水平,表明小麦的抗蚜性与保护酶的活性有关。SOD、POD及PPO活性的高低能否被用来作为小麦抗蚜育种中筛选抗性材料的生化指标还有待进一步研究。
[1]周明牂.作物抗虫性原理及应用[M].北京:北京农业大学出版社,1992.
[2]朱麟,古德祥.植物抗虫性概念的当代内涵[J].昆虫知识,1999,36(6):355-360.
[3]朱俊洪,程立生.植物次生性物质与植物抗虫性的关系及其在害虫防治中的应用前景[J].华南热带农业大学学报,2007,7(1):26-32.
[4]Woodhead S,Bernays E.Changes in release rates of cyanide in relation to palatability ofSorghumto insects[J].Nature,1977,270:235-236.
[5]朱麟,杨振德,赵博光,等.植食性昆虫诱导的植物抗性最新研究进展[J].林业科学,2005,41(1):165-173.
[6]Bryant J P,Reicherdt P B.Effects of mineral nutrition on delayed inducible resistance in Alaska paper birch[J].Ecology,1993,74(7):2072-2084.
[7]Hunter M D,Schultz J C.Fertilization mitigates chemical induction and herbivore responses within damaged oak trees[J].Ecology,1995,76(4):1226-1232.
[8]张瑛,严福顺.虫害诱导的植物挥发性次生物质及其在植物防御中的作用[J].昆虫学报,1998,41(2):204-214.
[9]李庆,杨群芳.氧肟酸在植物抗虫性中的作用[J].四川农业大学学报,2000,18(4):374-376.
[10]Leszcynksi B,Wright L C,Bakowski T.Effect of second arg plant substances on winter wheat resistance to grain aphid[J].Exp Appl,1989,52:135-139.
[11]刘保川,陈巨莲,倪汉样,等.小麦中黄酮类化合物对麦长管蚜生长发育的影响[J].植物保护学报,2003,30(1):8-12.
[12]李庆,叶华智,杨群芳,等.若干生化指标与山羊草对禾谷缢管蚜抗性的关系[J].中国农业科学,2003,36(9):1038-1043.
[13]康乐.植物对昆虫的化学防御[J].植物学通报,1995,12(4):22-27.
[14]秦秋菊,高希武.昆虫取食诱导的植物防御反应[J].昆虫学报,2005,48(1):125-134.
[15]谢春艳,宾金华,陈兆平,等.多酚氧化酶及其生理功能[J].生物学通报,1999,34(6):11-13.
[16]袁庆华,桂枝,张文淑.苜蓿抗感褐斑病品种内超氧化物歧化酶、过氧化物酶和多酚氧化酶活性的比较[J].草业学报,2002,11(2):100-104.
[17]刘长仲,兰金娜.苜蓿斑蚜对三个苜蓿品种幼苗氧化酶的影响[J].草地学报,2009,17(1):32-35.
[18]李保聚,李凤云.黄瓜不同抗性品种感染黑星病菌后过氧化物酶和多酚氧化酶的变化[J].中国农业科学,1998,31(1):86-88.
[19]吴凤芝,黄彩红,赵凤艳.酚酸类物质对黄瓜幼苗生长及保护酶活性的影响[J].中国农业科学,2002,35(7):821-825.
[20]张金锋,薛庆中.稻飞虱为害胁迫对水稻植株内主要保护酶活性的影响[J].中国农业科学,2004,37(10):1487-1491.
[21]李凤珍,吉万全,吴金华.小麦抗蚜研究新进展[J].西北农林科技大学学报(自然科学版),2004,32(增刊):73-77.
[22]李霞.休眠期小麦种发芽试验[J].种子世界,2000(8):31.
[23]张宪政.作物生理研究法[M].北京:农业出版社,1992.
[24]哈尔滨工业大学.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:46-49.
[25]薛应龙.植物生理实验手册[M].上海:上海科学技术出版社,1985:138-139.
[26]Prasad T K.Mechanism of chilling-induced oxidative stress injury and tolerances in developing maize seedlings:changes in antioxidant system,oxidation of proteins and lipids and protease activities[J].Plant J,1996,10(6):1017-1026.
[27]Cao X Q.The effect of membrane-lipid proxidation on cell and body[J].Prog Biochem Biophy s,1986(2):17-23.
[28]Havlickova H,Cvikrova M,Eder J.Changes in the pattern of phenolic acids induced by aphid infestation in two winter wheat cultivars[J].Bulletin OILB-SROP,1996,19(5):106-110.
Influences of Rhopalosiphum padi on oxidases of three wheat seedlings
Zhang Tingwei, Liu Changzhong
(Key Laboratory of Grassland Ecosystem,Ministry of Education,College of Grassland Sciences,Gansu Agricultural University,Lanzhou730070,China)
[Objective]It is necessary to study the relationships between aphid stress and oxidases in different wheat varieties for breeding of resistant wheat varieties and sustainable control of aphids.[Method]The changes in the activity of SOD,POD and PPO were studied in seedling leaves of three wheat varieties,namely ‘XM800’(high resistance),‘Selkirk Yr27’(moderate resistance)and ‘Lantian NO.24’(highly susceptible),infested byRhopalosiphum padiL.through artificial inoculation in the laboratory.[Result]The activities of SOD,POD and PPO in seedling leaves of the three wheat varieties increased significantly along with the increase of days after inoculation,and the stronger the resistance of varieties,the more significant the increase of the enzyme activity.the activities of SOD,POD and PPO were significantly different among the three wheat varieties(p<0.05).[Conclusion]The differences in activities of the protective enzymes in the three different aphid resistant wheat varieties were consistent with their resistant performances in the fields.
Rhopalosiphum padi; wheat seedling; oxidase; SOD; PPO; POD
S 435.122.2
A
10.3969/j.issn.0529-1542.2011.04.015
2010-05-24
2010-07-09
“十一五”国家科技支撑计划项目(2006BAD08A05)
*通信作者E-mail:liuchzh@gsau.edu.cn

