植物青枯菌Ⅵ型分泌系统核心基因vasK突变株的构建及其致病性的测定
张丽勍, 许景升, 徐 进, 冯 洁
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
植物青枯菌Ⅵ型分泌系统核心基因vasK突变株的构建及其致病性的测定
张丽勍, 许景升, 徐 进, 冯 洁*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
[目的]通过测试vasK基因突变株对番茄的致病力变化,评价该基因在青枯菌致病过程中的作用。[方法]根据青枯菌(Ralstonia solanacearum)中存在的Ⅵ型分泌系统基因簇中的核心基因vasK序列设计PCR引物,扩增并克隆vasK基因,将庆大霉素抗性基因(Gm)插入vasK基因内部,克隆至自杀质粒pK18mobsacB中,获得重组自杀质粒pK18-vasK-Gm。将自杀质粒电转化至青枯菌GMI1000感受态细胞中,采用同源重组双交换法,将野生型vasK基因置换。对vasK基因突变菌株进行三步筛选和PCR扩增鉴定。[结果]筛选获得了具有庆大霉素抗性的目标基因被抗性基因替换的青枯菌突变株(GMI1000-m)。土壤接种番茄青枯菌结果显示,突变株GMI1000-m的致病性较野生型GMI1000明显下降。[结论]vasK基因在青枯菌致病过程中具有重要作用。
青枯菌;Ⅵ型分泌系统;vasK基因
病原细菌通常利用蛋白的分泌来介导与寄主植物的相互作用[1]。革兰氏阴性病原细菌能够通过微小的装置将蛋白运送到胞外,或直接运输到寄主细胞中。这些微小的装置称为分泌系统。目前为止,发现在革兰氏阴性病原菌中至少存在着6种不同类型的分泌系统(Ⅰ~Ⅵ型分泌系统),这些分泌系统通过分泌或注射的方式释放胞外蛋白或效应子,以刺激或干扰寄主细胞的进程,从而能够调控一系列的病原细菌—寄主细胞的相互作用。Ⅵ型分泌系统是新近发现的一种细菌蛋白分泌系统。具有Ⅵ型分泌系统的一些革兰氏阴性病原菌对人类的健康构成了威胁:Vibrio cholerae,Yersinia pestis,Francisella tularensis,Burkholderia mallei,Salmonella ty phimurium,致病的Escherichia coli及条件性病原微生物如Pseudomonas aeruginosa,Burkholderia cenocepacia,Aeromonas hydrophila[2-5]。Ⅵ型分泌系统在细菌基因组中以基因簇形式存在,该基因簇通常编码12~25个蛋白。核心组分包括IcmF类蛋白、IcmH 类蛋白(DotU)、AAA+ATP酶ClpV、未知脂蛋白以及泌出蛋白VgrG和Hcp。根据T6SS蛋白位于细菌细胞的不同部位可以将T6SS蛋白分为穿刺装置、外膜蛋白、跨膜蛋白和内膜蛋白。
其中,VasF和VasK含有跨膜结构域和螺旋-螺旋(coiled-coil)结构,属于IcmH和IcmF类蛋白。IcmH和IcmF可以有助于细菌在寄主细胞膜形成蛋白转运孔,帮助细菌泌出毒性因子。因此作为细菌细胞周质蛋白的VasF和VasK在蛋白泌出中具有重要作用。VasK除了参与蛋白泌出外,还可能具有识别效应子蛋白和信号转导的功能,因为VasK还拥有G-蛋白家族的P-loop结构域,该结构域具有核酸磷酸化水解酶的功能[6]。
经分析发现在青枯菌GMI 1000菌株大质粒中也存在Ⅵ型分泌系统基因簇,同源性达到80%。本试验采用自杀性质粒载体与染色体进行基因同源交换技术,构建了青枯菌Ⅵ型分泌系统核心基因vasK的定位突变,通过测试vasK基因突变株对番茄的致病力变化,评价了该基因在青枯菌致病过程中的作用。
1 材料和方法
1.1 菌株和质粒
试验中使用的菌株和质粒见表1。青枯菌GMI1000生长在NA平板或液体培养基中,28℃条件下培养。大肠杆菌生长在LB平板或液体培养基中,37℃条件下培养。10%蔗糖NA培养基为NA培养基加入相应体积的蔗糖储存液(50%蔗糖,115℃灭菌20 min)至终浓度为10%。抗生素使用浓度分别为:氨苄青霉素(Ap)100 μ g/mL,卡那霉素(Kan)20 μ g/mL,庆大霉素(Gm)10 μ g/mL 。
1.2 主要试剂
普通Taq酶、dNTP 、SalI、PstI、T4 DNA Ligase购自大连宝生物(TaKaRa)公司,2×TaqPlatinum PCR MasterMix 、DL2000 、500 bp DNA ladder购自天根公司,琼脂糖凝胶回收试剂盒购自北京百泰克公司,氨苄青霉素(Amp)、卡那霉素(Kan)、庆大霉素(Gm)、IPTG 、X-gal购自Sigma公司,蔗糖为上海生工公司产品,dATP、pMD19-T载体购自大连宝生物(TaKaRa)公司,引物为上海生工公司合成。
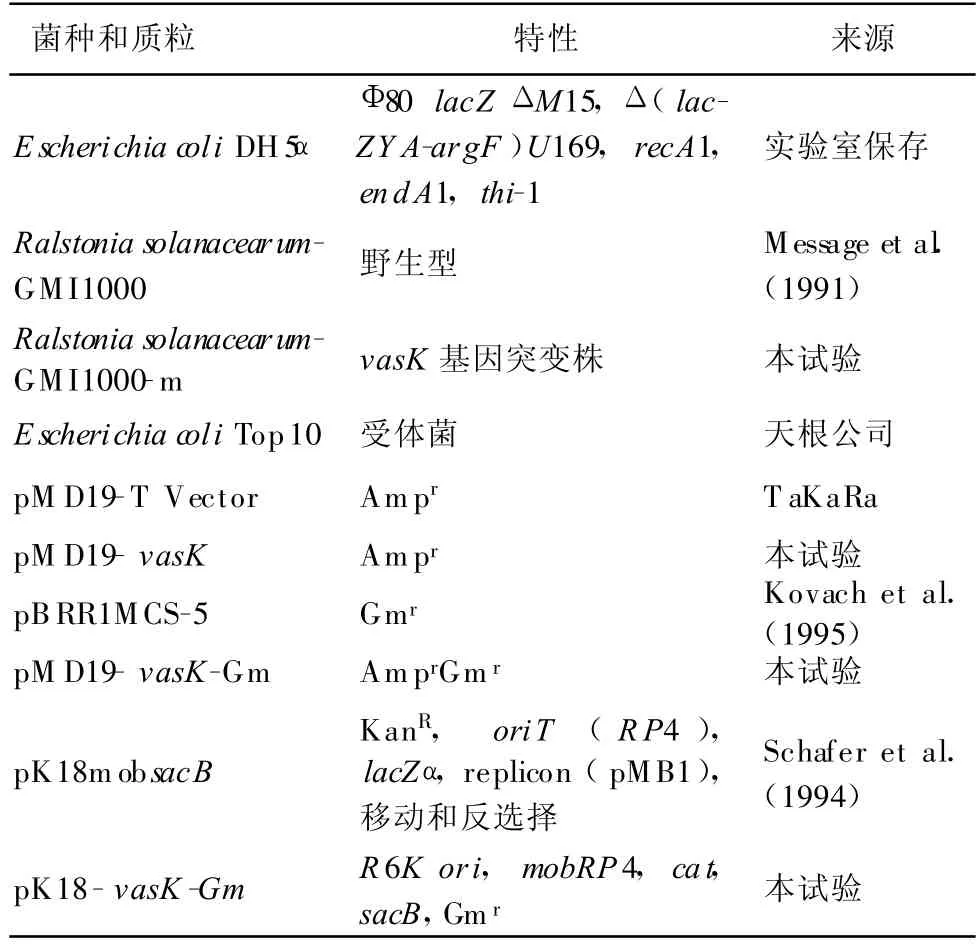
表1 菌种和质粒
1.3 vasK1-1455基因片段PCR扩增
根据vasK核苷酸序列设计引物,扩增vasK部分DNA片段,用于构建重组自杀质粒。上游引物从vasK起始密码子的第1 bp开始,下游引物至第1 455 bp,共1 455 bp,其中在第429 bp和1 112 bp处存在PstI酶切位点,在1 444 bp处存在SalI酶切位点。部分vasK基因上下游引物序列分别为,vasK1:5′-T TCATCACCT TCTCTACACTT-3′;vasK2:5′-TACATATCACATCAAATTCCTCAACTTCC-3′。采用PCR扩增,扩增条件:94℃,3 min;35个循环包括:94℃,30 s;60℃,30 s;72℃,1.5 min;1个循环:72℃,10 min。
1.4 庆大霉素基因的PCR扩增
根据质粒载体pBBR1MCS-5(GenBank登录号:U25061)中庆大霉素抗性基因的序列,设计引物扩增庆大霉素基因,作为重组突变体筛选标记基因。上下游引物序列分别为:5′-ATAATGCAT GGACGCACAC-CGTGGAAA-3′、5′-ATAATGCAT GGCGGCGTTGTGACAATTT-3′,下划线部分为NsiI的酶切位点。采用降落PCR扩增条件:95℃5 min;30个循环:95℃1 min;70℃1 min(每个循环降低0.7℃);72℃1 min;10个循环:95℃1 min;55℃1 min;72℃1 min;72℃10 min。
1.5 vasK基因重组自杀质粒pK18-vasK-Gm的构建及鉴定
PCR产物的回收、连接、转化、质粒提取及酶切参照文献指南[9]或按照试剂盒说明书推荐的条件进行,构建过程见图1。

图1 重组质粒pMD19-vasK-Gm的构建
1.6 青枯菌GMI 1000感受态细胞的制备及电转化
青枯菌感受态细胞的制备及电转化参照Ausubel等[11]和Lavie等[12]的方法并略有改动。于28℃,用NA培养液摇瓶培养青枯菌40 h,将菌液冰浴冷却10~15 min,然后转移到预冷的1.5 mL的Eppendorf管中。于4℃,5 000 r/min离心5 min,弃上清,沉淀用1 mL的ddH2O悬浮,离心,收集菌体,再重复一次。用1 mL的10%的甘油悬浮菌体,于4℃,5 000 r/min离心5 min,弃上清,沉淀用100 μ L 10%的甘油悬浮,加入1 μ g pK18-vasK-Gm质粒DNA混合物全部转移至电极杯(0.2 cm gap electroporation cuvette,BioRad)中,将电极杯放在Gene Pulser(BioRad)电转,参数为:2.5 kV,25 μ F,200 Ω[13]。
1.7 vasK基因突变菌株的筛选与鉴定
电转结束后立即加入1 mL NA液体培养基,转移至新的离心管中,28℃振荡复苏24 h,然后依次进行如下3次筛选。(1)初筛:将转化后的菌液涂布于含卡那霉素和庆大霉素的NA固体培养基平板上,28℃培养24~48 h,至单个菌落形成,提取基因组DNA,用vasK1/vasK2引物扩增鉴定。(2)复筛:挑取上步的单菌落接种于NA液体培养基中,培养过夜后梯度稀释并涂布于含有10%蔗糖和庆大霉素的NA固体平板上,28℃培养24~48 h,至单个菌落形成,筛选双重组子。(3)第3次筛选:挑取上步的单菌落分别转移至含有庆大霉素、卡那霉素和10%蔗糖平板上进行筛选。最终,筛选出对卡那霉素(Kans)和蔗糖(Sucs)敏感对庆大霉素具有抗性(Gmr)的菌落提取基因组,用vasK1/vasK2引物扩增鉴定[13]。
1.8 突变菌株和野生型菌株致病性的测定
参照He等[14]伤根浇注菌液接种法(土壤接种法)进行青枯菌接种试验。选用番茄感病品种种子播种于灭菌蛭石中育苗,待幼苗生长至3~4片真叶时选取植株大小和根系发育均匀一致的幼苗,移栽于直径15 cm装有混合土(1∶1的普通田园壤土和草炭土)的营养钵中,每钵3株。待番茄植株幼苗生到7~8叶期,采用伤根浇注菌液接种法进行青枯菌接种试验。在植株距茎1 cm处用手术刀向下划深3~4 mm,长4 cm的口子,每株番茄苗浇30 mL浓度为3×106cfu/mL的菌悬液,每处理10株,3个重复。青枯病的病情调查参照Denny[15]等的方法。
2 结果与分析
2.1 vasK基因片段的克隆
vasK基因全长为3 942 bp,本试验选择克隆了结构基因的760 bp作为靶序列用于同源重组。将纯化后的部分vasK基因的PCR扩增产物克隆入
pMD19-T载体,命名为pMD19-vasK。经SalI酶切和测序鉴定,与预期完全一致(图2)。
2.2 庆大霉素基因的克隆及重组质粒pMD19-vasK-Gm的构建及鉴定
庆大霉素基因Gm,长度为855 bp。将纯化后的庆大霉素基因PCR扩增产物经过NsiI酶切克隆至pMD19-vasK载体的vasK基因片段的
PstI酶切位点。将Gm基因插入到vasK基因的内部,一则将vasK基因突变使其失活,再则为以后筛选突变株提供抗生素标记。经含氨苄青霉素和庆大霉素的 LB平板进行筛选,获得重组质粒pMD19-vasK-Gm,经酶切鉴定与预期片段大小一致。
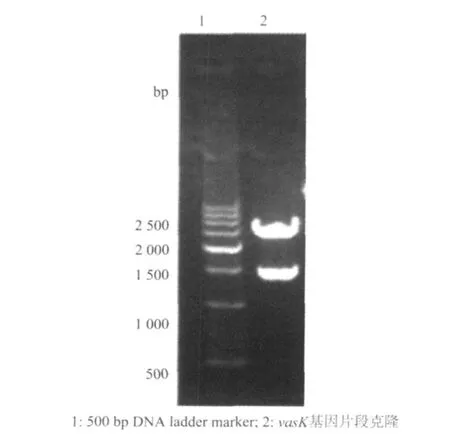
图2 重组质粒pMD19-vasK的酶切鉴定图
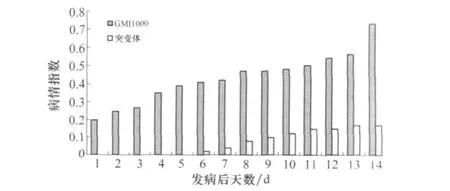
图3 vasK基因突变株致病力的测定
2.3 自杀质粒pK18-vasK-Gm的构建及鉴定
重组质粒pMD19-vasK-Gm经SalI酶切后,琼脂糖凝胶电泳分离1 396 bp的vasK-Gm片段,并亚克隆至经同样酶切的pK18mobsacB质粒载体中,构建pK18-vasK-Gm自杀性质粒载体,转化至E.coliDH5α菌株。在含卡那霉素和庆大霉素的LB平板上筛选克隆菌,获得了重组质粒pK18-vasK-Gm,经酶切鉴定与预期片段大小一致,序列测定结果表明,该重组子为内部含有庆大霉素基因的vasK基因的重组质粒。
2.4 vasK基因敲除菌株的筛选与鉴定
采用电击转化方法将质粒pK18-vasK-Gm转化至野生菌株中,通过三步筛选法获得了突变株。最后对Gmr、Sucs、Kans的菌株进行PCR扩增,筛选获得了突变株GMI1000-m,野生型菌株GMI1000的vasK基因已被突变了的vasK基因所置换。本试验最初选择了vasK基因的760 bp作为靶序列用于同源重组,基因本身含有PstI酶切位点,在与庆大霉素基因Gm连接的过程中,会损失219 bp的片段,庆大霉素基因Gm长855 bp,将纯化后的庆大霉素基因 PCR扩增产物经过NsiI酶切克隆至pMD19-vasK载体的vasK基因片段的PstI酶切位点,vasK-Gm片段长1 396 bp。
2.5 敲除菌株和野生型菌株致病性的测定
野生型菌株接种7 d开始发病,突变株在野生型发病后第6天才出现症状。野生型发病后12 d,当野生型菌株病情指数达到0.56时,突变株的仅为0.17,表明vasK基因与青枯菌的致病力密切相关(图3)。
3 结论与讨论
2006年,科学家报道了在Vibrio cholerae和Pseudomonasaeruginosa中存在一种新型的分泌系统,并将其命名为Ⅵ型分泌系统[1,17]。在Ⅵ型分泌系统中通常存在一个基因簇。该基因簇通常编码12~25个蛋白,只有DotU和IcmF样的蛋白在其他分泌系统中也存在(T4SS)[18]。植物细菌性青枯病是由茄劳尔氏菌(Ralstonia solanacearum)引起的一种世界性分布的重大病害。2002年法国科学家Salanoubat等[19]在 Nature上报道了青枯细菌(GMI 1 000菌株,1号小种)的全基因组序列。
Ⅵ型分泌系统的作用机制表明,辅助蛋白VasK(IcmF蛋白家族)引起细菌细胞表面的重组,导致了对寄主细胞黏附度的增加。VasK同时帮助运输和信号识别作用,因此可以增加运输的效率。
本试验围绕青枯菌的Ⅵ型分泌系统与致病性的关系开展了研究,通过基因敲除的方法破坏了青枯菌T6SS基因簇中的vasK基因,发现突变菌株的致病力明显降低,初步证实了vasK基因在青枯菌的致病过程中可能起到了重要作用。研究初步证实了vasK基因与青枯菌致病力可能相关。在致病力测定的基础上,需要进一步分析vasK基因突变对青枯菌泌出蛋白的影响,以期揭示Ⅵ型分泌系统在青枯菌致病过程中的作用。
由于Ⅵ型分泌系统的研究主要集中在人类和动物病原细菌,而对植物病原细菌T6SS的研究仅有两例报道。因此对植物青枯菌Ⅵ型分泌系统的研究,对探究T6SS致病机理具有非常重要的意义。
[1]Mougous J D,Cuff M E,Raunser S,et al.A virulence locus ofPseudomonasaeruginosaencodes a protein secretion apparatus[J].Science,2006,312:1526-1530.
[2]Das S,Chaudhuri K.Identification of a unique IA HP(IcmF associated homologous proteins)cluster inVibrio choleraand other proteobacteria throughin silicoanalysis[J].In Silico Biology,2003,3:287-300.
[3]Schell M A,Ulrich R L,Ribot W J,et al.Type VI secretion is a major virulence determinant inBurkholderia mallei[J].Molecular Microbiology,2007,64:1466-1485.
[4]Shalom G,Shaw J,Thomas M.Invivoexpression technology identifies a type VI secretion system locus inBurkholderia pseudomalleithat is induced upon invasion of macrophages[J].Microbiology,2007,153:2689-2699.
[5]Yen Y T,Bhattacharya M,Stathopoulos C.Genome-widein silicomapping of the secretome in pathogenicYersinia pestisKIM[J].FEMS Microbiol Lett,2008,279:56-63.
[6]Hamilton H L,Dominguez N M,Schwartz K J,et al.Neisseria gonorrhoeaesecretes chromosomal DNA via a novel type IV secretion sy stem[J].MolecularMicrobiology,2005,55:1704-1721.
[7]Message B,Boistard P,Pitrat M,et al.A new class of fluidal avirulent mutants ofPseudomonas solanacearumunable to induce a hypersensitive reaction[C].Proceeding s of the 4th International Conference on Plant Pathogenic Bacteria,1N RA,Angers,France,1978:823-833.
[8]Kovach M E,Elzer P H,Hill D S,et al.Four new derivatives of the broad host range cloning vector pBBR1M CS,carrying different antibiotic—resistance cassettes[J].Gene,1995,166(1):175-176.
[9]Schafer A A,Tauch W J,Kalinowsski G,et al.Small mobilizable multi-purpose cloning vectors derived fromEscherichia coliplasmids pK18 and pK19:selection of defined deletions in the chromosome ofCorynrbacterium glutamicum[J].Gene,1994,145:69-73.
[10]Sambrook J,Russell D W.Molecular cloning:A laboratory manual[M].3rd ed.Cold Spring Harbor Laborato ry Press,2002.
[11]Ausubel F M,Brent R,Kingston R E,et al.Sho rt protocols in molecular biology[M].3rd ed.John Wiley and Sons,Chichester,1998.
[12]Lavie M,Shillington E,Eguiluz C,et al.PopP 1,a new member of the YopJ/Av rRxv family of typeⅢeffector proteins,acts as a host specificity factor and modulates aggressiveness ofRalstonia solanacearum[J].M olecular Plant Microbe Interactions,2002,15(10):1058-1068.
[13]张争,何礼远,冯洁,等.植物青枯菌aac基因突变株的构建及其致病性的测定[J].农业生物技术学报,2009,17(3):522-528.
[14]He L Y,Sequeira L,Kelman A.Characteristics of strains ofPseudomonas solanacearumfrom China[J].Plant Disease,1983,67(12):1357-1361.
[15]Denny T P,Carney B F,Schell M A.Inactivation of multiple virulence genes reduces the ability ofPseudomonas solanacearumto cause wilt symptoms[J].Molecular Plant Microbiology Interaction,1990,3(5):293-300.
[16]吴乃虎.基因工程原理[M].北京:科学出版社,2001.
[17]Pukatzki S,Ma A T,Sturtevant D,et al.Identification of a conserved bacterial protein secretion system inVibrio choleraeusing theDictyosteliumhost model sy stem[J].Proceeding s of the National Academy of Sciences of the United States of America,2006,103:1528-33.
[18]Alain Filloux,Abderrahman Hachani,Sophie Bleves.The bacterial type VI secretion machine:yet another player fo r protein transport across membranes[J].Microbiology,2008,154:1570-1583.
[19]Salanoubat M,Genin S,Artiguenave F,et al.Genome sequence of the plant pathogenRalstonia solanacearum[J].Nature,2002,415(6871):497-502.
Construction and pathogenicity tests of the mutated strain of the core gene vasK of typeⅥsecretion system in Ralstonia solanacearum
Zhang Liqing, Xu Jingsheng, Xu Jin, Feng Jie
(State Key Laboratory for Biology of Plant Disease and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing100193,China)
[Objective]The change in pathogenicity of thevasKmutant to the tomato was investigated to estimate the function of thevasKgene in the pathogenicity process ofRalstonia solanacearum.[Method]According to the sequence ofvasKgene,a key component of typeⅥ secretion system inRalstonia solanacearum,PCR primers were designed to amplifyvasKgene.vasKgene was mutated by inserting a gentamicin◦3-acetyltransferase gene(Gmgene),and the mutatedvasKwas inserted into suicide vector pK18mobsacB,resulting in pK18-vasK-Gm.The vector pK18-vasK-Gm was then introduced intoR.solanacearumGMI1000.ThevasKmutant,named GMI1000-m,was generated by homologous recombination and selected by a three-step method.GMI1000-m was identified by PCR amplification.[Result]The pathogenicity test of the mutant GMI1000-m was decreased compared with the wild type GMI1000.[Conclusion]ThevasKgene was an important factor in the pathogenesis ofR.solanacearum.
Ralstonia solanacearum; typeⅥsecretion system;vasKgene
Q 753
A
10.3969/j.issn.0529-1542.2011.04.007
2010-04-26
2010-10-15
国家重点基础研究发展计划(“973”)项目(2009CB119200);国家科技支撑计划项目(2006BAD08A14);国家高技术研究与发展计划(“863”)项目(2006AA10Z432)
*通信作者E-mail:jfeng@ippcaas.cn

