溶血磷脂酸通过ERK1/2通道诱导在体海马星形胶质细胞增殖
朱 扬, 张兆辉, 曾 伟, 高 延, 许泽武, 徐金梅
星形胶质细胞是脑组织中含量最多的一种细胞。近来研究发现正常生理条件下,星形胶质细胞对神经元起营养、支持和保护作用,而脑损伤可激发星形胶质细胞使其过度活化,释放大量细胞因子,损伤神经元,同时过度增殖的胶质细胞形成胶质瘢痕阻碍了损伤后的修复以及神经元轴突再生,并明显改变了局部正常结构及神经元的生存环境。溶血磷脂酸是一种新发现的细胞间磷脂类信号分子,是细胞存活、增殖及迁移的强有力的诱导因子。在急性缺血性心脑血管病、脑损伤时,血小板被凝血酶活化产生LPA并释放到血清中,致使血清LPA水平大幅度增高,进而促进血脑屏障开放,引起神经元凋亡、坏死等多种损伤[1,2],严重影响脑血管疾病的预后。而LPA受体主要在AST中表达,AST为LPA在脑内作用的主要靶细胞[3]。
因此,LPA与AST活化增殖的内在关系已开始引起部分学者的关注。近年大量离体实验研究发现LPA能诱导AST增殖,但目前国内外相关在体研究较少,而有关海马区域相关研究尚未见报道。
故本实验拟通过观察LPA对在体海马AST的影响,从在体水平证实LPA诱导海马AST增殖并探讨其可能的作用机制,为急性缺血性脑血管病、脑损伤的理论及治疗提供实验依据。
1 材料与方法
1.1 主要仪器与试剂 立体定向仪、微量注射器、光学显微镜及手术器械等,溶血磷脂酸(Sigma公司),U0126(Promega公司);小鼠来源磷酸化ERK1/2一抗、罗丹明标记羊抗小鼠IgG、FITC标记羊抗小鼠IgG、封闭用山羊血清(Santa Cruz公司);小鼠来源胶原纤维酸性蛋白一抗(Neo markers公司);封闭用小鼠血清(Boster公司);振荡切片机,德国Leica公司产品;TCSSP2 AOBSMP型激光共聚焦显微镜,德国Leica公司产品。
1.2 实验动物及分组 80只健康雄性SD大鼠,月龄2~3个月,体重200±25g,购于武汉大学医学院实验动物中心,并随机分空白对照组5只、实验对照组25只、LPA组25只、LPA+U0126组25只,其中实验对照组、LPA组和LPA+U0126组分别于注射 PBS、LPA、LPA+U0126 后1d、3d、5d、7d、14d后处死,每个时间点5只。空白对照组不注射药物,直接处死。
1.3 动物模型的制作 大鼠称重,20%乌拉坦5ml/kg腹腔注射麻醉,固定于立体定位仪上,取前囟右侧2.15mm,后3.00mm处用牙科钻钻孔,骨孔直径约1.0mm,自颅骨表面垂直进针3.00mm深;P组、L组、L+U组分别用缓慢注射推进器注射PBS5μl和50μmol LPA5μl以及 U0126和 LPA 混合液5μl(0.2μl/min),注射完毕后针头在脑内停留10min,缓慢退出。
1.4 切片制备 各组大鼠分别于术后不同时间点开胸,用4%多聚甲醛的磷酸缓冲液(PBS,pH=7.4)300ml进行心脏灌注,灌注完后取脑置于4%多聚甲醛中固定24h。冲洗脑组织,用振荡切片机在含海马区的脑组织连续冠状切片(FREE=5,FREQ=5),片厚50μm。
1.5 免疫荧光双标记染色 切片置于多聚赖氨酸包被的玻片上,加入封闭液1,置37℃湿盒中1h;滴加1∶300的小鼠GFAP单克隆抗体,置4℃冰箱中过夜;滴加1∶100Rodamin标记羊抗小鼠IgG荧光二抗,置37℃湿盒1h;加入封闭液2,置37℃湿盒中1h;滴加1∶100小鼠 p-ERK单克隆抗体,置4℃湿盒中过夜;滴加1∶100FITC标记羊抗小鼠IgG荧光二抗,置37℃湿盒中1h;甘油封固,加盖盖玻片。采用TCSSP2 AOBSMP型激光共聚焦显微镜检查。用单位面积平均荧光强度(Average FI)表示GFAP和p-ERK1/2表达水平。计算公式如下:Average FI=FI/area(μm2)×100000。
1.6 统计学处理 采用SPSS13.0统计软件,计量资料以均数±标准差±s)表示,各组间比较采用t检验分析,以P<0.05为差异有统计学意义。分析结果用Excel办公软件制成图表。
2 结果
2.1 各组GFAP荧光强度时程变化 空白对照组与实验对照组GFAP单位面积平均荧光强度(Average FI)相当,无显著差异(P>0.05);LPA注射后第3天,可见GFAP显著增加(约4倍于基础强度),此后随时间延长,GFAP荧光强度逐渐增加,至LPA注射后2w仍可见增加说明星形胶质细胞增殖时间至少持续2w。U0126与LPA混合液注射后,GFAP单位面积平均荧光强度轻度增加(约2倍于基础水平),与实验对照组无显著差异(P>0.05)(见表1)。
表1 不同时间大鼠海马区GFAP单位面积荧光强度(Average FI)值比较±s)
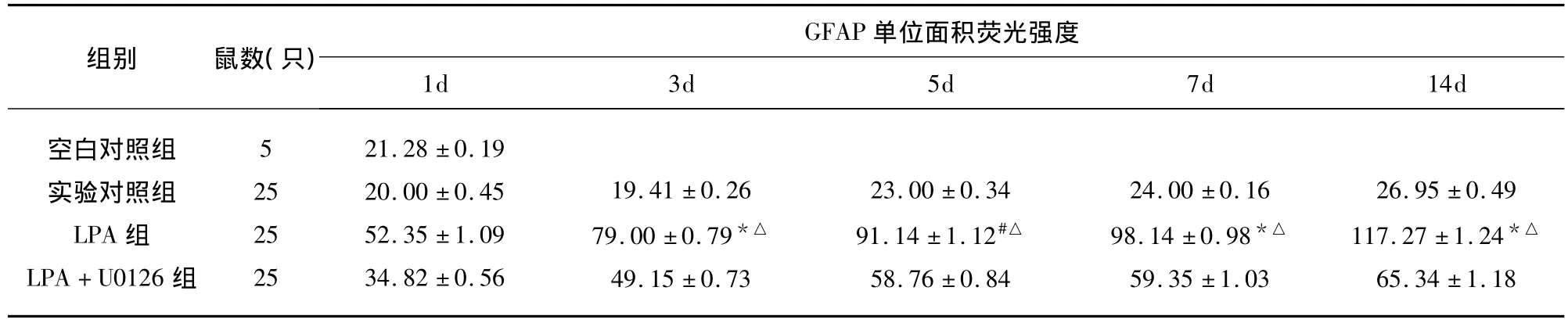
表1 不同时间大鼠海马区GFAP单位面积荧光强度(Average FI)值比较±s)
与实验对照组比较*P <0.05,#P <0.01;与 LPA+U0126组比较△P <0.05
GFAP组别 鼠数(只)单位面积荧光强度1d 3d 5d 7d 14d空白对照组实验对照组LPA组LPA+U0126组526.95 ±0.49117.27 ±1.24*△65.34 ±1.1825252521.28 ±0.1920.00 ±0.4552.35 ±1.0934.82 ±0.5619.41 ±0.2679.00 ±0.79*△49.15 ±0.7323.00 ±0.3491.14 ±1.12#△58.76 ±0.8424.00 ±0.1698.14 ±0.98*△59.35 ±1.03
2.2 各组p-ERK磷酸化荧光强度变化 LPA注射后第5天诱导显著的ERK 1/2磷酸化反应,第7d增加到最高水平,后出现轻度下降,基本与GFAP荧光强度平行增长(见图1),与实验对照组有显著差异(P<0.05)。LPA+U0126注射后各个时间点均未见明显的p-ERK1/2表达,但GFAP仍出现轻度的表达增加(见表1),提示U0126能完全阻断LPA诱导的ERK1/2磷酸化,但只部分抑制AST增殖(见图1)。
2.3 LPA诱导的p-ERK表达在脑组织中的定位 在双标检测中,早期在GFAP阳性细胞中LPA诱导的p-ERK1/2未见明显的表达,而在注射部位的神经元分布区有显著的表达(见图2A~C)。继续观察发现,注射后第14天在GFAP阳性细胞中有p-ERK1/2强烈的表达,且几乎全部在该细胞中表达(见图2D),提示LPA诱导的ERK1/2磷酸化早期主要在神经元和其他细胞中表达,后期主要在AST中表达。

图1 L组GFAP和p-ERK1/2荧光强度时程变化
3 讨论
LPA是上世纪60年代发现并开始研究的一种细胞膜脂类衍生物,为中枢神经系统损伤部位出现最早的信号分子之一,它作为一种脂质生长因子因其具有强烈的促增殖效应而引起人们的广泛关注。LPA具有促血小板聚集、平滑肌收缩、细胞增殖、增加紧密连接的通透性、促进细胞凋亡、坏死等多种生物学效应,在中枢系统损伤性疾病的发生、发展过程中发挥重要作用。
星形胶质细胞增生(Astrocyte proliferation)是许多中枢神经系统疾病发生发展过程中常见的病理改变。近年来研究发现星形胶质细胞增生进而形成胶质瘢痕在中枢神经系统损伤、变性性疾病以及癫痫中起着重要的作用[4]。而国内外大量研究证实LPA的一个重要功能就是其能诱导多片脑区AST细胞增殖[5,6],但关于 LPA 引起 AST 增殖的研究目前大多局限于细胞学水平,对于LPA诱导AST增殖的在体研究较少。Sorensen等[7]人的在体研究显示,LPA能诱导大鼠纹状体AST增殖。GFAP是特异性存在于AST中的中间丝,可用于标记损伤后胶质反应,其阳性表达提示星形胶质细胞的存在。本研究通过50μm LPA定位注射后发现大鼠海马区GFAP阳性细胞数目明显增多,随时间延长,GFAP阳性表达细胞数逐渐增加,至少持续2w仍在快速增加。此结果提示LPA可以诱导大鼠海马区AST增殖,这与细胞学研究结论相符,并首次在在体研究中证实之。但LPA作用途径十分复杂,其促AST增殖机制尚不完全明了。
我们认为在急性缺血性心脑血管病、脑出血、脑挫伤等疾病发生时出现血浆LPA大量增加,导致神经元多种损伤,同时诱导AST大量增殖,形成胶质瘢痕阻碍神经元损伤后的修复以及其轴突再生,进一步加重了神经元细胞的损害。因此寻找一种有效的手段及时遏止AST的大量增殖可以有效地保护神经元,减轻其不可逆损伤,在中枢神经系统损伤性疾病的临床治疗上有着重要意义。目前研究已知LPA主要通过质膜上的G蛋白偶联受体LPA1、LPA2、LPA3和LPA4发挥生物学功能,与LPA受体耦联的主要有3种 G蛋白,即 Gi/o、Gq/11和 G12/13。Yart等人[8]的研究表明LPA可以通过与 LPA1耦联的Gi蛋白活化丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径实现细胞增殖,另有文献报道LPA通过与LPA3耦联的Gq蛋白调节细胞内[Ca2+]浓度,最终激活 MAPK途径实现细胞增殖[9]。而ERK1/2作为 MAPK家族的重要成员之一,广泛存在于整个中枢神经系统中,在介导细胞反应的信号系统中起着重要作用。ERK1/2激活后可磷酸化核转录因子和其他蛋白激酶等多种底物,参与多种细胞的增殖、分化以及凋亡等细胞行为[10]。U0126为蛋白激酶阻滞剂,可以特异性阻断ERK1/2信号途径,抑制MAPKS级联反应,参与细胞周期调控[11]。LPA对AST的增殖效应能被U0126阻断,证明LPA可以通过p-ERK1/2诱导AST的增殖。
但在我们的实验中观察到LPA对AST的增殖效应没有被U0126完全阻断,注射U0126与LPA混合液的部位GFAP阳性细胞数目仍有少量增加。同时在双标检测中我们还发现早期(<7d)主要在神经元分布区域而非AST分布区域大量表达,继续观察发现p-ERK后期(14d)几乎完全在AST表达。近年来有些学者认为神经元和星形胶质细胞之间通过紧密连接等连接方式存在着广泛的联系从而构成细胞之间信息交流的基础[12],因我们推测,本实验中观察到的LPA诱导的ERK1/2磷酸化细胞分布的变化可能是AST的激活继发于其他细胞的激活的结果,也许是在体条件下LPA诱导AST增殖的另一途径,因而解释了U0126只能部分阻断AST的增殖这一现象。
我们的研究结果显示LPA可通过磷酸化ERK1/2诱导AST增殖,这为临床上寻找抑制急性缺血性脑血管病、脑损伤引发LPA的释放导致胶质细胞过度增生的治疗提供了可能的药物作用靶点。ERK抑制剂U0126的应用提示在LPA诱导大鼠海马AST增殖中,除了有MAPK/ERK1/2信号转导通路的参与外,还可能存在其他信号转导通路的参与,这还有待进一步的研究证实。

图2 GFAP和p-ERK1/2双标图(免疫荧光双标记法)
[1] Chung SM,Bae ON,Lim KM,et al.Lysophosphatidic acid induces thrombogenic activity through phosphatidylserine exposure and procoagulant microvesicle generation in human erythrocytes[J].Arterioscl Throm Vas,2007,(27):414 -421.
[2] 余 樱,张兆辉,杨 波,等.溶血磷脂酸对血脑屏障通透性的影响及其机制[J].中华急诊医学杂志,2006,15(12):1109 -1112.
[3] Tabuchi S,Kume K,Aihara M,et al.Expression of lysophosphatidic acid receptor in rat astrocytes:mitogenic effect and expression of neurotrophic genes[J].Neurochem Res,2000,25(5):573 - 582.
[4] Li LX,Welser JV,Dore-Duffy P,et al.In the hypoxic central nervous system,endothelial cell proliferation is followed by astrocyte activation,proliferation,and increased expression of the alpha 6 beta 4 integrin and dystroglycan[J].Glia,2010,58(10):1157 - 1167.
[5] Shano S,Moriyama R,Chun J,et al.Lysophosphatidic acid stimulates astrocyte proliferation through LPA(1)[J].Neurochem Int,2008,52(1-2):216-220.
[6] Citro S,Malik S,Oestreich EA,et al.Phospholipase cepsilon is a nexus for rho and rap-mediated Gprotein-coupled receptor-induced astrocyte proliferation[J].PNAS,2007,104(39):15543 - 15548.
[7] Sorensen SD,Nicole O,Peavy RD,et al.Common signaling pathways link activation of murine PAR-1,LPA,and S1Preceptors to proliferation of astrocytes[J].Mol Pharmacol,2003,64(5):1199 - 1209.
[8] Yart A,Chap H,Raynal P.Phosphoinositide3-kinases in lysophosphatidic acid signaling:regulation and cross-talk with the Ras mitogen-activated protein kinase pathway[J].BBA-Mol Cell Boil L,2002,1582:107 -111.
[9] Kranenburg O,Moolenaar WH.Ras-MAP kinase signaling by lysophosphatidic acid and other G protein-coupled receptor agonists[J].Oncogene,2001,20:1540 -1546.
[10] Katagiri A,Nakayama K,Rahman MT,et al.MEK inhibition suppresses cell invasion and migration in ovarian cancers with activation of ERK1/2[J].Exp Ther Med,2010,1(4):591 -596.
[11] Farrokhnia N,Ericsson A,Terent A.MEK-inhibitor U0126 in hyperglycemic focal ischemic brain injury in the rat[J].Eur JClin Invest,2008,38(9):679 -685.
[12] Bruzzone S,Verderio C,Schenk U,et al.Glutamate-mediated over expression of CD38 in astrocytes cultured with neurones[J].JNeurochem,2004,89(1):264 -272.

