静脉注入硫酸镁对兔蛛网膜下腔出血后脑血管痉挛的逆转作用
尹 波, 盛汉松, 林 坚, 张 弩
脑血管痉挛(cerebral vasospasm,CVS)是蛛网膜下腔出血(SAH)患者严重的并发症之一,发生率为38%,成为SAH致死、致残的主要原因之一[1]。硫酸镁被认为具有脑保护和血管扩张作用,但是其对改善SAH后的CVS效果报道不一[2]。本实验以兔SAH为模型,采用静脉注入硫酸镁,应用兔的行为学、血清中镁离子浓度测定、形态学等方法探讨硫酸镁对CVS的防治作用。
1 材料与方法
1.1 实验对象 实验动物选用健康大耳白兔,由温州医学院动物中心提供,兔龄3~4个月,体重1.5kg~2.5kg。大耳白兔32只,随机分成假手术组(8只)、SAH组(12只)和SAH+硫酸镁组(12只)。各组间体重无统计学差异(P>0.05)。
1.2 主要试剂和仪器 10%水合氯醛(自配);25%硫酸镁(杭州民生制药厂);欧乃派克碘海醇注射液(上海安盛药业有限公司);GE单C臂数字减影血管造影机(美国GE公司)。
1.3 SAH动物模型制作 SAH模型采用二次枕大池注血法(自体动脉血)。按360mg/kg腹腔注射10%水合氯醛进行麻醉。碘伏消毒后,经耳缘血管,抽取动脉血2ml。枕大池穿刺处脱毛仰卧固定并碘伏消毒,沿枕骨下缘用24号穿刺针刺入,有突破感后,见清亮脑脊液流出,小心缓慢放出2ml脑脊液后缓慢注入动脉血2ml。两组动物均48h后重复上述操作一次。而假手术组手术方式基本一样,但是使用2ml的生理盐水代替动脉血。
1.4 SAH动物模型制成后药物治疗及血样采集和血清中镁离子浓度测定 SAH+硫酸镁组:于术后1h由股静脉以静脉团注法匀速注入硫酸镁(0.01g/kg),随后每天分两次静脉缓慢滴入(0.067 g/kg/d)硫酸镁。假手术组和SAH组:同步给予等量生理盐水滴入。分别在第0、1、3、5、7天取兔耳缘动脉血3ml。使用美国产LX-20全自动分析仪,对血清中的镁浓度进行测定。
1.5 观察指标 记录各组动物每日饮食情况(以标准颗粒饲料、自来水喂养)、精神状态、活动情况以及神经功能变化等。
1.6 兔椎基底动脉造影 在SAH前和SAH后第1、7天,各组动物在麻醉满意后取仰卧位固定于DSA手术台上,下腹部备皮消毒,手术小心暴露左侧髂总动脉。用18#穿刺针直接穿刺髂总动脉,成功后0.014英寸Transend platinum微导丝配合Exel-14微导管超选至左侧椎动脉开口以上。用欧乃派克碘海醇注射液手推造影观察椎基底动脉,并测量狭窄处基底动脉直径。
1.7 兔基底动脉的组织学检查 各组动物在SAH后第8天采用心脏灌注法处死并开颅取材,解剖兔头颅,将兔脑及上颈髓完整暴露并离断,大体观察椎基底动脉,置于福尔马林液中存放。HE染色:
1.8 统计分析方法 所有数据均用SSPS for windows16.0软件完成,数据以均数±标准差±s)表示。数据比较采用t检验。
2 结果
2.1 饮食及神经功能变化 动物存活期间,均予标准颗粒饲料、自来水喂养。SAH后SAH组动物普遍活动减少,警觉性差,摄食吸水量明显下降,有6只兔子术后出现头位弓状蜷缩,1只出现单侧肢体偏瘫。并且在SAH后第4天起有加重表现。SAH+硫酸镁组动物亦出现饮食、活动减少,但持续时间及程度均较SAH组轻,未出现明显偏瘫者。
2.23组SAH前后血清镁浓度变化 3组SAH前后血清镁浓度(μmol/L)变化具体(见表1)。SAH+硫酸镁组在SAH后即每日静脉注入硫酸镁,其4个时间段镁浓度明显升高,且保持在一定范围内;SAH后SAH组血清镁浓度明显下降,假手术组未见明显变化。SAH组与SAH+硫酸镁组在SAH前血清镁浓度无显著差异(P>0.05),在SAH后的4个时间段SAH+硫酸镁组明显高于SAH组和假手术组,有显著性差异(P<0.01)。标本常规脱水,石蜡包埋,切片,常规HE染色,在OLYMPUSBX51生物显微镜(低倍、高倍)下观察动脉壁的显微结构并摄影。
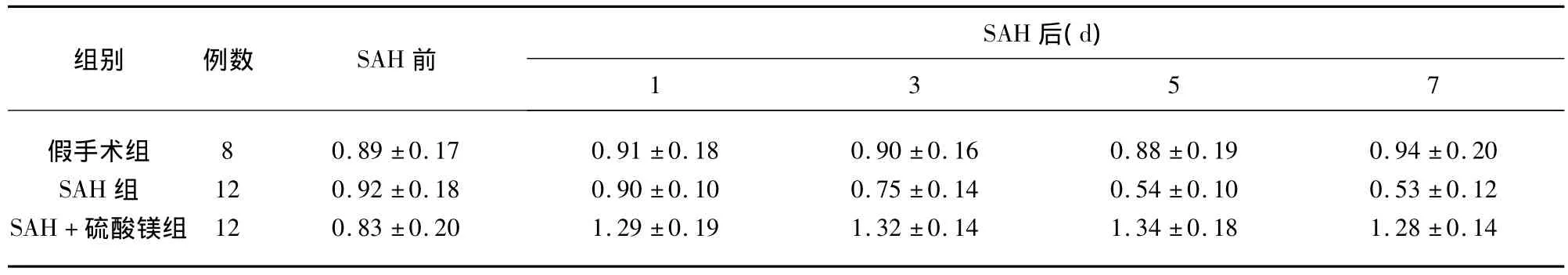
表1 3组SAH前后血清镁浓度变化(μmol/L)
2.3 椎基底动脉造影结果 从DSA检查结果可以看到SAH后1d兔子基底动脉变细,可以看到局部血管粗细不均,考虑血管痉挛形成(见图1A)。而在7d后基底动脉基本恢复正常(见图1B)。而假手术组、SAH组和SAH+硫酸镁组术后第7天造影其基底动脉直径(mm)为 0.63 ±0.13,0.31 ±0.11,0.42±0.12,SAH 组和 SAH+硫酸镁组基底动脉直径有显著性差异(P<0.05)。
2.4 形态学观察结果 假手术组基底动脉结构基本正常(见图2A)。SAH组基底动脉发生了明显的病理变化:管腔有不同程度变窄增厚、内弹力膜明显迂曲皱折,血管平滑肌肥大扭曲变形,部分坏死,胞浆浓染,胞核固缩,外膜细胞增多 (见图2B);SAH+硫酸镁组基底动脉管壁增厚不明显,内弹力膜亦有迂曲,但较SAH组平直(见图2C)。

图1 SAH+硫酸镁组在SAH后1d(A)和7d(B)的椎基底动脉造影
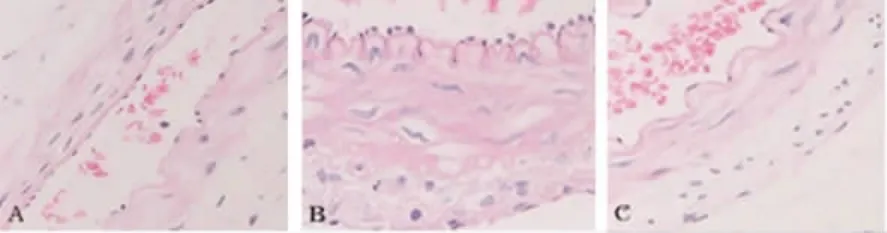
图2 基底动脉形态学观察
3 讨论
自发性蛛网膜下腔出血(SAH)可导致颅内压升高、脑血流下降、脑自动调节机制障碍以及全身血容量下降;随着时间的推移,蛛网膜下腔中的氧合血红蛋白可启动一系列的病理生理改变,引起脑血管痉挛,继而脑灌注不足,产生缺血性神经症状,引起迟发性脑缺血[3]。近年来对SAH的研究颇多,也取得了很多进展,但其死亡率和致残率仍未明显降低。血管痉挛引起的迟发性脑缺血仍然是SAH后最常见的并发症。宋锦宁[4]等研究发现兔实验性蛛网膜下腔出血后脑血管超微结构表现为血管壁增厚,管腔狭窄,内皮细胞变性、肿胀,染色质不均,空泡形成;内弹力膜迂曲皱褶或断裂,厚薄不均;中膜增厚,平滑肌细胞排列紊乱;外膜可见淋巴细胞或单核细胞浸润,这与在人类SAH后早期延迟血管痉挛的改变相似。本研究也发现SAH组基底动脉血管壁也有类似的病理改变。
镁离子是机体内重要的阳离子,参与多种重要酶的生化反应过程,用于临床已有近百年的历史。硫酸镁被认为在对脑血管痉挛的防治及缺血性脑损害具有脑保护和血管扩张作用[5]。目前认为镁离子主要通过以下机制发挥作用:(1)镁离子能抑制突触前膜释放兴奋性氨基酸(EAA)和非竞争性拮抗突出后膜的N-甲基-D-天冬氨酸(NMDA)受体。SAH时EAA产生增多,胞外浓度过高会产生毒性,损伤神经元;EAA受体亚型之一NMDA受体是受配体调节的离子通道,对钙离子具有通透性,NMDA受体活化和去极化后引起非NMDA受体激活,钙离子通道开放,使钙离子内流,引起级联反应,自由基生成增加,导致细胞损伤或凋亡。镁离子可非竞争性拮抗NMDA受体活性,减少兴奋性氨基酸释放,拮抗兴奋性氨基酸的毒性作用,从而减轻NMDA诱发的迟发性神经元损伤[6]。(2)稳定细胞膜,扩张血管。细胞外镁增高可显著减少细胞膜上的内向电流,轻度增加外向电流,引起细胞膜超极化,减少细胞膜上的钙-钠交换;镁与钙竞争结合位点,竞争性抑制钙,阻止钙内流;镁阻止血管平滑肌细胞钙内流,拮抗内皮素-1,防止血管收缩,减轻血管痉挛,增加脑血流供应,改善脑供血,防治脑缺血,减轻神经功能缺损[7]。(3)镁是多种辅酶成分,可促进细胞能量代谢,降低ATP消耗,减少自由基对细胞膜损害,防止迟发性脑缺血[8]。(4)镁对一氧化氮(NO)的合成有调节作用,而NO为血管舒张因子。SAH后NO的作用减弱,而镁可增强NO的作用,从而防止脑血管痉挛[9]。
目前,硫酸镁对动脉瘤性SAH后脑血管痉挛及其继发的延迟性脑缺血(delayed cerebral ischemia,DCI)的临床疗效尚未有确切的研究结论。Macdonald等[10]在10例猴的SAH模型中进行随机对照实验,发现连续静脉注射硫酸镁不能逆转造影证实的血管痉挛。但是近年来有作者[11]通过荟萃分析认为:在人体临床实验中发现SAH后静脉注入硫酸镁能够减少发生DCI的风险和改善患者的预后。本研究采用二次枕大池注血法成功制成SAH模型。静脉注入硫酸镁后两组血浆中的硫酸镁浓度为有显著性差异,治疗可明显提高兔的摄食量和活动能力,避免出现偏瘫等严重神经功能障碍。通过血管造影及病理检查,发现在组织形态学改变方面,硫酸镁充分显示了其良好的扩张血管作用。镁通过改善血管痉挛,使脑血流增加,从而达到预防迟发性脑缺血性损伤的作用。
综上所述,静脉注入硫酸镁可以提高血浆中Mg2+浓度,能逆转兔蛛网膜下腔出血后脑血管痉挛。但是硫酸镁过量的应用也会导致许多不良反应,所以对硫酸镁防治作用的最佳剂量、开始使用和持续使用的时间需要进一步研究。
[1] Dorsch NWC.Therapeutic approaches to vasospasm in subarachnoid hemorrhage[J].Curr Opin Crit Care,2002,8(2):128 -133.
[2] Mori K,Miyazaki M,Iwata J,et al.Intracisternal infusion of magnesium sulfate solution improved reduced cerebral blood flow induced by experimental subarachnoid hemorrhage in the rat[J].Neurosurg Rev,2008,31(2):197 -203.
[3] Muroi C,Terzic A,Fortunati M,et al.Magnesium sulfate in the management of patients with aneurysmal subarachnoid hemorrhage:A randomized,placebo-controlled,dose-adapted trial[J].Surg Neurol,2008,69(1):33 -39.
[4] 宋锦宁,梁 琦,张 明,等.兔实验性蛛网膜下腔出血后脑血管超微结构的病理特征与动态变化[J].西安交通大学学报(医学版),2007,28(4):388 -391.
[5] Wong GK,Kwok R,Tang K,et al.Effects of magnesium sulfate infusion on cerebral perfusion in patients after aneurysmal SAH[J].Acta Neurochir Suppl,2010,106:133 -135.
[6] Dorhout Mees SM,Bertens D,van der Worp HB,et al.Magnesium and headache after aneurysmal subarachnoid haemorrhage[J].J Neurol,Neurosurg Psychiat,2010,81(5):490 -493.
[7] Wong GK,han MT,Gin T,et al.Intravenous magnesium sulfate after aneurysmal subarachnoid hemorrhage:current status[J].Acta Neurochir Suppl,2011,110(Pt 2):169 -173.
[8] Murata T,Horiuchi T,Goto T,et al.Vasomotor response induced by change of extracellular potassium and magnesium in cerebral penetrating arterioles[J].Neurosci Res,2011,70(1):30 - 34.
[9] Laskowitz DT,Kolls BJ.Neuroprotection in subarachnoid hemorrhage[J].Stroke,2010,41:79 -84.
[10] Macdonald RL,Curry DJ,Aihara Y,et al.Magnesium and experimental vasospasm[J].J Neurosurg,2004,100(1):106 -110.
[11] Ma L,Liu W,Zhang J,et al.Magnesium sulphate in the management of patients with aneurysmal subarachnoid haemorrhage:A meta-analysis of prospective controlled trials[J].Brain Injury,2010,24(5):730-735.

