2009甲型H1N1流感患者的细胞因子研究
王一栋,杨潇,单可记,代冬梅,许汪斌
(1.温州市第二人民医院 老年医学科,浙江 温州 325000;2.昆明医学院第一附属医院 ICU科,云南 昆明 650032)
2009年甲型H1N1流感病毒代替季节性H1N1流感病毒,成为此次流感大流行的病因,它起源于猪流感病毒。由于病毒的抗原转变,人类缺乏抗体,它的病死率高于季节性流感,而明显低于H5N1流感[1]。病理性肥胖、心血管疾病、妊娠和免疫力功能低下的患者为此次甲型H1N1流感危重症的高危人群[2-3]。
2009年甲型H1N1流感病毒感染后,患者可出现发热、鼻塞、流涕、咽痛、咳嗽、肌痛、乏力和全身不适等流感样症状。相对于季节性流感病毒,新流感病毒更易侵犯哺乳动物的下呼吸道。部分患者病情进展迅速,可出现细胞免疫功能低下和出血性坏死性肺炎,严重者可导致多器官功能衰竭,甚至死亡。在H5N1流感病毒的患者研究中,死亡的H5N1流感患者有着高病毒载量和高细胞因子血症[4]。但对于2009年甲型H1N1流感病毒,目前我国鲜见相关的细胞因子的报道。我们参考以往对H5N1流感患者的细胞因子的研究,选择致炎因子白介素-2(IL-2)、IL-6、肿瘤坏死因子-α(TNF-α)及抑炎因子IL-4、IL-10作为我们研究的细胞因子。
昆明医学院第一临床学院ICU科成为云南省收治重症2009年甲型H1N1流感患者的指定地点,我们有机会对2009年甲型H1N1流感患者的细胞因子进行前瞻性的研究。
1 资料和方法
1.1 研究对象 纳入本次研究的20例甲型 H1N1流感患者均为发病后3 d内入院,既往均体健,没有已知的基础疾病,平均年龄为(34.65±15.66)岁(16~71岁)。男9例,女11例,年龄>65岁2名,孕妇3名。诊断标准参照卫生部颁发的《甲型H1N1流感诊断治疗方案(2009试行版第三版)》[5]及卫生部制定的《甲型H1N1流感出院标准》。
1.2 研究方法 本研究是以入院时以氧合指数200为界,将甲型H1N1患者分为A组(n=10例)和B组(n=10例)。A组平均氧合指数为321.27±131.60,B组平均氧合指数为152.27±54.04。两组均给予抗病毒(奥司他韦及利巴韦林抗病毒)、抗细菌感染、呼吸支持(包括无创及有创呼吸支持)及小剂量的激素治疗(甲强龙40 mg,每12 h 1次)。分别于入院时、治疗第1、3、5天抽取外周静脉血4 mL检测细胞因子。
1.3 实验方法
1.3.1 病原学检测
1.3.1.1 检测方法:甲型H1N1流感疑似病例入院后,采集上呼吸道标本。咽拭子采集后送交疾病控制中心(CDC)进行real-time RT-PCR病毒核酸检测。
1.3.1.2 咽拭子采样器材:拭子:使用头部为聚酯纤维的拭子。采集管:外螺旋口,耐-70 ℃冻存。采样液:含有蛋白质稳定剂、阻止细菌和真菌生长的抗生素和缓冲液。
1.3.1.3 甲型H1N1实验室诊断标准:甲型流感病毒通用(M基因)阳性,猪H1N1流感病毒通用(NP基因)阳性,甲型H1N1流感病毒特异(HA基因)阳性的标本,3项均为阳性可确诊为感染甲型H1N1病毒。
1.3.2 细胞因子的检测
1.3.2.1 白介素的检测:主要试剂:预包被微孔反应板,浓缩酶结合物,酶结合物稀释液,标准品和标本稀释液,生物素化的抗人白介素抗体,白介素标准品,浓缩洗涤液,显色剂A、B,终止液。仪器:酶标仪或全自动酶联免疫检测仪。检测步骤:在微孔反应板相应孔中分别加入待测样本、不同浓度标准品10OμL,再加生物素化的抗人白介素抗体和辣根过氧化物酶标记的亲和素5Ord;振荡混匀,置20~25 ℃环境中温育120 min;将孔内液体吸干,用洗涤液充分洗涤5次,干燥;除空白孔外,加入酶结合物工作液100μL;振荡混匀,置20~25 ℃环境中温育3O min;将孔内液体吸干,用洗涤液充分洗涤5次,干燥;每孔加入显色剂A、B各50μL,轻轻振荡混匀,37 ℃环境中避光显色10 min;加入终止液5OμL后,轻轻振荡混匀;用酶标仪(45O nm波长)测定各孔吸光度,与标准曲线对照,求出白介素水平。
1.3.2.2 TNF-α的检测:主要试剂:预包被微孔反应板,浓缩酶结合物,酶结合物稀释液,标准品和标本稀释液,生物素化的抗人TNF抗体,TNF-α标准品,浓缩洗涤液,显色剂A、B,终止液。仪器:酶标仪或全自动酶联免疫检测仪。检测步骤:在微孔反应板相应孔中分别加入待测样本、标准品5μL,轻轻混匀10 s。每孔加入20OμL抗人TNF-α抗体,轻轻混匀30 s,置37 ℃环境中温育30 min。将孔内液体吸干,用洗涤液充分洗涤5次,干燥。除空白孔外,加入酶结合物工作液200μL,轻轻混匀10 s,置37 ℃环境中温育30 min。将孔内液体吸干,用洗涤液充分洗涤5次,干燥。每孔加入TMB显色剂各1OOμL,轻轻振荡混匀10 s,37 ℃环境中避光显色20 min。加入终止液100μL后,轻轻振荡混匀30 s。用酶标仪(45O nm波长)测定各孔吸光度,与标准曲线对照,求出TNF-α水平。
1.4 统计学处理方法 用SPSS 11.5统计软件包分析,所有数据以±s表示。组内比较采用配对资料的t检验,组间比较采用方差分析,P<0.05表示有统计学意义。
2 结果
2.1 IL-2水平 总体均数明显呈下降趋势,由(12.87±12.76)pg/mL下降至(1.15±0.68)pg/mL。与氧合指数≥200组相比,入院时及治疗第1天氧合指数<200组IL-2升高,两组比较差异有统计学意义(P<0.05)。见表1。
表1 氧合指数≥200组与氧合指数<200组IL-2比较(n=10±s)

表1 氧合指数≥200组与氧合指数<200组IL-2比较(n=10±s)
与氧合指数≥200组比:*P<0.05
入院 治疗第1天 治疗第3天 治疗第5天全部患者 12.87±12.76 5.03±4.97 1.31±0.57 1.15±0.68氧合指数<200 20.44±15.99* 8.28±7.92* 1.59±0.38 1.04±0.64氧合指数≥200 5.29±3.56 1.77±0.42 1.03±0.61 1.25±0.74
2.2 IL-4水平 与氧合指数≥200组相比,治疗第3天氧合指数<200组IL-4明显增高(P<0.01)。见表2。
表2 氧合指数≥200组与氧合指数<200组IL-4比较(n=1±s)
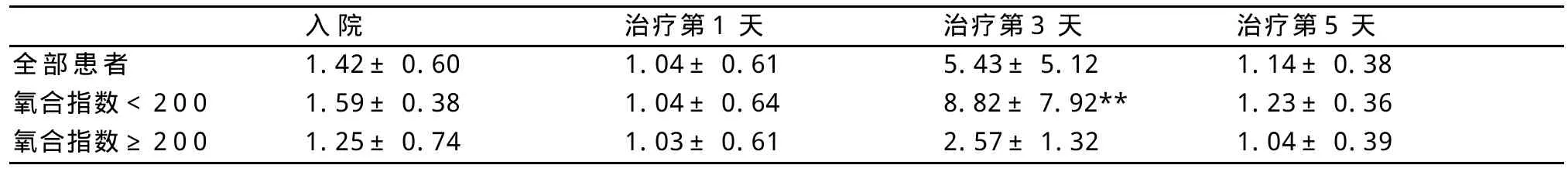
表2 氧合指数≥200组与氧合指数<200组IL-4比较(n=1±s)
与氧合指数≥200组比:**P<0.01
入院 治疗第1天 治疗第3天 治疗第5天全部患者 1.42±0.60 1.04±0.61 5.43±5.12 1.14±0.38氧合指数<200 1.59±0.38 1.04±0.64 8.82±7.92** 1.23±0.36氧合指数≥200 1.25±0.74 1.03±0.61 2.57±1.32 1.04±0.39
2.3 IL-6水平 总体均数明显呈下降趋势,由(27.26±27.88)pg/mL下降至(1.15±0.51)pg/mL。与氧合指数≥200组相比,入院及治疗第1天氧合指数<200组IL-6明显增高(P<0.01)。见表3。
表3 氧合指数≥200组与氧合指数<200组IL-6比较(n=10±s)

表3 氧合指数≥200组与氧合指数<200组IL-6比较(n=10±s)
与氧合指数≥200组比:**P<0.01
入院 治疗第1天 治疗第3天 治疗第5天全部患者 27.26±27.88 6.43±6.93 1.25±0.65 1.15±0.51氧合指数<200 49.56±23.06** 10.28±8.16** 1.47±0.64 1.25±0.61氧合指数≥200 4.96±1.92 2.57±1.33 1.03±0.61 1.04±0.39
2.4 IL-10水平 与氧合指数≥200组相比,入院及治疗第3天氧合指数<200组IL-10明显增高(P<0.05)。见表4。
表4 氧合指数≥200组与氧合指数<200组IL-10比较(n=10±s)

表4 氧合指数≥200组与氧合指数<200组IL-10比较(n=10±s)
与氧合指数≥200组比:*P<0.05,**P<0.01
入院 治疗第1天 治疗第3天 治疗第5天全部患者 5.43±6.26 6.51±4.38 3.86±3.09 2.15±1.06氧合指数<200 8.28±7.92** 7.45±5.67 4.93±3.98* 2.21±0.65氧合指数≥200 2.57±1.33 2.56±1.32 2.78±1.30 2.09±1.40
2.5 TNF-α水平 总体均数明显呈下降趋势,由(37.56±48.48)pg/mL下降至(6.25±9.29)pg/mL。与氧合指数≥200组比,氧合指数<200组TNF-α明显增高(P<0.01)。见表5。
表5 氧合指数≥200组与氧合指数<200组TNF-α比较(n=10±s)

表5 氧合指数≥200组与氧合指数<200组TNF-α比较(n=10±s)
与氧合指数≥200组比:**P<0.01
入院 治疗第1天 治疗第3天 治疗第5天全部患者 37.56±48.48 18.31±26.32 11.09±18.51 6.25±9.29氧合指数<200 70.16±50.96** 32.62±31.85** 19.37±23.87** 9.95±12.23**氧合指数≥200 7.40±5.52 4.96±1.92 3.99±2.24 2.80±5.75
3 讨论
20世纪全球共发生5次流感大流行,自有记载以来最大的一次流感是1918-1919年发生在西班牙的甲型H1N1流感,导致全球4000~10000万人死亡,死亡人数超过两次世界大战死亡人数的总和[6-7]。流感病毒由于抗原漂移和抗原转变,极易发生变异,使得人群对新出现的病毒株缺乏免疫力,导致流感的周期性爆发。在动物实验研究中,新流感病毒在病毒复制和诱发细胞因子的作用类似于季节性流感病毒,但明显弱于H5N1流感病毒[1]。但是,新甲流病毒易同时侵犯上呼吸道和下呼吸道,不像季节性流感病毒主要侵犯上呼吸道[8-9]。在死亡的患者中,弥漫性的肺泡损伤、反应性嗜红细胞现象和淋巴结萎缩类似于H5N1感染所致的患者[10]。由于流感病毒主要侵犯呼吸道,所以我们根据氧合指数,分为重症组和非重症组,即A组和B组,研究其细胞因子的变化趋势。
机体的病毒载量在流感症状发生的2~3d达到高峰,随着机体免疫功能的激活,病毒复制到达一个平台期[11]。奥司他韦等抗病毒治疗能快速地抑制病毒的复制,而免疫球蛋白和含有中和抗体的血浆也被认为是重症流感患者的有效治疗手段,它们都可以减轻过度的炎症反应。
细胞因子虽然有抗病毒的作用,但是也会造成组织损伤,在重症的流感患者中,机体有着更高的细胞因子水平。在感染流感病毒的猕猴模型中,肺泡液中IL-6和MCP-1的升高程度与疾病的严重性有关[9]。IL-10在减轻严重的炎症反应是必需的,在流感病毒感染的小鼠模型中,IL-10的缺乏具有保护现象,而高的IL-10水平具有不良的抗体反应[12-13]。我们研究的20例确诊的新流感患者中,IL-2、IL-6、IL-10和TNF-α的升高与疾病的严重程度密切相关,重症患者的细胞因子水平高于非重症患者。IL-2、IL-6和TNF-α作为致炎因子,在重症患者的血中浓度一直高于非重症。IL-4和IL-10作为抑炎因子,在入院后第1天和第3天升高后又下降,可能与病情的好转,炎症反应的减轻有关。总体上,随着病情的好转,细胞因子的水平逐渐下降。
总之,重症流感患者有着更高的细胞因子水平,流感病毒引起机体的炎症风暴是这次流感大流行期间重症患者的重要致病机制。在临床工作中,快速有效的抗病毒治疗可以减轻机体的病毒复制,免疫调节剂的应用可以减轻患者的炎症风暴,减少机体组织的损害,可能有助于重症患者的恢复。
[1] Li IW, Chan KH, To KW, et al. Differential susceptibility of different cell lines to swine-origin influenza A H1N1,seasonal human influenza A H5N1 viruses[J]. J Clin Virol,2009,46(4):325-330.
[2] Hanshaoworakul W, Simmerman JM, Narueponjirakul U,et al. Severe human influenza infections in Thailand:oseltamivir treatment and risk factors for fatal outcome[J].Plos One, 2009, 4(6):e6051.
[3] Jamieson DJ, Honein MA, Rasmussen SA, et al. Novel Infuenza A(H1N1) Pregnancy Working Group. H1N1 2009 infuenza virus infection during pregnancy in the USA[J].Lancet,2009,374(9688):451-458.
[4] de Jong MD, Simmons CP, Thanh TT, et al. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia[J]. Nat Med, 2006, 12(10):1203-1207.
[5] 卫生部办公厅关于印发《甲型H1N1流感诊疗方案(2009年试行版第三版)》的通知[EB/OL].http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohyzs/s3586/200910/43111.htm
[6] Johnson NP, Mueller J. Updating the accounts:global mortality of the 1918--1920 "Spanish" influenza pandemic[J].Bull Hist Med,2002,76(1):105-115.
[7] Oxford JS. Influenza A pandemics of 20th century with special reference to 1918:virology,pathology and epidemiology[J]. Rev Mec Virol,2000,10(2):119-133.
[8] Munster VJ, de Wit E, van den Brand JM, et al. Pathogenesis and transmission of swine-origin 2009 A (H1N1) influenza virus in ferrets[J]. Science,2009,325(5939):481-483.
[9] Itoh Y, Shinya K, Kiso M, et al. In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses[J].Nature,2009,460(7258):1021-1025.
[10] Yuen KY, Chan PK, Peiris M, et al. Clinical features and rapid viral diagnosis of human disease associated with avian influenza A H5N1 virus[J]. Lancet,1998,351(9101):467-471.
[11] Moltedo B, Lopez CB, Pazos M, et al. Cutting edge: stealth influenza virus replication precedes the initiation of adaptive immunity[J]. J Immunol,2009,183(6):3569-3573.
[12] McKinstry KK, Strutt TM, Buck A, et al. IL-10 deficiency unleashes an influenza -specific Th17 response and enhances survival against high-dose challenge[J]. J Immunol,2009,182(12):7353-7363.
[13] Corsini E, Vismara L, Lucchi L,et al. High interleukin-10 production is associated with low antibody response to influenza vaccination in the elderly[J]. J Lerkoc Biol,2006,80(2):376-382.

