Optiprep法分离大鼠肝星状细胞的实验研究
余盼攀,张胜初,季世强,苏龙丰,张启瑜
(温州医学院附属第一医院 肝胆外科,浙江 温州 325035)
Knook等[1]在1982年采用胶原酶、链霉蛋白酶原位循环灌注法首先成功地分离出大鼠肝星状细胞(hepatic stellate cells,HSC),标志着HSC研究的开始。HSC是目前肝纤维化研究的一个关键点。活化的HSC能分泌细胞外基质及多种细胞因子,在肝纤维化发生、发展及转归中扮演了重要的角色。原代HSC和体外活化的细胞株具有不同的生物学特点,原代HSC适合静止HSC的生物学特性的研究。体内绝大部分HSC是以静止状态存在,所以对原代HSC的研究更有实际意义。原代HSC的分离难度大,成功率低,建立一种合理、经济、便捷的分离方法实属必要。本研究在国内外大鼠HSC分离培养基础上采用改良的Optiprep密度梯度离心法成功分离出大鼠HSC,现介绍如下。
1 材料和方法
1.1 实验动物 雄性SD大鼠,体质量500~600 g,由温州医学院动物实验中心提供,常规喂养,术前12 h禁食。
1.2 试剂及仪器 IV型胶原酶(type IV collagenase)、DNA酶I(DNaseI)、D-Hanks液均购自美国Sigma公司,Optiprep分离递质购自挪威Axis-shield公司。DMEM培养基购自美国Gibco公司,胎牛血清购自杭州四季青公司。大鼠α-SMA单克隆抗体、山羊抗小鼠IgG二抗购自武汉博士德公司。倒置相差显微镜购自德国Leica公司,荧光显微镜购自日本Olympus公司,高速离心机购自美国Beckman公司。
1.3 分离用液 前灌注液:D-Hanks液500 mL+肝素钠1 mL预热至37 ℃。酶灌注液:Hanks 100 mL+IV型胶原酶0.05 g+DNA酶I 0.03 g预热至37 ℃。震荡消化液:同酶灌注液。终止消化液:DMEM培养液10 mL+胎牛血清5 mL预冷至4 ℃。细胞洗涤液:Hanks 50 mL+DNA酶I 0.02 g。离心液:10%离心液(60% Optiprep原液0.8 mL+D-Hanks液4.17 mL);16%离心液(60% Optiprep原液1.5 mL+D-Hanks液3.5 mL)。各液体中分别加入1%青链霉素。
1.4 分离方法
1.4.1 原位消化:大鼠经3%戊巴比妥钠30 mg/mL麻醉后,固定于操作台上,腹部备皮,75%酒精消毒后取大十字切口进腹。肝脏稍作分离,显露肝上下腔静脉同时游离肝下下腔静脉带线备用。游离门静脉主干1.5 cm带线备用,侧支予以结扎。血管夹夹闭门静脉远端,近端置18号留置针并固定,同时夹闭肝上下腔静脉,剪开肝下下腔静脉,用50 mL针筒缓慢推注前灌注液。
1.4.2 离体消化:当肝脏表面颜色变为灰白时迅速游离肝脏置于无菌小弯盘。换酶灌注液继续灌注10 min,待肝包膜下肝组织完全软化几乎成液体时停止消化。
1.4.3 细胞分散及纯化:将肝脏转移至无菌培养皿中,剪开包膜,剔除结缔组织,剪碎肝组织放入50 mL离心管中加入震荡消化液于37 ℃震荡消化20 min,结束后加入15 mL终止消化液。所得细胞悬液经200目滤网过滤2次,移入2个50 mL离心管中,加入细胞洗涤液充分吹打分散细胞。65 g离心10 min去除肝细胞,上清分别移入2只50 mL离心管中,500 g离心10 min,取沉淀。2管合为1管,用40 mL细胞洗涤液重悬细胞,再次500 g离心10 min,取沉淀。
1.4.4 Optiprep密度梯度离心:上述细胞沉淀加入16% Optiprep 5 mL重悬,终浓度为12%,再轻轻上覆10% Optiprep 5 mL,再以同样的方法上覆5 mL D-Hanks液,于4 ℃ 1400 g密度梯度离心17 min,轻轻取出离心管,用玻璃注射器小心吸出上层D-Hanks液与10% Optiprep液界面灰白色的细胞条带,用洗涤液以500 g,7 min漂洗2次,用含20%胎牛血清的DMEM重悬细胞,移出部分用于细胞鉴定外其余移入培养瓶中,于37 ℃,5% CO2培养箱中培养。
1.5 鉴定方法
1.5.1 新鲜HSC产量的测定:倒置相差显微镜下,用血细胞计数板计算细胞产量。
1.5.2 活细胞率鉴定方法:台盼蓝排斥反应:取细胞悬液90μL加入0.4%台盼蓝10μL后滴加到载玻片上,显微镜下计算未染色的活细胞数。
1.5.3 性质鉴定方法:荧光显微镜下观察当激发波长为328 nm时出现自发荧光的细胞即为新鲜分离的肝星状细胞。六孔板中放入在盖玻片,待细胞爬片后采用α-SMA免疫细胞化学法鉴定。
1.6 培养及传代方法 将细胞以5×105/mL接种于25 mL培养瓶中,于37 ℃,5% CO2培养箱中培养,24 h后首次换液去除未贴壁的细胞。以后每2~3天换液一次,待细胞长满瓶底时0.25%胰酶消化传代。
2 结果
2.1 HSC的形态观察 在荧光显微镜下能见到新鲜分离细胞的自发淡蓝色荧光,见图1。在相差显微镜下,新分离的HSC呈圆形,具有很强的折光性,体积明显小于肝细胞,见图2。接种30 min即可出现贴壁,培养24 h后细胞90%贴壁,多呈纺锤形、多角形。培养至5 d左右细胞外观呈现出明显的星形,胞浆内颗粒减少,细胞逐渐融合成片状生长,见图3。培养至14 d细胞全部活化,胞浆内脂滴基本消失,体积增大。

图1 新鲜分离的HSC自发荧光(×400)
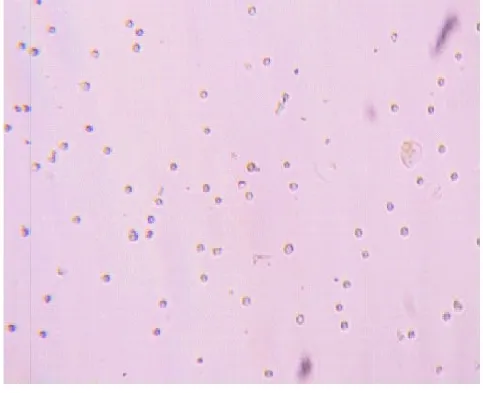
图2 新鲜分离的HSC(×100)

图3 体外培养5 d的HSC(×200)
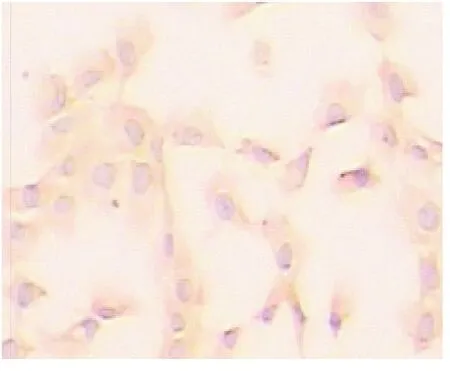
图4 传5代后HSCα-SMA染色(SABC,×200)
2.2 HSC的得率和存活率 采用Optiprep密度梯度离心法分离SD大鼠肝星状细胞,大鼠平均每只重500 g,平均得率为2×107个/肝。经0.4%台盼蓝染色,细胞存活率在90%以上。
2.3 HSC纯度鉴定 α-SMA免疫细胞化学染色显示,新鲜分离的肝星状细胞α-SMA染色阴性,传5代后α-SMA阳性细胞达95%以上,见图4。
3 讨论
HSC是四种肝脏非实质细胞的一种,首先由Kuffer在1876年发现。1996年美国肝病会议将其统一命名为肝星状细胞(HSC)[2]。目前大量的抗纤维化研究都是围绕着HSC的增殖、凋亡、转归而开展的[3]。静止的HSC在体外能迅速活化,所以要研究静止HSC的生物学特性必须采用新鲜分离的HSC。国内外关于大鼠HSC分离培养的方法报道甚多[4-8],但也有一些不足,如单用原位循环灌注酶液虽然操作简单,但由于肝脏与邻近器官侧支循环丰富,这样不但增加酶的用量,增加分离成本,而且酶容易经侧支循环流向其他器官而影响灌注的效果;链酶蛋白酶虽然可以去除部分肝细胞,提高星状细胞纯度,但对星状细胞亦有较大的损伤;采用蠕动泵灌注虽然速度压力较均匀,但起初灌注时需要较高的压力迅速冲洗肝脏内血液及其他杂质,而当灌注酶液时由于酶与肝细胞需要一定的反应时间,此时则需要较低的灌注压。我们经过反复实验总结出影响HSC得率、纯度、活力的主要因素及改进方法,介绍如下:
3.1 实验动物的选择 实验动物体质量要大于400 g,并且营养状况要好,这样才能保证有足够的细胞数并且使HSC含有更多的脂滴,有利于密度梯度的形成。术前1个月给予每周两次腹腔注射维生素A对密度梯度的形成有一定的帮助。
3.2 酶的类型及浓度 我们仅使用IV型胶原酶和DNA酶I而没有使用链酶蛋白酶,发现HSC得率并没有明显下降反而细胞活力有所提高,说明链酶蛋白酶并非必需。在配置各种液体时要确保浓度准确,若酶浓度过高则对细胞的损伤大,若过低则达不到充分消化的目的,影响HSC的得率。值得注意的是,对各种实验用液要在实验前预冷或预热到适当温度,以保证达到最佳的效果。
3.3 合适的灌注压力及消化时间 必须掌握好合适的灌注压。若压力过大,细胞容易发生机械损伤,若过小则延长实验时间亦会影响细胞的活力。我们在实验中采用注射器人工推注的方法根据实际推注时阻力大小调整灌注速度和压力(约10~15 mL/min)提高了灌注效率,减少细胞损伤,取得较好效果。灌注、震荡消化时间尤为重要。我们通过反复实验得出离体灌注酶液约10 min后剪碎肝组织后再37 ℃震荡消化20 min效果最好。
3.4 肝脏的处理 在游离肝脏时应尽量结扎除肝下下腔静脉外所有与外界相通的管道,并且避免肝脏损伤,这样才能保证整个肝脏灌注均匀、完全。值得一提的是,离体灌注结束后用组织剪先剔除肝包膜及肝内血管、胆管以减少杂质的混杂,而后剪碎肝组织,确保能充分消化以提高细胞得率。
3.5 分离递质的选择及配置 高质量的分离递质是HSC分离成功的关键因素。目前国内学者多采用Percol或Nycodenz作为分离递质,我们通过预实验发现Percol虽然价格较低,但很难形成明显的细胞条带。Nycodenz为固体,溶解度小,配置过程容易污染且浓度误差较大。因此我们采用Optiprep作为分离递质,发现与Percol、Nycodenz相比其对细胞损伤较小,液体配置更加简便、准确且细胞条带更明显,细胞纯度、得率亦较高。重要的是分离用液必须现用现配,配之前必须充分混匀原液,以避免密度不均。我们采用D-Hanks液稀释60% Optiprep至10%、16%,加10% Optiprep和最上层D-Hanks时一定要沿管壁慢慢流下,保证加完以后能形成明显的分层。
3.6 密度梯度的形成及细胞获取 密度梯度的形成除优质的分离递质外离心机的正确使用至关重要,离心时务必将离心机调成慢制动状态,并且温度设置为4 ℃,避免快速制动后层面发生混杂及温度过高影响细胞活性。离心完取细胞条带时尽量保持注射器垂直,缓慢向上吸取细胞层,避免过快时吸到层面下的Kupffer细胞影响HSC的纯度。
当然整个分离过程必须保证严格无菌,操作过程必须熟练,尽量缩短分离时间,否则影响细胞活力。
综上所述,我们采用原位预灌注含肝素的DHanks液后再离体灌注IV型胶原酶和DNA酶I,不仅大大节省了酶的用量,而且使得灌注更加完全、均匀。此方法提取的HSC产量、纯度、活力都达到甚至超过了之前的分离方法,并且操作简便,费用较低,可以作为一种合理、经济、便捷的HSC提取方法。
[1] Knook DL, Seffelaar AM, Delleuw AM. Fat-storing cells of the rat liver:their isolation and purification[J]. Exp Cell Res,1982,139(2):468-471.
[2] Ahernmn M, Hall P, Halliday J, et al. Hepatic stellate cell nomenclature[J]. Hepatology,1996,23(1):193-193.
[3] Wang X, Tang X, Gong X, et al. Regulation of hepatic stellate cell activation and growth by transcription factor myocyte enhancerfactor 2[J]. Gastroenterology,2004,127(4):1174- 1188.
[4] 翁山耕, 冷希圣, 魏玉华. 改良法大鼠肝星状细胞的分离培养及鉴定[J].北京大学学报:医学版,2001,33(1):83-86.
[5] Friedman SL, Roll FJ. Isolation and culture of hepatic lipocytes ,kupffer cells,and sinusoidal endothelial cells by density gradient centrifugation with stractan[J]. Anal Biolchem,1987,161(1):207-218.
[6] Ramm GA. Isolation and culture of rat hepatic stellate cells[J]. J Gastroenterol Hepatol,1998,13(8):846-851.
[7] 王文兵, 戴立里, 郑元义. 改良原位循环灌流法大鼠肝星状细胞分离培养及鉴定[J]. 中华肝脏病杂志,2004,12(10):629-630.
[8] 罗云, 戴立里, 沈鼎明,等. 原位循环灌流法分离大鼠肝星状细胞[J].重庆医科大学学报,2002,27(1):48-49.

