不同多花黑麦草品种萌发期耐盐性评价
许能祥,顾洪如,程云辉,张 霞,丁成龙
(江苏省农业科学院畜牧研究所,江苏 南京210014)
目前全世界盐碱地面积已有9.5亿hm2,而中国各类盐碱地的总面积达9 913.3万hm2,约占世界盐碱地的10%[1]。土壤盐碱化是影响全球农业生产和生态环境的严重问题[2],加上不断增长的人口增加了对土地的需求量。另一方面伴随着全球气候变化,淡水资源将成为未来世界的最大制约因子,传统农业灌溉所依赖的淡水资源短缺将不可避免,因此,耐重盐植物的培育及规模化生产将是未来农业发展方向[3]。有关盐碱地对植物生长和生理生化影响的研究较多[4-6],但田间试验相对较少。
目前对植物耐盐的分子机制缺乏透彻了解,在众多已分离鉴定的盐应答基因中,许多仅是盐胁迫的产物,对植物抵抗盐害并没有作用或作用很小,因此,从适应盐生环境的盐生植物中直接开发耐盐作物比将耐盐基因导入传统作物的路径更容易获得成功[6]。多花黑麦草(Lolium multiflourum)是一种再生性较强的优质牧草,具有很好的抗逆性,分布广泛,种质资源丰富。由于国内登记的多花黑麦草品种很少,培育新的品种需要花费很多时间和精力,而引进国外耐盐且饲草品质优良的多花黑麦草品种可以节省大量的时间和精力。当前对植物耐盐性的研究多采用表型指标,且多采用单一指标,不能真实反映植物的耐盐性。因此,需要建立一套客观评价牧草耐盐性的方法,对牧草种质资源的耐盐性进行综合评价[7]。本研究采用人工模拟不同盐浓度胁迫处理的方法,对24个引进多花黑麦草品种的种子萌发进行综合评价,以期为盐碱地初步筛选和利用牧草种质资源提供依据。
1 材料与方法
1.1 供试材料 供试的材料为江苏省农业科学院畜牧研究所于2007年从日本引进的24个多花黑麦草品种(表1)。
1.2 试验方法
1.2.1 试验处理 用 NaCl(纯度达99.9%)配成23.4、35.1、46.8和58.5mol/L 4个处理的盐溶液,每个处理3次重复,对照不加盐。在直径90mm洗净干燥的培养器内放入适量脱脂棉,上盖一层滤纸,然后每个培养器中加入30mL各处理的盐溶液,再放入100粒经消毒处理的种子,置于温箱中,在变温条件下15℃16h和25℃8个h进行光照培养。每日补充所损失的水分,使各处理的盐浓度维持不变。
1.2.2 测定项目 发芽率为盐胁迫7d后种子的发芽数;苗(根)长为盐胁迫7d后植株苗(根)的长度;生物量和叶片含水量均采用称量法,于盐胁迫7d后分别将植株和叶片放入烘箱中,70℃烘至质量不变,在干燥器内冷却至室温后称量。


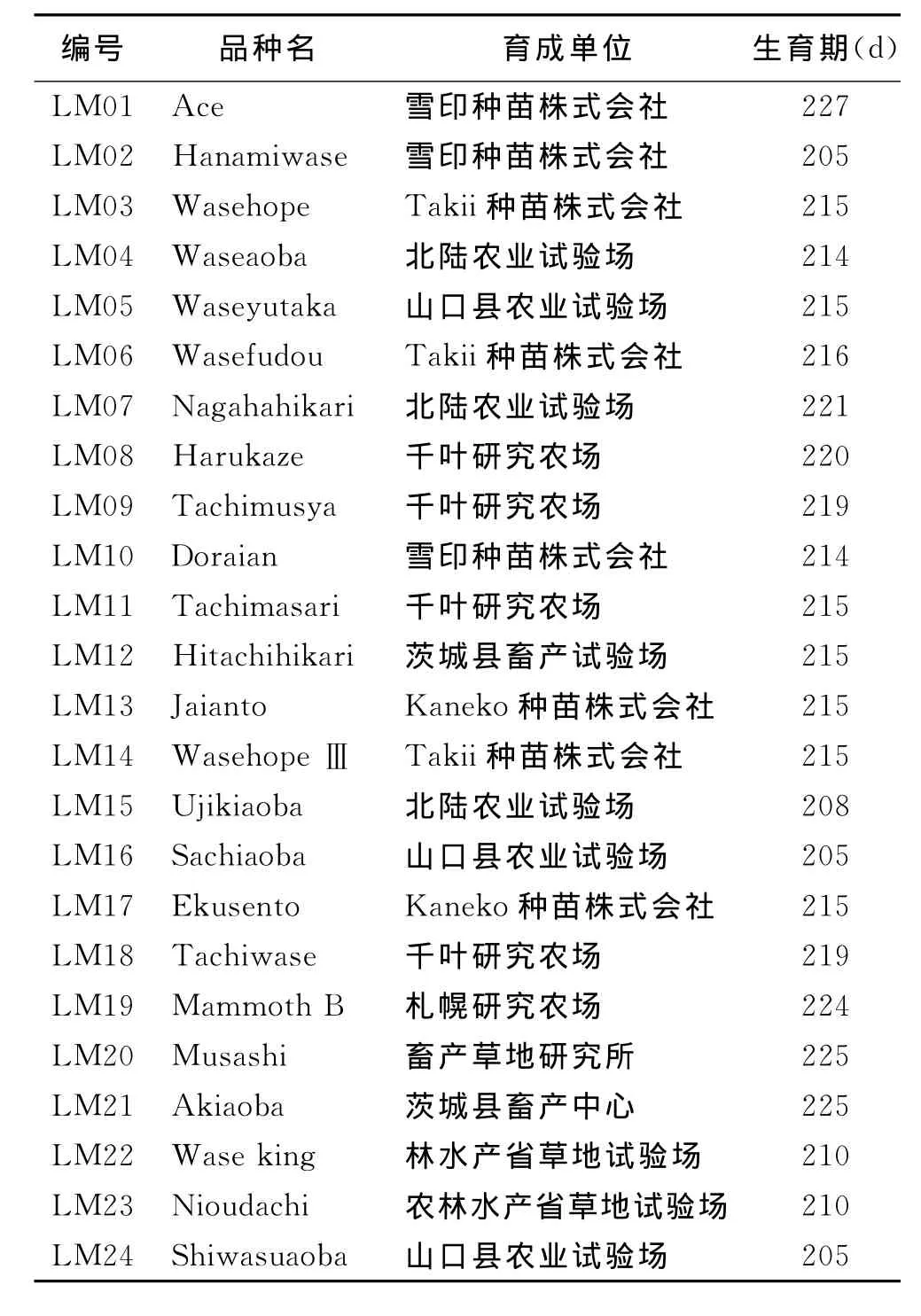
表1 试验材料及来源
1.3 数据处理 采用Excel和SPSS.v16.0软件进行数据分析。
2 结果
2.1 盐胁迫对多花黑麦草种子相对发芽率、相对苗长和相对根长的影响 为了消除各材料本身的差异,均采用相对值作为衡量耐盐性状指标。相对发芽率、相对苗长、相对根长随着盐浓度的增加呈下降趋势,其中参试的24个材料在23.4mol/L盐溶液浓度下的相对发芽率、相对苗长、相对根长显著高于46.8、58.5mol/L处理(P<0.05)(表2)。
在23.4mol/L盐胁迫下,参试材料的相对发芽率的变化在76.8%~95.5%,只有LM03、LM07、LM08、LM09、LM14、LM16、LM19和 LM24的相对发芽率低于90%;而在58.5mol/L盐胁迫下,相对发芽率的变化在20.2%~67.1%,其中LM05、LM07、LM10、LM12、LM13、LM17、LM18、LM20和LM23的相对发芽率高于60%,受盐害胁迫程度相对较轻。在23.4mol/L盐溶液浓度胁迫下,参试材料的相对苗长的变化在77.8%~123.5%,其中LM02、LM04、LM09、LM14、LM16、LM18、LM22和LM24的相对苗长低于90%;在58.5mol/L盐胁迫下,相对苗长的变化在32.9%~61.9%,其中LM03、LM07、LM10、LM11、LM12、LM15、LM17、LM19、LM20、LM22和LM23高于50%,表明有较强的耐盐性。相对于相对发芽率和相对苗长,盐胁迫对相对根长的影响更大,在23.4mol/L盐溶液浓度胁迫下,参试材料的相对根长的变化在61.2%~102.0%,其中 LM03、LM05、LM08、LM11、LM12、LM19、LM20、LM21和LM24的相对根长高于90%;在58.5mol/L盐溶液浓度胁迫下,相对根长的变化在6.0%~41.3%,下降幅度较大,不同材料间差异明显,其中LM12、LM13、LM21和LM22的相对根长保持在25%以上,表现出较强的耐受性。不同品种、不同盐浓度、品种和盐浓度的互作效应分别对相对发芽率、相对苗长和相对根长的影响差异达极显著水平(P<0.01)。
2.2 盐胁迫对多花黑麦草种子相对生物量和叶片相对含水量的影响 参试材料的相对生物量和相对叶片含水量呈下降趋势(表3)。其中参试的24个材料在23.4mol/L盐溶液浓度下的相对生物量和相对叶片含水量显著高于46.8、58.5mol/L处理(P<0.05)。在23.4mol/L盐溶液浓度胁迫下,参试材料的相对生物量的变化在49.5%~131.8%,其中LM03、LM05、LM06、LM07、LM08、LM10、LM11、LM12、LM13、LM17、LM18、LM19、LM20、LM21和LM22的相对生物量高于100%,在较低盐溶液浓度下的植株的生物量较对照有增加;在58.5mol/L盐溶液浓度胁迫下,相对生物量的变化在29.3%~85.6%,其中 LM03、LM10、LM11、LM12、LM19和LM22保持在80%以上,表现出较好的生长状态。在23.4mol/L盐溶液浓度胁迫下,参试材料的相对叶片含水量的变化在90.4%~99.9%,在58.5mol/L盐溶液浓度胁迫下,相对叶片含水量的变化在70.4%~81.7%。表明盐胁迫对相对叶片含水量的影响较小,除LM02外,不同材料间相对叶片含水量差异不显著,但同一品种不同浓度差异均显著(P<0.05)。不同品种、不同盐浓度、品种和盐浓度的互作效应分别对相对生物量和叶片相对含水量的影响差异达极显著水平(P<0.01)。

表2 不同盐浓度对多花黑麦草种质资源萌发期耐盐性状的影响
3 讨论
多花黑麦草种子的相对发芽率随着盐浓度的增加呈下降趋势,特别是在盐溶液浓度达46.8mol/L以后,大部分种子的相对发芽率急剧下降。沈艳等[8]认为盐溶液浓度在35.1~70.2mol/L时,大部分高羊茅(Festuca arundinacea)种子的相对发芽率迅速下降,且相对发芽率下降速度越快说明品种耐盐性越差。在高盐溶液浓度胁迫下,多花黑麦草种子相对发芽率差异性很大,其中在58.5mol/L盐溶液浓度胁迫下,LM20的相对发芽率为67.1%,而LM08只有20.2%,表明多花黑麦草种质材料的耐盐性有较大差异。因此,通过耐盐性评价,获得耐盐性较强的材料可在盐碱地直接种植,可能成为盐碱地的先锋植物,可以为畜牧业的生产发展提供优质的青绿饲料,这是下一步的研究计划。
在较低盐溶液浓度时,部分种质材料(LM01、LM05、LM06、LM07、LM10、LM12、LM13、LM17等)的相对根长、相对苗长和相对生物量有所增加,这可能是因为种子在一定浓度的盐胁迫条件下,无机盐小分子在水溶液中可以解离为相应的离子,渗透进入细胞,降低细胞水势,控制种子的吸水速度,增加水分的吸收量,从而提高发芽整齐度、出苗速率[9]。随着盐浓度的增加,24个多花黑麦草种子相对发芽率、根长、苗长、生物量等指标迅速下降。大部分品种相对根长在盐溶液浓度达35.1mol/L以后迅速下降,在46.8mol/L以后,相对苗长和相对生物量迅速下降,而叶片相对含水量保持平稳下降。盐胁迫对多花黑麦草种子幼苗生长状况的影响大于对萌发的影响,对幼苗根系的影响大于对生物量的影响。这与王晓栋和石凤翎[10]、杨劲松[11]、芦翔等[12]的研究结果一致。生物量真实反映多花黑麦草在盐胁迫下维持生产的能力,本研究材料(LM03、LM10、LM11、LM12等)相对生物量在58.5 mol/L盐溶液浓度胁迫下仍保持在80%以上,表现出较强的耐盐性。王宝山等[13]、Xu[14]、祁淑艳和储诚山[15]认为盐胁迫导致植物生长量减少的原因主要是植物在细胞内主动积累有机化合物和蛋白类保护剂,以其维持高渗透压,保证植物在高盐条件下对水分的吸收,然而过多合成保护剂会使用于细胞生长的碳源减少,抑制植物的生长发育。另一方面,叶片含水量在一定范围内与光合作用成正相关,当叶片含水量不足时,叶片细胞膨压减小,叶片气孔减小或关闭,CO2的利用率降低,减少了植物生长的碳源,植株生物量的积累也随之减少。

表3 不同盐浓度对多花黑麦草幼苗相对生物量和叶片相对含水量的影响
4 结论
本研究采用NaCl直接对24个多花黑麦草品种种子处理,测定发芽率、苗长、根长、生物量等。24个多花黑麦草种质材料耐盐性鉴定表明,耐盐材料为LM05、LM07、LM10、LM20和LM23,盐敏感材料为LM03、LM08、LM09和LM16、LM03、LM11、LM22等耐盐性排名较低,但在高浓度盐胁迫下,其相对生物量仍保持较高水平,可对这些材料进一步研究挖掘。
[1] 刘小京,刘孟雨.盐生植物利用与区域农业可持续发展[M].北京:气象出版社,2002:1-9.
[2] 戴高兴,彭克勤,皮灿辉.钙对植物耐盐性的影响[J].中国农学通报,2003,19(3):97-101.
[3] 林栖凤.耐盐植物研究[M].北京:科学出版社,2004.
[4] Adele M,Maria R P,Maria S.Effects of salinity on growth,carbohydrate metabolism and nutritive properties of kikuyu grass (Pennisetum clandestinum Hochst)[J].Plant Science,2003,164:1103-1110.
[5] Sonali S,Arun L M.Insight into the salt tolerance factors of a wild halophytic rice,Porteresia coarctata:a physiological and proteomic approach[J].Planta,2009,229:911-929.
[6] 刘一明,程凤枝,王齐,等.四种暖季型草坪植物的盐胁迫反应及其耐盐阈值[J].草业学报,2009,18(3):192-199.
[7] 吐尔逊娜依,高辉远,安沙舟,等.8种牧草耐盐性综合评价[J].中国草地,1995(1):30-32.
[8] 沈艳,兰剑,谢应忠.NaC1对高羊茅萌发的胁迫效应研究[J].种子,2009,28(12):44-47.
[9] 张才喜,庄天明,谢黎君,等.NaC1胁迫对不同品种番茄种子发芽特性的影响[J].上海交通大学学报(农业科学版),1998,16(3):209-212.
[10] 王晓栋,石凤翎.17份红豆草种质材料种子萌发期耐盐性研究[J].种子,2008,27(7):38-41.
[11] 杨劲松.作物对不同盐胁迫和调控条件的响应特征与抗盐性调控研究[D].南京:南京农业大学,2006:82-91.
[12] 芦翔,汪强,赵惠萍,等.盐胁迫对不同燕麦品种种子萌发和出苗影响的研究[J].草业科学,2009,26(7):77-81.
[13] 王宝山,赵可夫,邹琦.作物耐盐机理研究进展及提高作物抗盐性的对策[J].植物学通报,1997,14:25-30.
[14] Xu Y L.Energy consumption in adaptability to salt stress of plant[J].Plant Physiology Communications,1990,26(6):54-55.
[15] 祁淑艳,储诚山.盐生植物盐渍环境的适应及其生态意义[J].天津农业科学,2005,11(2):42-45.

