Src介导NEDD4-1在调控胶质瘤U251细胞侵袭性作用中的研究
张家留,张 丰*,殷丽萍,于如同
(1.江苏省中西医结合医院,江苏南京 210028;2.徐州医学院附属医院)
胶质瘤是主要的颅内肿瘤之一,其预后不佳。探讨胶质瘤发生过程中增殖、侵袭的的分子病因学机制,以寻找相应的治疗靶点是临床和科研工作中的迫切需求[1]。黏着斑激酶(FAK)的激活,是肿瘤发生侵袭的重要机制,FAK通过增强整合素和生长因子介导的Ras-MAPK的通路活性,促进肿瘤细胞的转移。酪氨酸激酶Src是肿瘤早期出现的致癌性蛋白激酶,参与诸如细胞周期、增殖、细胞骨架形成、生长因子信号传递等诸多肿瘤生长相关机制[2,3]。Src与FAK关系密切,Src结合并激活FAK,而活化的FAK-Src复合物则通过底物磷酸化介导下游反应。抑癌基因PTEN能通过抑制黏着斑激酶(FAK)和酪氨酸激酶 Src的磷酸化,从而选择性Ras-MAPK通路[4,5]。但PTEN的泛素连接酶NEDD4-1(neural precursor cell expressed developmentally downregulated 4-1)的过表达能够下调PTEN的功能,从而促使肿瘤发生和转移[6]。
对于Src蛋白在NEDD4-1介导的胶质瘤在侵袭性的作用,目前尚无临床报道。本实验拟采用RNA干扰技术(RNAi),通过抑制Src在胶质瘤U251细胞系中的表达,探索其对下游信号分子蛋白的影响,进一步揭示Src在干扰胶质瘤细胞侵袭中的作用。
1 材料和方法
1.1 材料
本实验依托徐州医学院神经外科及神经生物学实验室(该实验室为SPF级重点实验室)。实验中的硬件及软件材料大部分由该实验室提供,其中实验中所需的U251细胞购自中国典型培养物保藏中心(武汉大学保藏中心)。所需的pcDNA3.1-NEDD4-1质粒由美国Memorial Sloan-Kettering肿瘤中心细胞生物学实验室提供。pGPU6/GFP/Neo-NEDD4-1质粒由本实验室构建、保存。pcDNA3.1-Src siNRA质粒均根据所查相关碱基序列购于上海吉凯基因化学技术有限公司。实验中所需的抗体:FAK(C-20)(Santa Cruz公司,Sc-558);FAK(phosphoY397)(Genetex公司,Gtx24803);山羊抗兔IgG抗体的二抗;小鼠抗人GAPDH单克隆抗体(上海吉凯化学技术公司)
1.2 方法
1.2.1 实验设计 实验分4组:(A)pcDNA3.1-空质粒转染组(B)pcDNA3.1-NEDD4-1组:U251转染pcDNA3.1-NEDD4-1,(C)pcDNA3.1-NEDD4-1+Src转染细胞组:U251转染NEDD4-1及Src,(D)Src siRNA组:U251转染pcDNA3.1-Src siRNA。最后通过Transwell细胞侵袭实验及划痕法迁移实验观察胶质瘤U251细胞侵袭情况。
1.2.2 ShRNA表达质粒的构建通过查询Src基因序列,利用Elbashir[7]等推荐的siRNA设计原则,寻找合适的siRNA靶序列。采用NCBIGenBank(美国国立医学图书馆和美国国立卫生研究院编写)提供的BLAST软件对选择的靶序列进行同源分析,排除siRNA非特异性地抑制其他基因片段的可能。采用Ambion公司的shRNA在线设计软件(www.ambion.com)设计可克隆入 pGPU6/GFP/Neo表达载体的shRNA,Src siRN的有效作用靶点:5′-AAGCTGTTCGGAGGCTTCAAC-3′(226-244 bp)购于上海吉凯基因化学技术有限公司。
1.2.3 试验中通过对该序列质粒DNA小量快速抽提后,并大量制备和纯化。然后质粒的稳定转染胶质瘤细胞。转染24 h后移除转染试剂,转染72 h后换完全培养基(1640,加10%的FBS,青霉素、链霉素各100 μ g/ml),分别于转染后1,3,5,7 d收集细胞检验目的基因的活性。最后通过Transwell细胞侵袭实验(参照Valster A,et al(2005).Cell migration and invasion assays.Methods37(2)208-215报道方法进行操作。在24孔板中放入转移培养皿(Transwell,培养皿直径6.5 mm,微孔径 8.0 μ m),转移培养下室加600 μ l含0.5%的胎牛血清(作为趋化因子)的DMEM。细胞用2 mmol/L EDTA消化、离心,收集并用无血清DMEM洗涤两次,重悬于无血清DMEM中,调节浓度至 2×105细胞/ml,取100 μ l细胞悬液加入上室,0.5%结晶紫染色5 min,在200倍显微镜下计数膜下细胞以膜下细胞的数量多少表示迁移能力。每组细胞进行3次独立实验。)及划痕法迁移实验(参照Valster A,et al(2005).Cell migration and invasion assays.Methods37(2),208-215报道方法进行操作。取80%汇合的细胞,胰蛋白酶消化后以1.2×105个细胞/孔接种于包被有Fn的6孔培养板上,贴壁12 h后换无血清培液培养24 h,细胞基本汇合。用无菌1 ml枪头垂直在培养板底划平行、垂直的4对‖划痕,无血清培液冲洗若干次,以洗去被划下的细胞。于指定时间点在显微镜下从划痕边缘迁移出的细胞,每组设双复孔,反复进行3次独立实验。)观察胶质瘤U251细胞侵袭情况。
1.2.4 数据处理
用于分析统计的软件有sigmastat3.0、spss14.0,实验数据以均数±标准差(¯x±s)表示。统计分析采用单因素方差分析(ANOVA),多个实验组与一个对照组比较采用最小显著差法(LSD),实验组之间比较采用q检验(Newman-keuls test)(P<0.05为差异有统计学意义)。
2 结果
2.1 Src shRNA表达质粒的鉴定
将重组Src shRNA表达质粒转化感受态DH5α,提取的质粒用BamHⅠ和PstⅠ内切酶分别单酶切。PstⅠ酶切结果显示有2条带,一条为超螺旋的SC构型,一条为质粒的松弛开环的OC构型。重组体被BamHⅠ单酶切而线性化,条带大小为232 bp。送目的质粒DNA由上海吉凯生物技术公司完成测序,T3 启 动 子 引 物 5′-AAGCTGTTCGGAGGCTTCAAC-3′(226-244 bp),结果显示插入序列与设计的shRNA碱基序列完全一致,无突变(图1)。
2.2 重组质粒对U251胶质瘤细胞的影响
U251细胞转染48 h后,Src siRNA组与空对照组相比,RT-PCR测得Src表达明显下降,Src+NEDD4-1组Src表达增强,而NEDD4-1组几乎无太大的变化。实验组Src shRNA组,Src+NEDD4-1组却变化较大。并且Src shRNA水平的下调影响其本身以及NEED4-1的表达(图1)。
2.3 Western blot分析U251细胞中Src蛋白的表达结果
Western blot方法检测胶质瘤细胞U251中Src的表达情况发现其Src较正常胶质细胞表达增加。实验结果显示,Src蛋白激酶被RNA干扰后的U251胶质瘤细胞和未干扰的U251细胞相比,出现了明显的G1/S期的阻滞及凋亡率的上升。同时,Src蛋白表达缺失。而Src+NEDD4-1组转染质粒组Src蛋白表达在各组中最强。ND4组变化不大(图2)。
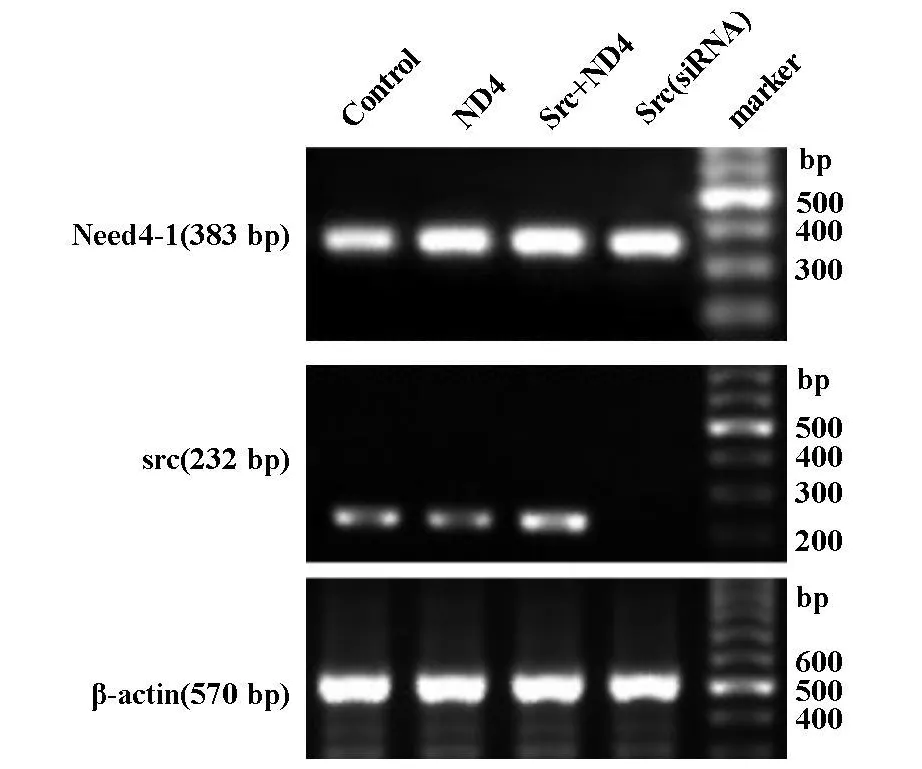
图1 Src shRNA ND4表达质粒的PCR及酶切鉴定
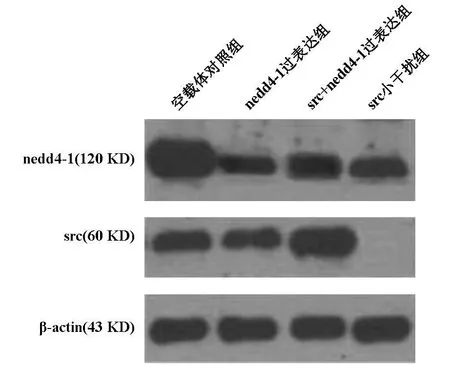
图2 转染后Western Blot结果分析
2.4 Src介导NEDD4-1引起的胶质瘤细胞迁移、侵袭性的变化
应用划痕法测定转染的四组在U251细胞中迁移能力的变化(图3-5)。实验结果显示:转染Src+ND4组16 h后向划痕内迁移的细胞侵袭距离较其他各组呈明显增强趋势,而转染 shRNA质粒的U251细胞16 h后向划痕内迁移的细胞侵袭距离较其他各组明显降低。这一发现提示Src shRNA抑制胶质瘤细胞迁移能力的作用中扮演关键的开关角色(如表1)。
表1 转染各组胶质瘤细胞侵龚距离(±s)
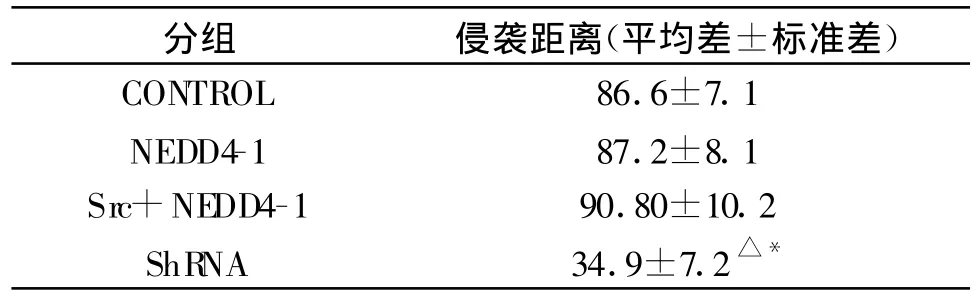
表1 转染各组胶质瘤细胞侵龚距离(±s)
干扰组与控制组比较,△P<0.5,干扰组与Src+ND4组间比较,*P<0.1
分组 侵袭距离(平均差±标准差)CONTROL 86.6±7.1 NEDD4-1 87.2±8.1 Src+NEDD4-1 90.80±10.2 ShR NA 34.9±7.2△*

图3 Src介导下胶质瘤细胞迁移能力的变化
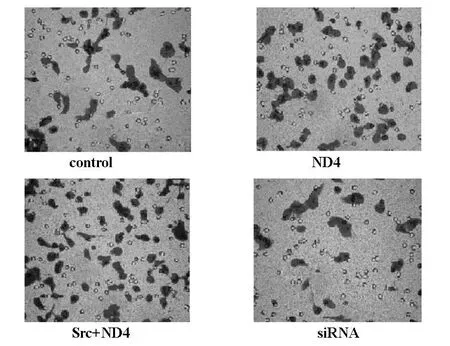
图4 T ranswell细胞侵袭实验分析细胞侵袭能力的变化
进一步用Transwell细胞侵袭实验分析细胞侵袭能力的变化。实验结果显示,转染Src与NEDD4-1质粒在U251细胞的细胞侵袭性较转染空载体对照组明显增强。可以看出NEDD4-1与Src质粒的转染可以促进胶质瘤细胞的侵袭性,而在Src shRNA则通过抑制Src的作用进而抑制U251细胞的侵袭性。

图5 Src介导下胶质瘤细胞迁移、侵袭性的变化
3 讨论
我们在表达Src shRNA重组载体构建成功的基础上,对其抑制胶质瘤细胞中Src基因表达的效果进行检测,并观察Src基因表达下降对胶质瘤细胞生物学特征的影响。
从Transwell细胞侵袭实验结果分析细胞侵袭能力的变化看出:转染的Src+NEDD4-1质粒细胞组U251细胞侵袭性较其他各组明显增强,而Src shRNA通过抑制Src的活性进而抑制胶质瘤U251细胞的侵袭性。同时,应用划痕法测定转染的四组细胞中迁移变化得出的结果与Transwel实验相符。可以看出Src+NEDD4-1质粒转染可以促进胶质瘤细胞的侵袭性。
Western blot实验表明胶质瘤U251细胞系中Src蛋白的正常表达(见图2)。应用Src酪氨酸激酶抑制剂shRNA抑制U251细胞中Src酪氨酸激酶活化,能够抑制Src的表达;相反,NEDD4-1+Src组与其他三组相比Src蛋白表达明显增强[8]。
同时大量的文献发现Src还作用于整合素依赖性粘附、细胞骨架肌动蛋白重排以及整合素基因表达调节及信号传导机制中的二级分子[9]。各种体内外实验也证实Src肿瘤增值有促进作用。对编码无激酶活性形式的Src的DNA进行显微注射,或是压制识别Src末端保守序列的抗体,都能抑制由GEF,PGDF和CSF诱导的DNA合成。此外,无活性的激酶或是缺少结构域的Src突变体在Src的成纤维细胞中的表达,也能阻断PGDF诱导的DNA合成。Src的SHZ域是与PDGF受体结合所必需的;SH3域突变的Src突变体干扰了由PDGF和GEF所诱导的NDA合成,证明SH3域在这些生长因子诱导的DNA合成中有重要作用[10]。
与人胶质瘤发生发展相关基因的研究进展较快,依据胶质瘤细胞分化障碍、胶质瘤恶性进展发生情况,已明确的基因包括KRa,Ink4a-Arfs,PDGF,RB,TP53等[11],尚未涉及到与Src的关系。本研究选择Src作为靶基因,原因是它在神经节胶质细胞瘤恶变成多形性胶质母细胞瘤过程中,随恶性程度增高而表达增加。从目前胶质瘤起源细胞的研究进展来看,这类肿瘤细胞来源于神经元和胶质细胞的共同前体细胞,即神经干/祖细胞的可能性很大[12]。而我们在人胎脑来源的神经干/祖细胞体外分化过程中又发现了它随细胞分化程度增高而表达量下降。而Src在胶质瘤体外细胞系高表达,并随恶性程度增高表达增高[13]。
Src蛋白激酶功能复杂,已经明确的是机体细胞有丝分裂过程中起G1-S期的关键作用[14-15],细胞无论是走进还是走出分裂周期都需要它的参与。在G1后期Src与cyclinB1结合形成有丝分裂促进因子(MPF),它的高表达是肿瘤细胞无限增殖的源动力,已在多种肿瘤中检测到它的高表达[16-17]。Src高表达还可以通过纺锤体检查点的改变,促进癌细胞染色体的不稳定性[18],因此它又是肿瘤异质性和恶性进展的根源。我们在人脑胶质瘤U251培养的细胞转染稳定表达Src shRNA的重组的实验结果表明,肿瘤细胞Src被表达干扰后,其侵袭能力显著下降,增殖周期阻滞在G1/S期,凋亡比例增加。由此以反证法证明了Src在胶质瘤发生发展过程中起重要作用和作为病因分子的潜在靶基因治疗的价值。
综上所述,本研究对Src在胶质瘤中的表达、分布以及Src在NEDD4-1发挥作用过程中的角色及其下游信号分子进行了初步研究揭示了:NEDD4-1通过Src在细胞的凋亡、肿瘤的发生及其侵袭性过程中发挥着重要作用。做为Src的抑制剂Src shRNA在人脑胶质瘤中的表达及对肿瘤细胞生长、侵袭作用可能成为胶质瘤治疗的又一靶点。而更为重要的是对NEDD4-1基于Src引发的一系列信号转导通路的研究则可能进一步发现胶质瘤发生、发展、侵袭的生物学信息,为最终揭示其生长、侵袭的机制提供依据。
[1]Blume-Jensen P,HunterT.Oncogenic kinase signalling[J].Nature,2001,411(6835):355.
[2]GrandisJR,Chakraborty A,Zeng Q,MelhemMF,Tweardy DJ.Dow nmodulation of TGF-alpha protein expression with antisense olig on ucl eotides inhibits proliferation of head and neck squamous carcinoma but not normal mucosal epithelial cells[J].J Cell Biochem,1998,69(1):55.
[3]Nicholson RI,Gee JM,Harper ME.EGFR and cancer prognosis[J].Eur J Cancer,2001,37(Suppl.4):S9.
[4]Tandon AK,Clark GM,Chamness GC UllrichA,McGuireWL.HER-2/neuoncogene protein and prognosis in breast cancer[J].J Clin Oncol,1989,7:1120.
[5]Meden H,Kuhn W.Overexpression of the oncogene c-erbB-2(HER2/neu)in,ovarian cancer:a new prognostic factor[J].Eur J Obstet Gynecol Reprod Biol,1997,71:173.
[6]Sadasivan R,Morgan R,Jennings S,Austenfeld,et al.Over-expression of Her-2/neu may be an indicator of poor prognosis in prostate cancer[J].J Urol,1993,150:126.
[7]Selvaggi G,Scagliotti GV,Torri V,Novello S,Leonardo E,Cappia S,et al.HER-2/neu overexpression in patients with radically resected nonsmall cell lung carcinoma.Impact on long-term survival[J].Cancer,2002,94:2669.
[8]王忠诚主编.王忠诚神经外科学[M].武汉:湖北科学技术出版社,2005:497-537.
[9]Wang X,Trotman L C,Koppie T,et al.NEDD4-1 is a proto-oncogenic ubiquitin ligase for PTEN[J].Cell,2007,128(1):129.
[10]Trotman L C,Wang X,Alimonti A,et al.Ubiquitination regulates PTEN nuclear import and tumor suppression[J].Cell,2007,128(1):141.
[11]Kim R H,Peters M,Jang Y,et al.DJ-1,a novel regulator of the tumor suppressor PTEN[J].Cancer Cell,2005,7(3):263.
[12]Odriozola L,Singh G,Hoang T,et al.Regulation of PTEN activity by its carboxyl-terminal autoinhibitory domain[J].J Biol Chem,2007,226.
[13]Wu D N,Pei D S,Wang Q,et al.Down-regulation of PTEN by sodium orthovanadate inhibits ASK1 activation via PI3-K/AKT during cerebral ischemia in rat hippocampus[J].Neurosci Lett,2006,404(1-2):98.
[14]Raftopoulou M,Etienne-manneville S,Self A,et al.Regulation of cell migration by the C2 domain of the tumor suppressor PTEN[J].Science,2004,303(5661):1179.
[15]Zhou J,SchmidT,FrankR,el al.PI3K/AKTis requiredforheat shock proteins to protect hypoxia—inducible factor l ctfrom PVHL—indepe ndent degradation[J].J Biof Chem,2004,279(14):13506.
[16]Alvarez-Tejado M,A1franca A,Aragones J,el al.Lack ofevidence forthe involvement of the phosphoinositide 3-kinase/AKT pathway in the activation of hypoxia—inducible factors by low oxygen tension[J].J Biol Chem,2002,277(16):13508.
[17]Lapidot T,Sirard C,Vormoor J,et al.A cell initiating human acute myeloid leukaemia after transplantation into SCID mice[J].Nature,1994,367(6464):645.
[18]onnet D,Dick J E.Human acute myeloid leukemia is organized asa hierarchy thatoriginates from a primitive hematopoietic cell[J].Nature Med,1997,3(7):730.

