非小细胞肺癌患者血清CDH13基因甲基化检测及意义
鲁德玕 刘伟 姬晓青 刘姝梅
聊城市人民医院呼吸科,*中心实验室,山东 聊城 252000
肺癌是全世界范围内首位肿瘤死因。由启动子异常甲基化造成的特定基因的沉默在肺癌发病机制中起重要作用。钙黏附素(cadherin)是调整上皮表型和肿瘤侵袭力的细胞黏附分子[1]。CDH13是cadherin家族的成员之一,是一个候选抑癌基因,在人类多种肿瘤中因启动子甲基化而沉默。在前列腺癌[2]、睾丸生殖细胞肿瘤[3]等的发生、发展中起重要作用。非小细胞肺癌(non-small cell lung cancer,NSCLC)患者支气管灌洗液中的研究表明,CDH13肿瘤特异性甲基化可能是NSCLC的一个早期诊断有价值的标记[4]。鲜有肺癌患者血清中 CDH13甲基化的研究。甲基化特异性聚合酶链反应(methylation-specific polymerase chain reaction,MSP)是一种应用最广泛的测定甲基化水平的方法。MSP只需要少量的DNA,可检测出给定的CpG岛0.1%的等位基因甲基化[5]。本研究采用MSP法检测NSCLC患者外周血清中CDH13基因的甲基化状态,分析其与临床病理之间的相关性,探讨其临床意义。
1 资料和方法
1.1 研究对象
2007年9月5日—2008年12月20日本院呼吸内科住院治疗的62例NSCLC患者为研究对象,其中男性40例,女性22例;年龄42~75岁,中位年龄62岁。所有患者均经组织病理学证实,其中鳞癌27例,腺癌35例,均未行放化疗。TNM分期[6]:Ⅰ期1例,Ⅱ期10例,Ⅲ期24例,Ⅳ期27例。肺部良性疾病患者系我院呼吸内科同期住院治疗的30例患者,男性18例,女性12例;年龄45~74岁,中位年龄59岁;其中肺部感染8例,慢性阻塞性肺疾病15例,气胸7例。16名健康志愿者为我院体检中心体检者。男性10例,女性6例;年龄46~68岁,中位年龄59岁。3组性别(χ2=0.18,P>0.05)和年龄(方差分析,F=1.05,P>0.05)间差异无统计学意义,具有可比性。
1.2 方法
1.2.1 标本采集
所有患者均于确诊后、手术或放化疗前凌晨空腹采集外周静脉血5 mL,健康体检者血液标本由我院体检中心提供。标本4 ℃静置2 h,3 000 r/min离心10 min(离心半径10 cm),留取血清,将血清标本置-80 ℃保存。
1.2.2 血清DNA提取
采用QIAamp Blood Mini Kit DNA抽提试剂盒(QIAGEN公司,德国)提取血清DNA。每份标本使用2 mL血清,按照说明成比例地增大所需的反应试剂用量,多次过离心柱,最后以50μL灭菌去离子水洗脱DNA,-80 ℃保存。
1.2.3 亚硫酸氢钠修饰
参照Zinn等[7]的方法,对所提取的血清DNA进行亚硫酸氢钠修饰,将DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U)。
1.2.4 DNA纯化及脱磺基反应
在提取所得的DNA中,加入1 μg鲑鱼精DNA(Sigma公司产品)作为载体,以终浓度为0.3 mol/L的NaOH于40 ℃反应15 min变性解链,依次加入新鲜配制的对苯二酚(Sigma公司产品)30 μL和pH为5.0的NaHSO3(Sigma公司产品)520 μL,轻柔混匀,以石蜡油覆盖,55 ℃避光反应14 h。吸除石蜡油,采用美国 Promega公司生产的Wizard DNA Clean-Up System 提纯DNA,以终浓度为0.3 mol/L的NaOH于室温处理10 min脱硫,最后冷乙醇沉淀,所得DNA 溶于30μL灭菌去离子水中,-80 ℃保存。
1.2.5 甲基化特异性PCR
参照文献[8]设计CDH13引物,分别识别甲基化特异性(M)和非甲基化特异性序列(U)。CDH13具体序列,M正义引物:5’-TCGCGGGGTTCGTTTTTCGC-3’,M反义引物:5’-GACGTTTTCATTCATACACGCG-3’;扩增产物大小:243 bp。U正义引物:5’-TTGTGGGGTTGTTTTTTGT-3’,U反义引物:5’-AACTTTTCATTCATACACACA-3’;扩增产物大小:243 bp。
PCR反应体系20 μL,其中去离子水14.95 μL,10×PCR缓冲液2 μL,MgCl2(25 mmol/L)1.2 μL,dNTPs(10 mmol/L)0.25 μL,上下游引物各0.2 μL(25 pmol),修饰后的DNA模板1 μL,Taq DNA聚合酶(10 U/μL)0.2μL,充分混匀后置DNA扩增仪中扩增。反应条件为:95 ℃预变性5 min,94 ℃变性30 s、64 ℃(甲基化)、56 °C(非甲基化)退火30 s、72 ℃延伸30 s,共44个循环,最后72 ℃终延伸5 min[9]。
取扩增产物5 μL行2%的琼脂糖凝胶电泳(10 V/CM,20 min),溴化乙啶染色后凝胶成像系统拍照。以正常人外周血淋巴细胞DNA作为非甲基化阳性对照,过量CpG(Sss Ⅰ)甲基化酶(美国NEB公司产品)修饰的淋巴细胞DNA作为甲基化阳性对照,水空白代替DNA作为阴性对照。
1.3 统计学处理
定量资料采用t检验,分类资料采用χ2检验。P<0.05为差异有统计学意义。统计学分析在SPSS 12.0版软件包上完成。
2 结 果
2.1 血清CDH13基因启动子区甲基化检测结果
62例NSCLC患者中,有23例患者血清DNA CDH13基因甲基启动子区域CpG岛发生了甲基化,检出率为37.1%,而良性肺部疾病患者和健康体检者血清未检出CDH13基因甲基化,差异有统计学意义(χ2=14.84,P<0.01,图1)。
2.2 CDH13基因启动子区甲基化状态与临床病理的相关性
NSCLC患者血清CDH13基因甲基化状态与性别、年龄、病理类型和吸烟状况无明显相关(P>0.05)。CDH13甲基化率在TNM Ⅲ~Ⅳ期(43.14%,22/51)高于Ⅰ~Ⅱ期(9.10%,1/11),差异无统计学意义(χ2=1.14,P>0.05),低、未分化组显著高于高、中分化组(χ2=4.72,P<0.05,表1)。
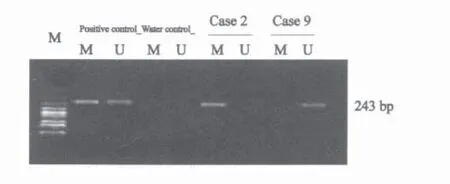
图1 NSCLC患者血清CDH13基因甲基化检测电泳图Fig.1 Gel electrophoresis of CDH13 gene methylation in serum of NSCLC patients
3 讨 论
DNA甲基化是基因修饰的重要方式,真核生物DNA的甲基化位点主要是CpG岛中的胞嘧啶(C)。在肿瘤中,尽管全局上呈现低甲基化,但是在CpG岛区域基因组是高甲基化的,且常常与启动子相关。CpG岛区域启动子甲基化是肿瘤相关抑癌基因的一种主要的失活机制[10],与一些肿瘤的演变直接相关。
Cadherin家族是一组钙依赖性糖蛋白,广泛分布于各种类型的细胞表面,和肿瘤的侵袭与转移密切相关。CDH13是cadherin家族中的一个非典型成员,缺少跨膜区域,通过甘油磷酸肌醇位点锚定于细胞膜的外表面,主要利用其信号蛋白影响分子行为,在肿瘤细胞中表达常常下调。CDH13基因位于人染色体16q24.2-3,在肺癌和乳腺癌中,其异常甲基化伴随基因表达缺失[11]。在诸如肺癌、卵巢癌、宫颈癌和前列腺癌等不同肿瘤中CDH13表达下调与不良预后有关。CDH13在大多数肿瘤细胞株中重新表达可抑制肿瘤细胞增殖和侵袭力,增加对凋亡的易感性,在体内减慢肿瘤生长[12]。CDH13表达缺失在NSCLC中经常出现,有助于肿瘤的局部生长和种植[13]。CDH13在不同肿瘤中常常因启动子甲基化而失活,启动子区域CpG岛的甲基化是导致 CDH13基因失活的主要机制。
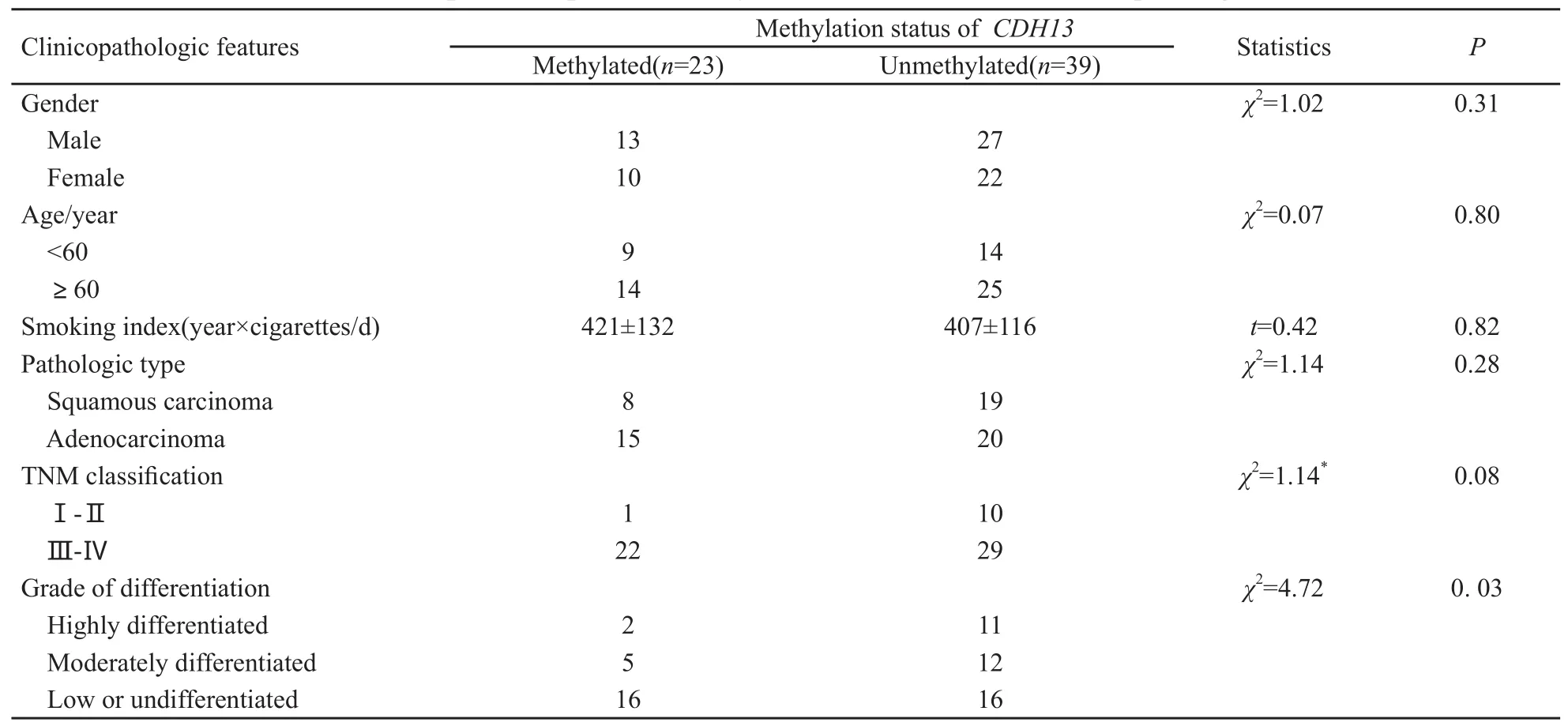
表1 CDH13基因启动子区甲基化状态与临床病理特征的关系Tab.1 Relationship between promoter methylation status of CDH13 and clinicopathologic features
研究表明,肿瘤患者外周血中存在一定数量的DNA,并且含量远高于正常人,可能来源于肿瘤细胞坏死释放[14]。从外周血中提取并且作为肿瘤DNA的代表,在肿瘤相关的分子生物学研究方面开启了一个新的领域。血清易于取得,因此是理想的DNA 甲基化检测标本。MSP法是一项应用最广泛的检测甲基化水平的技术,常规MSP的灵敏度可达1∶2 000。本研究发现,NSCLC患者血清中CDH13基因甲基化检出率为37.1%,提示CDH13基因甲基化在NSCLC患者血清中经常出现,CDH13基因甲基化及随之而来的CDH13表达缺失是NSCLC的常见事件。由于在肺部良性疾病患者和健康体检者外周血血清中未检测到CDH13基因启动子甲基化,因此,NSCLC患者外周血清中CDH13基因启动子甲基化具有肿瘤特异性。CDH13甲基化作为一个新的NSCLC肿瘤标记,有望成为启动子甲基化框架内有价值的筛选NSCLC的标志。
既往利用NSCLC切除标本检测CDH13甲基化状况的研究报道,肿瘤组织中CDH13甲基化率为29.5%~66%[1,15],均高于本研究结果,可能与组织中DNA数量大于血液有关。Ulivi等[16]检测NSCLC患者血清中CDH13基因甲基化率为23%,低于本研究结果,可能与病例选择和(或)种族差异有关。Hsu等[17]研究显示,肺癌组织与相应血清DNA中CDH13基因甲基化检测结果是一致的。Rykova等[18]认为,血清中CDH13甲基化检测可以用于肺癌的早期诊断。采用外周血提取DNA研究目标基因的甲基化状况,方法基本无创,简单易行,患者易于接受,如果能得到进一步证实,那么外周血中基因甲基化的检测有望成为肺癌早期诊断的重要辅助手段。
本研究进一步比较了NSCLC患者血清CDH13基因甲基化检出率与临床特征的关系,发现NSCLC患者血清CDH13基因甲基化状况与患者性别、年龄、病理类型和吸烟状况无关,低、未分化组检出率显著高于高、中分化组,提示CDH13基因甲基化可能与NSCLC恶性程度有关。肺癌恶性程度高,侵袭力强,易于复发,患者生存期短。Kubo等[19]研究100例支气管肺泡癌标本发现,CDH13 在侵袭性类型的甲基化率明显高于非侵袭性类型。Brock等[20]发现,Ⅰ期NSCLC外科手术切除患者CDH13启动子区域的甲基化和早期复发有关。Yanagawa等[21]用MSP法检测101例NSCLC肿瘤切除组织CDH13启动子甲基化状况,和CDH13甲基化阴性组相比,阳性组患者生存期更短。癌细胞粘附力的降低是肺癌细胞侵袭转移的机制之一。启动子甲基化造成的CDH13表达下降,导致维持细胞间同质型粘附的黏附分子表达下降,可能是NSCLC侵袭转移的重要原因之一。Feng等[22]认为,检测CDH13在血液中的甲基化状况可能用于NSCLC患者早期术后复发的监测。虽然患者CDH13基因甲基化率在Ⅲ~Ⅳ期明显高于Ⅰ~Ⅱ期,但尚无统计学意义,与Ulivi等[16]在肺癌组织和相应血清中的研究结论相似。提示CDH13基因甲基化可能在NSCLC早期即已发生,在病情加重过程中持续存在并逐渐进展。Kim等[23]研究305例NSCLC石蜡标本CDH13甲基化状况,其甲基化率为43%,并且与病理分期有关,病理分期越晚,阳性率越高。因此,CDH13甲基化可能和NSCLC进展有关。众所周知,吸烟是肺癌的危险因素之一,也与DNA甲基化有关[24]。本研究中,CDH13甲基化组和非甲基化组吸烟指数无差异,尚无明确的解释,可能与病例选择有关,也可能系除吸烟以外的致癌因素诱导了分子变化而致。
总之,NSCLC患者外周血中CDH13基因的甲基化检出率较高。CDH13基因异常甲基化可能在NSCLC发生、发展中起重要作用,有望成为NSCLC辅助诊断分子标记,CDH13也许能成为NSCLC的一个可能的治疗靶点。有必要进行进一步的研究评估。
[1] KIM D S, KIM M J, LEE J Y, et al. Aberrant methylation of E-cadherin and H-cadherin genes in non-small cell lung cancer and its relation to clinicopathologic features[J].Cancer, 2007, 110(12): 2785-2792.
[2] THOMAS G, JACOBS K B, YEAGER M, et al. Multiple loci identified in a genome-wide association study of prostate cancer[J]. Nat Genet, 2008, 40(3): 310-315.
[3] HONORIO S, AGATHANGGELOU A, WERNERT N, et al.Frequent epigenetic inactivation of the RASSF1A tumour suppressor gene in testicular tumours and distinct methylation profiles of seminoma and nonseminoma testicular germ cell tumours[J]. Oncogene, 2003, 22(3): 461-466.
[4] KIM H, KWON Y M, KIM J S, et al. Tumor-specific methylation in bronchial lavage for the early detection of nonsmall cell lung cancer[J]. J Clin Oncol, 2004, 22(12):2363-2370.
[5] HERMAN J G, GRAFF J R, MYÖHÄNEN S, et al.Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J]. Proc Natl Acad Sci U S A, 1996,93(18): 9821-9826.
[6] WATANABE Y. TNM classification for lung cancer[J].Ann Thorac Cardiovasc Surg, 2003, 9(6): 343-350.
[7] ZINN R L, PRUITT K, EGUCHI S, et al. hTERT is expressed in cancer cell lines despite promoter DNA methylation by preservation of unmethylated DNA and active chromatin around the transcription start site[J]. Cancer Res, 2007,67(1): 194-201.
[8] TOYOOKA K O, TOYOOKA S, VIRMANI A K, et al.Loss of expression and aberrant methylation of the CDH13(H-cadherin) gene in breast and lung carcinomas[J].Cancer Res, 2001, 61(11): 4556-4560.
[9] ULIVI P, ZOLI W, CALISTRI D, et al. p16INK4A and CDH 13 hypermethylation in tumor and serum of non-small cell lung cancer patients[J]. J Cell Physiol, 2006, 206(3): 611-615.
[10] YOSHINO M, SUZUKI M, TIAN L, et al. Promoter hypermethylation of the p16 and Wif-1 genes as an independent prognostic marker in stage ⅠA non-small cell lung cancers[J]. Int J Oncol, 2009, 35(5): 1201-1209.
[11] TOYOOKA K O, TOYOOKA S, VIRMANI A K, et al.Loss of expression and aberrant methylation of the CDH13(H-cadherin) gene in breast and lung carcinomas[J].Cancer Res, 2001, 61(11): 4556-4560.
[12] ANDREEVA A V, KUTUZOV M A. Cadherin 13 in cancer[J]. Genes Chromosomes Cancer, 2010, 49(9): 775-790.
[13] ZHONG Y, DELGADO Y, GOMEZ J, et al. Loss of H-cadherin protein expression in human non-small cell lung cancer is associated with tumorigenicity[J]. Clin Cancer Res, 2001,7(6): 1683-1687.
[14] WIDSCHWENDTER M, MENON U. Circulating methylated DNA: a new generation of tumor markers[J]. Clin Cancer Res, 2006, 12(24): 7205-7208.
[15] WANG Y, ZHANG D, ZHENG W, et al. Multiple gene methylation of non-small cell lung cancers evaluated with 3-dimensional microarray[J]. Cancer, 2008, 112(6):1325-1336.
[16] ULIVI P, ZOLI W, CALISTRI D, et al. p16INK4A and CDH13 hypermethylation in tumor and serum of non-small cell lung cancer patients[J]. J Cell Physiol, 2006, 206(3): 611-615.
[17] HSU H S, CHEN T P, HUNG C H, et al. Characterization of a multiple epigenetic marker panel for lung cancer detection and risk assessment in plasma[J]. Cancer, 2007, 110(9):2019-2026.
[18] RYKOVA E Y, SKVORTSOVA T E, LAKTIONOV P P,et al. Investigation of tumor-derived extracellular DNA in blood of cancer patients by methylation-specific PCR[J].Nucleosides Nucleotides Nucleic Acids, 2004, 23(6-7): 855-859.
[19] KUBO T, YAMAMOTO H, ICHIMURA K, et al.DNA methylation in small lung adenocarcinoma with bronchioloalveolar carcinoma components[J]. Lung Cancer,2009, 65(3): 328-332.
[20] BROCK M V, HOOKER C M, OTA-MACHIDA E, et al. DNA methylation markers and early recurrence in stage Ⅰ lung cancer[J]. N Engl J Med, 2008, 358(11): 1118-1128.
[21] YANAGAWA N, TAMURA G, OIZUMI H, et al. Promoter hypermethylation of RASSF1A and RUNX3 genes as an independent prognostic prediction marker in surgically resected non-small cell lung cancers[J]. Lung Cancer,2007, 58(1): 131-138.
[22] FENG Q, HAWES S E, STERN J E, et al. DNA methylation in tumor and matched normal tissues from non-small cell lung cancer patients[J]. Cancer Epidemiol Biomarkers Prev,2008, 17(3): 645-654.
[23] KIM J S, HAN J, SHIM Y M, et al. Aberrant methylation of H-cadherin (CDH13) promoter is associated with tumor progression in primary non-small cell lung carcinoma[J].Cancer, 2005, 104(9): 1825-1833.
[24] HERCEG Z. Epigenetics and cancer: towards an evaluation of the impact of environmental and dietary factors[J].Mutagenesis, 2007, 22(2): 91-103.

