组蛋白去乙酰化酶抑制剂MS-275在体外抑制胃癌细胞的实验研究
刘瑾 任亚婵 吴智群
1.西北大学生命科学学院,陕西 西安 710069;2.第四军医大学附属唐都医院介入放射科,陕西 西安,710038
胃癌是消化道最常见的恶性肿瘤,其死亡人数在我国居恶性肿瘤的首位[1],每年约有17万人死于胃癌。手术对早期胃癌有较好的疗效,但对中晚期的胃癌疗效欠佳。由于化疗和放疗对胃癌的有效率均较低,因此,寻找不良反应小,疗效好的肿瘤靶向治疗药物已经成为肿瘤治疗研究的热点。
近年来,研究发现组蛋白的乙酰化和去乙酰化在基因的表达调控中起着非常重要的作用,组蛋白乙酰化和去乙酰化的紊乱与癌症的发生密切相关[2]。进一步研究证实,组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACis)能够诱导肿瘤细胞分化、生长抑制及凋亡[3],已经成为一种抗癌新药受到越来越多的关注,MS-275就是众多HDACis之一。MS-275是一种合成的苯甲酰胺衍生物,能显著抑制HDAC1(IC50=300 nmol/L)和HDAC3(IC50=8 μmol/L),对HDAC8(IC50>100 μmol/L)抑制效果不佳。MS-275对肿瘤细胞作用强,不良反应相对较小,且在人体内稳定性好,并且MS-275可以通过微芯生物设计合成,还可通过口服途径给药,具有较好的临床应用前景[4]。本研究旨在研究MS-275对胃癌细胞及正常细胞的作用,以期阐明MS-275对胃癌细胞的选择性杀伤作用,为临床的应用提供理论依据。
1 材料和方法
1.1 材料
MS-275购于美国Merck公司,SGC-7901(人胃低分化腺癌)细胞由第四军医大学细胞生物中心提供,GES-1(人正常胃黏膜细胞)和张氏肝细胞(CHANG-LIVER)购于博慧斯生物公司,RPMI1640培养液及胰蛋白酶购于Hyclone公司,胎牛血清购于美国GIBCO公司,二甲基亚砜(DMSO)购于Sigma公司,TUNEL检测试剂盒(in situ cell death detection kit,POD)购于Roche公司;Cell Proliferation Reagent WST-1购于碧云天生物技术公司。
1.2 细胞培养
SGC-7901和张氏肝细胞用含10%胎牛血清、100 mg/mL链霉素、100 U/mL青霉素的RPMI1640培养基在37 ℃、CO2体积分数为5%的培养箱中培养;GES-1用含10%胎牛血清、100 mg/mL链霉素、100 U/mL青霉素的DMEM高糖培养基在37 ℃,CO2体积分数为5%的培养箱中培养。
1.3 MS-275对SGC-7901细胞生长影响的检测
取对数生长期的SGC-7901细胞,用胰酶消化后吹打成单细胞悬液,以1×104mL-1的密度接种于96孔板,每孔100 μL,共接种5块96孔板,以不含细胞的培养基为空白对照。待24 h细胞完全贴壁后,加入MS-275,终浓度设置1、2、4和8 μmol/L的浓度梯度,每个 浓度3个平行孔,对照组不加MS-275。每24 h取出一块96孔板,每孔加WST-1 10 μL,37 ℃温箱中温育4 h后酶标仪450 nm测定吸光值(D),以 空白对照孔调零 ,根据吸光值结果计算:肿瘤细胞生长抑制率(%)=(1-D实验组/D对照组)×100%。
1.4 流式细胞术检测细胞凋亡
将贴壁良好的细胞用无血清培养基同步化24 h,经一定浓度MS-275处理48 h,对照组细胞为同样条件下的不加药细胞。收集处理组和对照组细胞,控制密度在1×106mL-1左右,PBS清洗2次,加入190 μL Annexin V缓冲液,再加入10 μL Annexin V-FITC(20 μg/mL),混匀,室温温育10 min,1 000 r/min离心5 min,弃上清,加入190 μL Annexin V-FITC缓冲液,再加入10 μL PI(20 μg/mL) 轻轻混匀,冰浴避光放置,用流式细胞仪检测凋亡细胞。
1.5 TUNEL实验
按照Roche公司POD的操作说明进行操作实验。
1.6 统计学处理
2 结 果
2.1 MS-275对SGC-7901细胞的生长抑制作用
一定浓度的MS-275对SGC-7901细胞具有生长抑制作用,且这种抑制作用呈时间和剂量依赖性。处理时间越长,浓度越高,抑制作用越明显。与阴性对照组相比,差异有统计学意义(P<0.05,表1)。
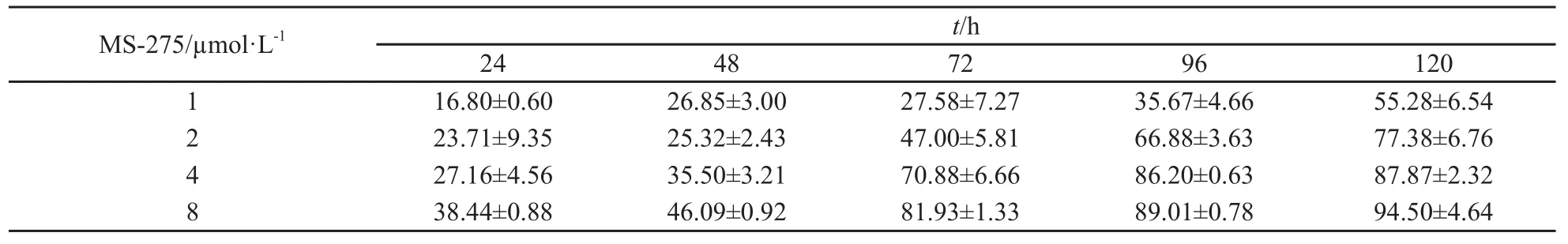
表1 不同浓度的MS-275给药不同时间后对SGC-7901细胞的生长抑制作用Tab.1 The inhibition of different concentration of MS-275 on cell growth of SGC-7901 cell in different time(n=3)
2.2 MS-275对SGC-7901细胞及正常细胞的凋亡诱导作用
设不加MS-275的对照组、1和4 μmol/L MS-275处理48 h的SGC-7901细胞和正常细胞,流式细胞仪检测凋亡情况,SGC-7901细胞的凋亡率分别为2.7%、7.5%和38.1%(图1);正常细胞GES-1的凋亡率分别为0.63%、0.43%和1.06%(图2);张氏肝细胞的凋亡率分别为1.47%、2.97%和2.85%(图3)。一定浓度MS-275(2 μmol/L)分别处理SGC-7901细胞24、48和72 h后,流式细胞仪检测凋亡情况,SGC-7901细胞的凋亡率分别为3.5%、21%和5 8.5%(图4)。

图1 MS-275对SGC-7901细胞凋亡的作用呈剂量依赖性Fig.1 Apoptosis in SGC-7 901 cell induced by MS-275 is a concentration-dependent mode
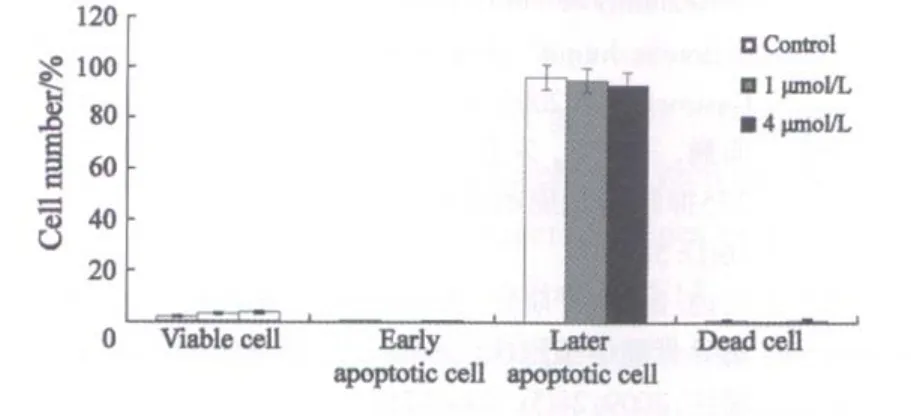
图2 MS-275对人正常胃黏膜细胞GES-1的作用Fig.2 The effect on human normal gastric mucosal cell GES-1 after treated by MS-275
2.3 TUNEL实验观察发生凋亡的细胞
2 μmol/L MS-275处理SGC-7901细胞48 h后,TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法)染色,可特异性标记细胞核内的DNA断裂末端,观察到MS-275处理后的细胞,核内被绿色荧光标记,MS-275未处理的对照组则没被染色。
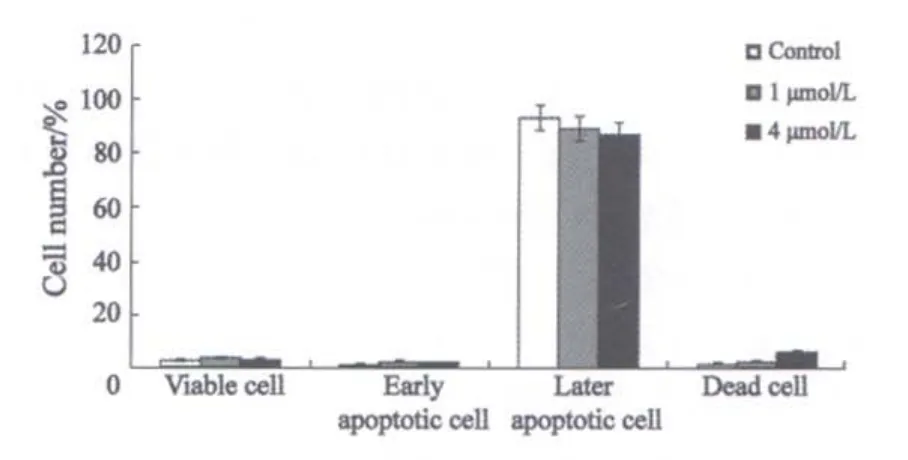
图3 MS-275对人正常肝细胞张氏肝细胞的作用Fig.3 The effect on human normal hepatic ce ll CHANGLIVER after treated by MS-275
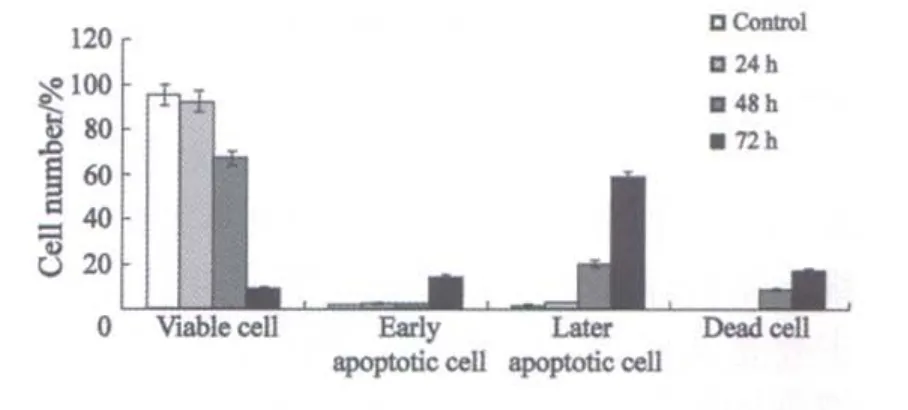
图4 MS-275对SGC-7901细胞凋亡的作用呈时间依赖性Fig.4 Apoptosis in SGC-7901 cell induced by MS-275 was a time-dependent mode
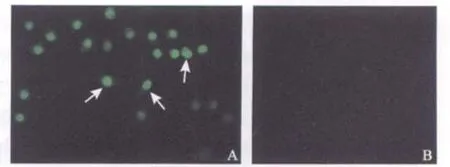
图5 TUNEL实验对比图Fig.5 TUNEL experimental comparison picture
3 讨 论
组蛋白乙酰化是调节基因表达的表观遗传修饰的一种,调节组蛋白乙酰化程度主要由组蛋白乙酰化酶(histone acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs)来相互协调完成。组蛋白乙酰化紊乱可能会导致染色体结构变化,调节细胞周期。分化以及凋亡的基因转录水平的失调[5]。组蛋白乙酰化状态利于基因表达,反之去乙酰化则与基因沉默相关,而大多数肿瘤细胞都存在着高度的组蛋白乙酰化[6]。HDACis可以抑制HDACs的作用,从而抑制肿瘤细胞的复制,成为近年来的抗癌药物的研究热点。MS-275是一种新型的苯酰胺类的HDACis,MS-275可以通过微芯生物设计和合成,与已经发现的HDACis无结构类似性,但是抑制效率是NaB等天然HDACis的30倍[7]。值得关注的是,MS-275的确具有诱导肿瘤细胞凋亡的作用,但是对于正常细胞却基本上没有作用。
SGC-7901细胞是人胃低分化腺癌细胞,在正常条件下生长增殖旺盛,MS-275浓度梯度处理后, WST-1检测发现,MS-275抑制生长的作用随着时间的延长和剂量的增加而升高,即MS-275的作用具有时间依赖性和剂量依赖性。这与Baradari等[7]发表的MS-275对胆管癌细胞系的作用和曲巍等[8]报道的MS-275对膀胱癌细胞系的作用相一致。目前的研究证实MS-275主要是通过诱导细胞凋亡和周期停滞抑制肿瘤细胞的生长。正在凋亡的细胞一个比较典型的特征是细胞核内出现DNA断裂。本实验中利用TUNEL 染色,可以在荧光显微镜下清楚观察到经过MS-275处理的SGC-7901细胞被染上绿色荧光,表明细胞核里的DNA发生断裂,而未经过MS-275处理的SGC-7901细胞则没有被染色。同时利用AnnexinV/PI双标流式细胞仪检测发现在同一处理浓度下(2 μmol/L),SGC-7901细胞分别处理24、48和72 h后,48 h后出现了非常明显的凋亡,说明MS-275确实会诱导肿瘤细胞发生凋亡,且凋亡率随着时间的延长逐渐上升,而在固定时间内(48 h)分别用1和4 μmol/L的MS-275处理后,在较高浓度(4 μmol/L)时会出现明显的细胞凋亡,推测在低浓度时主要是诱导细胞周期的停滞。为了证实MS-275对人正常细胞具有促凋亡作用,本实验还设了两种人正常细胞—人胃黏膜正常细胞GES-1和张氏肝细胞进行对照实验,结果显示在同等实验条件下,MS-275对正常细胞基本没有诱导凋亡的作用,说明MS-275的杀伤作用确实具有选择性。
本实验仅是MS-275对肿瘤细胞抑制作用的验证,下一步计划利用Western blot实验来检测细胞凋亡相关基因和细胞周期相关基因的表达情况,以及caspase家族在MS-275诱导的凋亡中的作用,这将对深入了解MS-275的作用机制起重要作用。
[1] USHIJIMA T, SASAKO M. Focus on gastric cancer[J].Cancer Cell, 2004, 5(2): 121-125.
[2] KRAMER O H, GOTTLICHER M, HEINZEL T. Histone deacetylase as a therapeutic target[J]. TRENDS Endocrinol Metabol, 2001, 12(7): 294-300.
[3] CHOI J H, KWON H J, YOON B I, et al. Expression profile of histone deacetylase in gastric cancer tissues[J]. Jpn J Cancer Res, 2001, 92: 1300-1304.
[4] MONNERET C. Histone deacetylase inhibitors[J]. Eur J Med Chem, 2005, 40(1): 1-13.
[5] STUMPP H H, BRACKER T U, et al. MS-275, a potent orally available inhibitor of histone deacetylases-the development of an anticancer agent[J]. Int J Biochem Cell Biol, 2007(39):1388-1405.
[6] BATTY N, MALOUF G G, ISSA J P J. Histone deacetylase inhibitors as anti-neoplastic agents[J]. Cancer Letters,2009(280): 192-200.
[7] BARADARI V, HOPFNER M, HUETHER A, et al. Histone deacetylase inhibitor MS-275 alone or combined with bortezomib or sorafenib exhibits strong antiproliferative action in human cholangiocarcinoma cells[J]. World J Gastroenterol, 2007, 13(33): 4458-4466.
[8] 曲巍, 王立明, 朱有华, 等. 组蛋白去乙酰酶抑制剂 MS-275抑制膀胱癌的实验研究[J].中国癌症杂志, 2006,16(1): 5-8.
[9] 马健, 赵名, 于晓妉, 等. 组蛋白去乙酰化酶抑制剂MS-275诱导骨髓瘤细胞株U266凋亡过程中Survivin的表达[J].癌症, 2009, 28(5): 466-471.

