Stathmin在上皮性卵巢癌组织中的表达及意义
石英 翁艳洁 周文娟 周婷 陈刚 王常玉
华中科技大学同济医学院附属同济医院妇产科,湖北 武汉 430030
卵巢癌是一种常见的严重威胁妇女生命健康的恶性疾病, 发病率仅次于宫颈癌和乳腺癌。由于缺乏有效的早期诊断筛选手段,且早期无明显症状,70%的患者就诊时已为晚期,其中上皮性卵巢癌占卵巢恶性肿瘤的85%~90%。虽然治疗方法不断改进,但预后仍较差,5年生存率无明显改善[1]。有研究证据表明,卵巢癌的发生、发展是多因素、多阶段的过程,涉及多个基因的变化,因此发现新的肿瘤基因治疗靶点,逐渐成为卵巢癌研究的热点。
Stathmin又称Op18 (Oncoprotein 18),是一种重要的微管不稳定蛋白,通过磷酸化和去磷酸化作用来调节细胞微管系统的动力学平衡与稳定,控制细胞周期,并参与调节细胞增殖、分化等生物学行为[2]。去磷酸化的Stathmin可以将Tubulin分离成无功能的可溶性T2S复合体,使微管末端附近可利用的Tubulin数量减少,促进微管解聚,调节微管的解聚和组装。同时,Stathmin参与调节细胞有丝分裂,特别是纺锤体形成。有丝分裂间期,非磷酸化Stathmin促进微管解聚,为有丝分裂期纺锤体生成奠定基础。当细胞进入有丝分裂期,Stathmin主要以磷酸化形式存在,促解聚活性丧失,微管聚合,利于纺锤体形成;而在有丝分裂晚期,Stathmin又通过去磷酸化激活,促进纺锤体解聚,顺利完成有丝分裂[3]。既往研究发现Stathmin在肺癌[4]、肝癌[5]、宫颈癌[6]等多种肿瘤中异常高表达,提示Stathmin可能参与多种肿瘤的发生、发展过程,但具体机制尚未完全阐明。本研究通过检测Stathmin在正常卵巢上皮、卵巢良性肿瘤和上皮性卵巢癌组织中的表达并分析其与临床病理特征的关系,为卵巢癌的临床靶向基因治疗提供依据。
1 材料和方法
1.1 材料
收集武汉同济医院2008年12月—2010年10月行手术治疗并经病理证实的卵巢组织标本。其中卵巢良性肿瘤16例,上皮性卵巢癌50例(浆液性囊腺癌33 例,黏液性囊腺癌12例,子宫内膜样腺癌5例),并以22例因宫颈癌手术行附件切除的正常卵巢作为对照。新鲜标本分两部分,一部分置RNA Later液保存于-80 ℃冰箱中用于RNA提取及RT-PCR,另一部分用4%多聚甲醛固定后交武汉谷歌生物公司石蜡包埋切片后用于免疫组化。
1.2 主要试剂
组织RNA提取试剂盒购于天根生化科技有限公司,RT-PCR相关试剂购于北京全式金公司,SABC法兔抗免疫组化试剂盒购于武汉博士德公司,Stathmin兔抗人抗体购自美国Abcam公司。
1.3 免疫组化方法及结果判定
所有标本经4%多聚甲醛固定,石蜡包埋连续切片后,按SABC法免疫组化试剂盒步骤进行。结果判定参照Sulzers分级法。按着色强度分4级:无阳性着色为0分;浅黄色阳性颗粒为1分;棕黄色阳性颗粒为2分;棕褐色阳性颗粒为3分。按着色范围分4级。Ⅰ级:无阳性细胞着色为0分;Ⅱ级:阳性细胞率≤25%为1分;Ⅲ级:阳性细胞率为26%~50%为2分;Ⅳ级:阳性细胞率≥51%为3分。随机观察5个高倍镜视野,计数100个细胞的阳性率,求平均值。染色结果判定标准为着色强度与范围之积:0分为阴性(-),1~2分阳性(+),3~6分中度阳性(++),7~9分强阳性(+++)。分析结果时,≤2分为阴性,>2分为阳性。
1.4 组织RNA提取及RT-PCR
组织RNA提取依照TIANGEN RNAprep pure微量RNA提取试剂盒步骤进行。引物由上海Invitrogen公司合成,Stathmin上游引物为5’-TGAAAGACGCAAGTCCCAT-3’,下游引物5’-GGTAGCCCCTAAAACAACAT-3’,扩增产物长度为444 bp;GAPDH上游引物5’-AGAAGGCTGGGGCTCATTTG-3’,下游引物为5’-AGGGGCCATCCACAGTCTTC-3’,扩增产物长度为238 bp。循环参数设为95 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,进行33个循环扩增,72 ℃终延伸10 min,4 ℃ 保存。各样本PCR产物通过1.2%琼脂糖凝胶电泳后,应用凝胶成像扫描及分析系统, 用各样本的目的基因条带灰度值与相应GAPDH条带灰度值相比,求其比值。
1.5 统计学处理
采用SPSS 16.0软件进行统计学分析,计量资料采用t检验和单因素方差分析,计数资料组间比较应用χ2检验和Fisher确切概率法,P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR方法检测Stathmin mRNA在不同卵巢组织中的表达
各组PCR产物分别在444 bp及238 bp处见条带(图1)。分析后得出Stathmin mRNA在上皮性卵巢癌组织中的表达(1.608±0.121)明显高于卵巢良性肿瘤(0.394±0.049)及正常卵巢上皮(0.537±0.068),差异具有统计学意义(P<0.05)。
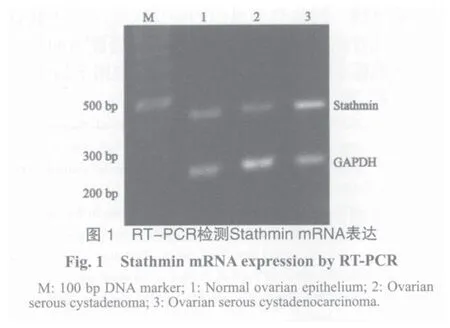
2.2 免疫组化法检测
Stathmin蛋白在不同卵巢组织中均表达。Stathmin蛋白表达阳性信号定位于肿瘤细胞的细胞质,呈浅黄、棕黄、棕褐色阳性颗粒。与正常卵巢组[9.09%(2/22)]、良性卵巢肿瘤组[31.25%(5/16)]相比,上皮性卵巢癌组的阳性表达率(74.00%,37/50)明显增高,差异具有统计学意义(χ2=35.91,P<0.01;χ2=9.57,P<0.01),而正常卵巢组与良性卵巢肿瘤组相比差异无统计学意义(P>0.05,图2)。
2.3 Stathmin蛋白表达与上皮性卵巢癌临床病理特征的关系
进一步研究发现,Stathmin蛋白表达与上皮性卵巢癌的临床分期、组织分级、淋巴结转移有关,差异具有统计学意义(P<0.05),而与年龄、病理类型及腹水量无相关性(表1)。
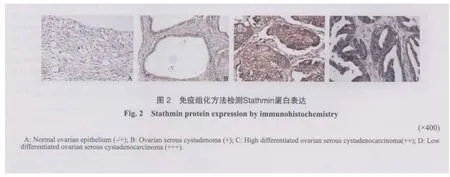

表1 Stathmin蛋白表达与上皮性卵巢癌临床病理特征的关系Tab.1 The relationship between Stathmin protein expression and clinicopathological characteristics in epithelial ovarian cancer
3 讨 论
寻找特异性的标志物已成为卵巢癌诊断和病情监测的拓展领域之一。许多标志物包括CA125、CA72-4、CA199和AFP等已被广泛应用于临床,但灵敏度和特异度不高。因此不断寻找新的标志物并联合检测将更有效地应对卵巢癌的异质性。
Stathmin作为一种与细胞周期相关的微管调节蛋白,最初被发现在恶性淋巴瘤细胞中高表达,随后证实在多种肿瘤中异常高表达,提示Stathmin可能参与多种肿瘤的发生和发展。Stathmin表达与正常细胞的增殖相关,但存在组织差异性。研究发现Stathmin在低分化肺癌和乳腺癌中高表达,推测Stahtmin可能与肿瘤细胞的过度增殖和分化不良相关[7-8]。Stathmin作为一种传递细胞外信号的细胞质磷蛋白,可与多种细胞因子、癌基因或抑癌基因表达产物相互作用,引起细胞内一系列生物学改变[3,9]。其中,野生型p53基因可通过抑制 Stathmin基因启动子活性来参与Stathmin表达的负性调节,而Stathmin持续高表达会越过p53介导的G2/M期阻滞,促进肿瘤细胞的增殖与分化[10]。
本研究通过RT-PCR及免疫组化方法检测Stathmin在卵巢癌组织中的表达,从基因和蛋白水平验证了Stathmin在正常卵巢上皮及肿瘤组织中均有表达,且在上皮性卵巢癌中表达明显升高;同时探讨了Stathmin与卵巢癌临床病理参数的关系,发现Stathmin的异常高表达与卵巢癌临床分期、病理分级、淋巴转移相关,即Stathmin在晚期低分化及伴淋巴转移的癌组织中异常高表达,与 Price等[11]的研究结论一致,提示Stathmin与卵巢癌的分化不良有关,并可能参与卵巢癌的淋巴转移。Trovik等[12]报道,Stathmin在子宫内膜癌转移淋巴结中表达增高,并作为一种PI3K激酶抑制因子,促进子宫内膜癌的淋巴转移。另外,研究组前期通过二维电泳联合质谱分析技术,发现对顺铂敏感性不同的两种卵巢癌细胞株之间存在多种差异表达蛋白,Stathmin即为其中之一,推测其可能在卵巢癌铂类耐药中发挥一定作用。
以上研究为探索Stahtmin在卵巢癌中的作用机制奠定了基础,下一步将完善实验思路:在体外,干预Stathmin的表达及功能,观察对卵巢癌细胞株化疗敏感性及侵袭转移等生物学行为的影响;在体内,选择适当的模式动物建立卵巢癌模型,寻找特异性的靶向药物,有效致力于卵巢癌的临床治疗。
综上所述,Stathmin在卵巢癌组织中异常高表达,可能与卵巢癌的分化不良、淋巴转移及化疗耐药相关。Stathmin将可能成为卵巢癌新的标志物之一,并作为新靶点应用于临床。
[1] GADDUCCI A, COSIO S, ZOLA P, et al. Surveillance procedures for patients treated for epithelial ovarian cancer:a review of the literature [J]. Int J Gynecol Cancer, 2007,17(1): 21- 31.
[2] MISTRY S J, ATWEH G F. Role of Stathmin in the regulation of the mitotic spindle: potential applications in cancer therapy[J]. Mt Sinai J Med, 2002, 69 (5): 299-304.
[3] RUBIN C I,ATWEH G F. The role of oncoprotein 18 in the regulation of the cell cycle[J]. J Coil Biochem, 2004, 93(2):242-250.
[4] CHEN G, WANG H, CHARIB T G, et al. Overexpression of oncoprotein 18 correlates with poor differentiation in lung adenocarcinomas [J]. Mol Cell Proteomies, 2003, 2 (2):107-116.
[5] 董旭旸, 易继林, 李兴睿. Stathmin/Oncoprotein 18(Op18)在肝细胞癌中的表达及其意义[J]. 胃肠病学和肝病学杂志, 2007, 4(16): 39-42.
[6] XI W, RUI W, FANG L, et al. Expression of stathmin/op18 as a significant prognostic factor for cervical carcinoma patients[J]. Cancer Res Clin Oncol, 2009, 135(6): 837-846.
[7] CHEN G, WANG H, GHARIB T G, et al. Overexpression of oncoprotein 18 correlates with poor differentiation in lung adenocarcinomas[J]. Mol Cell Proteomics, 2003, 2(2): 107-116.
[8] BRATTSAND G. Correlation of oncoprotein 18/stathmin expression in human breast cancer with established prognostic factors[J]. Br J Cancer, 2000, 83(3):311-318.
[9] WITTMANN T, BOKOCH G M, WATERMAN-STORER C M. Regulation of microtubule destabilizing activity of Op18 /Stathmin downstream of Rac1 [J]. J Biol Chem, 2004, 279(7): 6196-6203.
[10] JOHNSEN J I, AURELIO O N, KWAJA Z, et al. p53 mediated negative regulation of Stathmin/Op18 expression is associated with G2/M cell cycle arrest [J]. Int J Cancer, 2000, 88 (5):685-691.
[11] PRICE D K, BALL J R, BAHRANI-MOSTAFAVI Z, et al.The phosphoprotein Op18/stathmin is differentially expressed in ovarian cancer [J]. Cancer Invest, 2000, 18(8): 722-730.
[12] TROVIK J STEFANSSON I M, MARCICKIEWICZ J, et al.Stathmin overexpression identifies high risk patients and lymph node metastasis in endometrial cancer [J]. Clin Cancer Res, 2011, 17(10): 3368-3377.
——水芹主要害虫识别与为害症状

