血小板源性生长因子受体-β在蛛网膜下腔出血后脑血管痉挛中的作用
王灯亮 康德智 游鸿海 林章雅 林元相
颅内动脉瘤破裂出血是引起蛛网膜下腔出血(subarachnoid hemorrhage,SAH)最常见的原因,而动脉瘤性SAH的患者中约30% ~90%可发生脑血管痉挛[1](cerebral vasospasm,CVS),是SAH患者死亡和致残的主要原因。近年来,关于血小板源性生长因子(platelet derived growth factor,PDGF)在CVS的作用越来越受人们的关注。它是在血小板中发现的一种生长因子,是一种重要的促分裂剂,其中PDGF-BB是最重要的细胞增殖和迁移的趋化因子,在SAH后CVS的发生过程中,血管内皮受损脱落,完整性破坏刺激血管壁PDGF高表达[2],通过与靶细胞上的血小板源性生长因子受体(Platelet derived growth factor receptor,PDGFR),而 PDGFR-β 是 PDGFBB的特异性受体。本实验通过建立兔CVS的动物模型,观察基底动脉的管径变化、超微结构和PDGFR-β的表达变化规律,根据配体和受体的结合特点,进一步从侧面反映出PDGFBB在SAH后CVS的作用,为临床上更好的防治CVS提供理论基础。
1 资料与方法
1.1 动物及其分组 健康清洁的新西兰大白兔36只(上海生旺实验动物养殖有限公司提供)许可证号SCXK(沪)2007-0007,质量2.0~2.8 kg,雌雄不限。其中制模导致死亡9只,重新补入实验动物9只后,随机分为2组:①对照组:6只。②SAH组:30只。SAH组根据注血后处死时间,随机分为注血后1、3、5、7、10 d,共5 组,每组 6 只。
1.2 CVS模型的制备 采用枕大池二次注血法建立稳定的兔CVS模型。以盐酸氯氨酮(30 mg/kg)和盐酸氯丙嗪(7.5 mg/kg)联合行肌内注射麻醉,侧卧位枕部常规消毒后,充分暴露寰枕关节间硬脊膜,用2 ml注射器针头行枕大池穿刺,缓慢释放脑脊液0.4 ml/kg,同时将未抗凝的等量兔自体耳中央动脉血,缓慢注入枕大池,术后保持头低位30 min。对照组用等量的37℃生理盐水代替动脉血,余处理同上。48 h重复上述操作,注入的动脉血量为0.2 ml/kg。二次注血后24 h为SAH后第1天,依次类推。
1.3 标本留取方法 将SAH组按照不同时间点、对照组于造模后第5天过量麻醉,充分暴露心脏和主动脉根部,夹闭下腔静脉和降主动脉,左心室穿入自制灌注针头,同时剪开右心房放血,用多聚甲醛溶液经心脏灌注固定后,开颅取含基底动脉的脑干,置入多聚甲醛固定24 h后,进行组织取材、石蜡包埋、组织切片(与血管横断面平行,层厚4 μm)。
1.4 基底动脉直径测量 每个标本分别切1张切片,行常规苏木精-伊红染色,并通过计算机图像分析系统(Image-pro plus5.1),量化分析对照组和SAH各组基底动脉管腔直径变化。
1.5 透射电子显微镜观察 另取新西兰大白兔4只,将其随机分为2组:①对照组(NS组):2只。②SAH组术后第7天:2只。制模及取材过程大致同上,灌注时采用的是预冷的2.5%戊二醛溶液。具体过程:3%戊二醛-1.5%多聚甲醛前固定,1%锇酸-1.5%亚铁氰化钾后固定,酒精-丙酮脱水,环氧树脂618包埋剂包埋;超薄切片,醋酸铀、柠檬酸铅染色,飞利浦208型透射电镜观察、摄影。
1.6 PDGFR-β表达的检测及结果判断 一抗:兔抗兔PDGFR-β多克隆抗体,SANTA CRUZ公司;二抗:PV9002,北京中杉金桥生物工程公司。一抗浓度按1:200稀释,并严格按照兔超敏二步法试剂盒说明进行免疫组化染色。PBS代替一抗作为阴性对照,乳腺癌组织作为阳性对照。采用 Leica DM2500显微镜拍照系统(福建医科大学实验室提供)分别对各组标本基底动脉内皮细胞和平滑肌细胞的PDGFR-β的表达进行观察,免疫组化染色后细胞质中有棕黄色颗粒者为阳性细胞,每个标本分别取3张切片进行免疫组化。
1.7 统计学方法 采用SPSS 11.5统计软件进行数据处理,各组基底动脉直径的均数采用单因素方差分析(One-way,AVONA,LSD检验),PDGFR-β的表达情况采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
2 结果
2.1 基底动脉内径的变化 对照组基底动脉管腔呈圆形或椭圆形,在SAH组的各时间点内,基底动脉均发生了明显的痉挛,出现管腔直径的不同程度的缩小(P<0.01),在术后第1天下降明显(P<0.01),随后有所恢复,但与对照组相比,第3、5天仍有下降趋势,在第7天再次明显收缩(P<0.01),第10天时管径狭窄程度比第7天有所缓解。SAH各组间比较,除第1天与第5天基底动脉直径无明显变化(P>0.05),其余组间比较,直径变化比较差异有统计学意义(P<0.05)。
表1 各组的基底动脉的管腔直径(±s,μm)

表1 各组的基底动脉的管腔直径(±s,μm)
分组(n=6) 对照组 第1天 第3天 第5天 第7天 第10天直径 871.81±67.50 657.49±27.55 715.32±65.72 618.36±26.61 553.93±51.52 678.45±35.54
2.2 透射电镜结果 对照组:血管壁超微结构正常,内皮细胞线粒体结构正常,紧密连接呈纺锤形,弹力膜排列整齐,平滑肌细胞、外膜成纤维细胞结构正常。SAH组:血管部分内皮细胞脱落,胞浆空泡样变,紧密联接打开,内皮间隙扩大;内弹力膜扭曲、断裂;平滑肌细胞变形,排列紊乱,胞浆空泡化;外膜胶原水肿,成纤维细胞增多,可见大量中性粒细胞、单核细胞浸润。

图1 -A 对照组:内皮细胞结构正常,紧密连接正常,平滑肌细胞排列规则(TEM 8000)

图1 -B SAH组:内皮细胞脱落,紧密连接打开,内弹力膜扭曲、断裂,平滑肌细胞胞浆空泡化,外膜可见大量中性粒细胞、单核细胞浸润(TEM 8000)
2.3 PDGFR-β的表达情况 根据文献[3],采用量化评分表评价各组的PDGFR-β的表达情况,其免疫组化的阳性反应主要在血管内皮细胞胞浆,平滑肌和外膜细胞胞浆亦可见,呈棕黄色,胞核无着色。在正常对照组,无阳性细胞表达;在SAH组:第1天开始出现少量阳性细胞,表达较浅;第3天逐渐增多,并在第5、7天达到高峰(P<0.01),表达较深;到第10天逐渐下降,但仍高于对照组(P<0.05)。
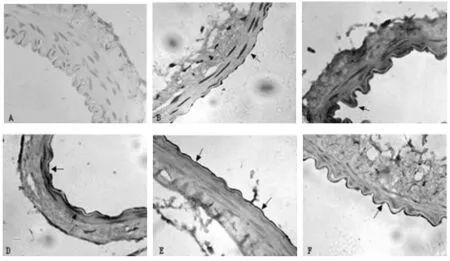
图2 A对照组(400);图B至图F(400):依次为SAH术后第1、3、5、7、10天。黑色箭头所指为PDGFR-β的阳性细胞(胞浆呈棕黄色,胞核呈蓝色)。
3 讨论
SAH后CVS的发病机制十分复杂,目前认为多种物质共同参与了SAH后CVS的发生,其中PDGF是其中重要的一种[4]。自Borel等[5]报道在因CVS死亡的患者脑脊液中发现PDGF-AB升高,在鼠痉挛模型中发现PDGF和细胞增生有关,而增生可被PDGF拮抗剂抑制的现象后,PDGF在CVS发生、发展过程中的作用日益受到人们的关注。临床和动物实验均表明PDGF在血管内皮细胞及平滑肌细胞的表达确实存在于痉挛血管中。
PDGF是结缔组织细胞如成纤维细胞、平滑肌细胞、血管内皮细胞等的强有丝分裂原和化学驱动剂。目前发现PDGF家族成员至少有4个,即PDGF-A、B、C和D。PDGF一般以有二硫键连接的同源二聚体或异源二聚体组成,如PDGF-AA、BB、CC和DD[6],尤其PDGF-BB是最重要的细胞增殖和迁移的趋化因子。PDGF生物学特征主要有三方面:一是促细胞分裂作用,能刺激多种细胞分裂增生。二是化学趋化性,PDGF对成纤维细胞和平滑肌细胞有趋化性。三是血管收缩效应。PDGF与靶细胞膜受体结合介导动脉壁平滑肌细胞由中膜迁移到内膜并增生,在刺激动脉壁平滑肌细胞增殖的同时促进了胶原蛋白的合成与分泌。

表2 SAH后基底动脉的PDGFR-β的表达量化表
PDGF受体包括两种结构相似酪氨酸激酶受体PDGFR-α、β。PDGFR-α主要在胚胎期神经嵴细胞及体节的发育过程中其重要作用[7],而PDGFR-β主要参与血管壁细胞的发育,具有吸收和促进外膜细胞、平滑肌细胞增殖的作用,在血管形成后期发挥重要作用[8]。PDGFR-α可与PDGF A、B和C结合,PDGFR-β可与B和D结合,受体与PDGF结合后可发生二聚化和自身磷酸化反应,从而激活几种特定的细胞内分子,引起不同信号传导通路的级联反应,产生相应的病理生理反应[9]。
研究表明[10],在外源PDGF-BB注入蛛网膜下腔后,脑血管痉挛是逐渐的加重的过程,吴军等[11]在大鼠CVS模型中证实了PDGF mRNA转录和PDGF-BB蛋白表达增强与SAH后CVS的血管增生性变化有关。因此在SAH后痉挛血管的PDGF-BB表达升高,与CVS的发生密切有关,而PDGFR-β与PDGF-B链有高亲和力[12],后者许多生理作用的有效发挥,需要结合PDGFR-β,因此在SAH后CVS的发生中可能伴随着PDGFR-β表达的上调。但目前未见有对PDGFR-β在CVS的痉挛血管中表达时间窗的相关研究。
本实验通过兔枕大池二次注血法建立兔CVS模型,结果提示兔CVS模型的血管痉挛现双相期改变,急性脑血管收缩出现在第1天,随后逐渐缓解,而迟发性CVS在第3天左右出现,在第7天达到高峰后逐渐缓解,与临床上SAH患者出现CVS的时相基本一致。同时,透射电镜示SAH组的基底动脉出现相应的超微结构变化,这均表明实验模型的制作是成功的。本实验应用免疫组化技术观察PDGFR-β在SAH后血管壁的表达情况,发现在正常对照组的血管壁上无阳性细胞表达,在SAH后第1天开始出现少量阳性细胞,第3天逐渐增多,在第5、7天达到高峰后,第10天逐渐下降,表达部位主要在血管内皮细胞上,平滑肌和外膜亦可见有表达,规律呈现一定的时序性,且其表达时相与管腔狭窄程度的结果基本一致。由此可见,PDGFR-β可能与SAH后CVS的发生有关,而SAH后PDGFR-β的表达上调可能是与其配体的作用相适应,放大了PDGF对痉挛血管的生理作用,引起CVS的发生。
在SAH后的初期,大量血凝块激活血小板等释放出血管收缩物质,如PDGF、内皮素等,这些缩血管物质作用于脑血管,引起早期的CVS病理改变,此时应用血管扩张剂(罂粟碱、尼莫地平等)可在一定程度上缓解CVS。更为重要的是,PDGF还可以作为游走趋化因子,在基底动脉内长期高表达,并作用于平滑肌细胞,使平滑肌细胞表型的转化,刺激血管平滑肌细胞增殖分化,引起脑血管重构,管壁增厚,血管顺应性下降[13],从而参与整个脑血管痉挛的病理变化过程。而此时痉挛血管壁的病理变化为器质性的,对血管扩张剂的反应较差。
综上所述,本实验通过研究PDGFR-β在CVS痉挛血管的表达规律,进一步从侧面反映出PDGF-BB是SAH后CVS发生的一种重要的致痉作用,然而,目前关于PDGF-BB在CVS中的具体作用机制尚不明确,有待于今后进一步更好的研究。目前,已有研究认为[14],SAH后早期使用PDGF抑制剂Trapidil,可有效抑制PDGF及其受体的活性,减轻PDGF对平滑肌的增殖及迁移作用,从而改善痉挛血管的器质性病理改变,这为临床上更有效的预防CVS的发生提供了思路。
[1]Crowley RW,Medel R,Kassell NF,et al.New insights into the causes and therapy of cerebral vasospasm following subarachnoid hemorrhage.Drug Discov Today,2008,13(5-6):254-260.
[2]Yu J,Moon A,Kim HR.Both platelet-derived growth factor receptor(PDGFR)-alpha and PDGFR-beta promote murine fibroblast cell migration.Biochem Biophys Res Cornmun,2001,282(3):697-700.
[3]Tsurutani H,Ohkuma H,Suzuki S.Effects of thrombin inhibitor on thrombin-related signal transduction and cerebral vasospasm in the rabbit subarachnoid hemorrhage model.Stroke,2003,34(6):1497-1500.
[4]Megyesi JF,Vollrath B,Cook DA,et al.In vivo animal models of cerebral vasospasm:a review.Neurosurgery,2000,46(2):448-460.
[5]Bore,Shaw MD,Vermeulen M,et al.Efficacy and safety of the endothel in receptor antagonist TAK in treating subarachnoid hemorrhage:a report by the steering committee on behalf of the UK/Netherlands/Eire TAK Subarachnoid Haemorrhage Study Group.J Neurosurg,2000,93(6):992-997.
[6]林春霞,惠汝太.PDGF家族新成员:PDGF-C和PDGF-D.中国分子心脏病杂志,2005,5(5):738-743.
[7]Tallquist MD,Soriano P.Cell autonomous requirement for PDGFR alpha in populations of cranial and cardiac neural crest cells.Development,2003,130(3):507-518.
[8]Hellstrom M,Kalen M,Lindahl P,et al.Role of PDGF-B and PDGFR-beta in recruitment of vasular smooth muscle cells and pericytes during embryonic blood vessel formation in the mouse.Development,1999,126(14):3047-3055.
[9]徐希奇,赵红,惠汝太,等.血小板源性生长因子受体表达和活性的调控机制.中国分子心脏病杂志,2005,5(5):758-761.
[10]Miller CA,Lombard FW,Wu CT,et al.Role of vascular mitogens in subarachnoid hemorrhage-associated cerebral vasculopathy.Neurocrit Care,2006,5(3):215-21.
[11]吴军,张海鸥,周春奎,等.大鼠蛛网膜下腔出血迟发性脑血管痉挛血小板衍生生长因子基因表达动态变化.中华老年医学杂志,2004,23(6):410-413.
[12]廖志钢,李雷波,陈晓刚,等.PDGFR-β在大鼠闭合性脑损伤中的表达.中国法医学杂志,2004,19(3):131-133.
[13]Van Heyningen P,Cal Ver AR,Richardson WD,et al.Control of progenitor cell number by mitogen supply and demand.Curr Biol,2001,11(4):232-241.
[14]薛菁灰,张志文,李安民,等.Trapidil对蛛网膜下腔出血后脑血管痉挛作用的实验研究.中华神经医学杂志,2007,6(2):138-140.

