纳米TiO2对镉(Ⅱ)的吸附性能
刘雪岩, 杨丽君, 金燕利, 张 蕾, 徐天赐, 李 娜
(1. 辽宁大学 化学学院,沈阳 110036;2. 海军装备部 驻沈阳军事代表局,沈阳 110031)
金属镉及镉的化合物被广泛地应用于电镀工业、制造合金、蓄电池、颜料、聚氯乙烯稳定剂、核反应堆的中子吸收剂等。镉在自然界中以硫镉矿的形式存在,并常与锌、铅、铜、锰等矿共存,这些金属的精练过程都会排出大量镉,因此,镉以工业废水、废气、废渣的形式污染环境。镉是毒性较强的重金属元素,因此,快速、有效地去除镉具有十分重要的意义。目前,常用的去除镉的方法有共沉淀法[1]、浮选法[2]、溶剂萃取法[3]、离子交换法[4]、液膜法[5]、吸附法[6]等。沉淀法是一种传统的分离富集方法,在溶液中加入沉淀剂和少量金属离子作为载体,共沉淀溶液中的镉;离子交换分离法常用阳离子交换树脂或阴离子交换树脂去除镉,采用腐植酸树脂和螯合树脂去除镉的方法也有见报道;膜分离法处理含镉废水具有污染物去除率高、工艺简单等特点, 但膜在处理废水时的选择性和使用成本较高, 膜组件的设计也是一个难题,所以,膜法去镉的应用受到限制;吸附法是利用多孔性的固体物质作吸附剂去除镉的,常用于处理含镉废水的吸附剂有:活性炭、风化煤、磺化煤、高炉矿渣、沸石、壳聚糖、羧甲基壳聚糖、硅藻土、改良纤维、活性氧化铝和蛋壳等。纳米材料是近年来发展起来的一种新型功能材料,它具有比表面积大、表面原子数目多等优点,已受到研究工作者的广泛关注。纳米粒子对许多金属离子具有很强的吸附能力,因此,是去除有毒有害重金属污染物的理想吸附剂[7]。
梁沛等[8]利用 ICP-AES研究了纳米 TiO2对Cr(Ⅵ)/Cr(Ⅲ)的吸附性能,并将其用于水样中铬的形态分析。张东等[9]考察了纳米钛酸钙粉体对水中重金属铅和镉的吸附性能。MATŠÚ 等[10]利用 ET-AAS和ICP-OES研究了纳米TiO2分离和富集痕量Al(Ⅲ)的可行性,探讨了纳米TiO2材料对Al(Ⅲ)的吸附行为。张蕾等[11]报道了纳米TiO2对钼(Ⅵ)吸附性能的研究。
有关金红石型纳米 TiO2对镉的吸附性能研究鲜见报道,本文作者以金红石型纳米TiO2为吸附剂,探讨pH对吸附的影响及相关吸附机理,并对纳米TiO2吸附镉的热力学与动力学行为进行较系统的研究,该研究为纳米吸附剂有效去除镉提供了理论依据。
1 实验
1.1 实验仪器与试剂
1.1.1 实验仪器
AAnalyst−700原子吸收光谱仪(美国,PE公司),pHS−3C型精密pH计(上海雷磁),Malvern Nano ZS纳米粒度及Zeta电位分析仪(美国,Malvern公司),X射线粉末衍射仪(D8 ADVACE 德国 BRUKER 公司),KQ−100B型超声波清洗器(昆山市超声仪器有限公司),TDL80−2B台式离心机(上海安亭科学仪器厂),DK−98−1型电热恒温水浴锅(天津市泰斯特仪器有限公司)
1.1.2 主要实验试剂
主要试剂如下:纯镉,硝酸,盐酸,氢氧化钠,金红石型纳米-TiO2(舟山明日纳米材料有限公司)。实验所用试剂均为分析纯,水为二次蒸馏水。
镉标准储备溶液(优级纯)为 1 mg/mL:准确称取1 g 镉置于烧杯中,加入 20 mL HNO3(其中V(HNO3)∶V(H2O)=1∶1)溶液,加热煮沸至溶液变为无色透明,冷却后转移至1 000 mL容量瓶中,以二次蒸馏水定容,摇匀。
1.1.3 仪器工作条件
原子吸收分光光度计。工作参数如下:波长228.8 nm,狭缝宽0.7 H,灯丝电流4.0 mA,乙炔流量2.0 L/min,空气流量17 L/min。
1.2 实验方法
1.2.1 镉的测量方法
准确移取0、0.10、0.25、0.50、1.00、1.50、2.00、2.50、3.00 mL的镉标准溶液于25 mL容量瓶中,以0.5 mol/L HNO3稀释、摇匀。用AAnalyst700 原子吸收光谱仪,以乙炔−氧气作火焰,HNO3作空白溶液,测定吸光度A。
1.2.2 纳米二氧化钛等电点的测定
将0.059 9 g的金红石型纳米二氧化钛粉体于250 mL水溶液中,超声分散形成分散液,用HCl和NaOH调节一系列分散液的pH值,采用Zeta电位分析仪,测量分散液的 Zeta电位,Zeta电位为零时所对应的pH值即是金红石型纳米二氧化钛的等电点。
1.2.3 镉的吸附方法
移取10 mL一定浓度Cd(Ⅱ)标准溶液置于50 mL具塞锥形瓶中,用HCl 和NaOH 溶液调节Cd(Ⅱ)标准溶液的pH 值,然后加入一定量的纳米TiO2,超声分散3 min,静置5 min,离心分离5 min (4 000 r/min),然后分析水相中Cd(Ⅱ)的浓度,按照1.2.1 测定方法,测定吸光度A,计算Cd(Ⅱ)含量和吸附率。
吸附率η的计算公式为

式中:ρ0为原溶液中吸附质的质量浓度,mg/L;ρ为吸附平衡时溶液中剩余吸附质的质量浓度,mg/L。
1.2.4 动力学实验
移取10 mL浓度为20 mg/L的Cd(Ⅱ)溶液置于一系列50 mL具塞锥形瓶中,调溶液pH为6.0,加80 mg纳米TiO2,分别在273、293和313 K条件下,测定不同时间间隔下溶液中吸附质的浓度,直到吸附达到平衡。
1.2.5 热力学实验
在一系列50 mL具塞锥形瓶中,加入不同质量浓度的Cd(Ⅱ)溶液10 mL,用HCl和NaOH调溶液的pH为6.0,加入80 mg纳米TiO2,分别在273、293和313 K条件下进行吸附实验。
2 结果与讨论
2.1 纳米TiO2的表征
样品XRD的分析结果如图1所示。结果表明,样品衍射角在2θ= 27.4°有明显衍射峰,且其余各峰对应的面间距d值与 JCPDS 卡中 211276 号金红石型TiO2的d值完全一致,说明样品为金红石相结构。经测定样品的平均晶粒尺寸约为81.9 nm左右,皆处于纳米范围(见图2)。

图1 纳米氧化钛的XRD谱Fig.1 XRD pattern of nano-TiO2

图2 纳米TiO2的粒度分布图Fig.2 Particle diameter distributions of nano-TiO2
2.2 pH的影响
pH值对纳米TiO2吸附Cd(Ⅱ)起着重要的作用。在不同pH值条件下,纳米TiO2对Cd(Ⅱ)的吸附率的影响如图3所示,在pH值4~7范围内,纳米TiO2对Cd(Ⅱ)具有良好的吸附性能,吸附率可达97%以上,即可以被定量吸附。
Cd(Ⅱ)溶于酸性介质,不溶于中性和碱性介质中,在水溶液中,主要以Cd2+和Cd(OH)2两种形态存在。当pH<7时,主要以Cd2+形态存在;pH>7时,主要是Cd(OH)2形态存在(见图4),测定金红石型纳米TiO2的等电点pHZPC为3.8(见图4)。pH<3.8时,纳米TiO2表面带正电荷,不利于Cd2+的吸附。溶液pH在3.8~7之间,纳米TiO2表面带负电荷,有利于Cd2+吸附。故本实验选择pH 6.0为最佳吸附酸度。
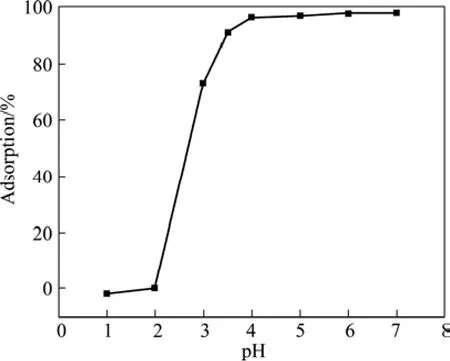
图3 pH值对纳米TiO2吸附Cd(Ⅱ)的影响Fig.3 Effect of pH on adsorption rate of Cd(Ⅱ)for nano-TiO2

图4 不同pH值下金红石型纳米TiO2的Zeta电位Fig.4 Zeta potential of rutile type nano-TiO2 at different pH
从图3可知,pH<2时,Cd(Ⅱ)的吸附率较低,本研究选择HCl溶液解析Cd(Ⅱ)。实验结果表明,7.0 mL 0.1 mol/L HCl 溶液于70 ℃恒温水浴中可定量解析Cd(Ⅱ),解析率为95%。
2.3 共存离子对吸附的影响
本研究也考察了常见的共存离子对纳米 TiO2吸附镉的干扰情况。实验结果表明,对于 200 μg/mL 的Cd2+,1 mg/ mL 的 K+;1.5 mg/ mL Na+;3 mg/ mL 的Ca2+,Mg2+;3 mg/mL 的 Cl−;1.5 mg/mL 的;1 mg/ mL 的和和 0.8 mg/ mL的对测定结果无显著性影响。
2.4 吸附动力学研究
取10 mL 20 mg/L的Cd(Ⅱ)溶液,调溶液pH 6.0,加入80 mg纳米TiO2,以吸附量qt对时间t作图,得到 Cd(Ⅱ)吸附量随温时间变化的吸附动力学曲线(见图5)。由图5可见,qt随时间的增长而增大,吸附3 min基本达到平衡。
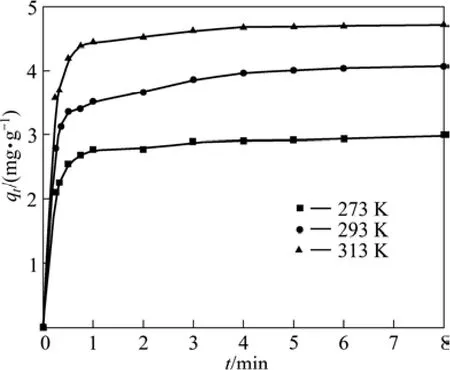
图5 不同温度时镉的吸附量随时间的变化曲线Fig.5 Adsorption capacity of Cd(Ⅱ)on sorbent vs time at different temperature
将以上实验数据用于准二级动力学方程:

式中: k2为二级反应速率常数,g·mg−1·min−1;qt为 t时刻的吸附量,mg·g−1;q2为平衡吸附量,mg·g−1。以t/qt对t作图,对所有数据进行线性回归分析,从斜率和截矩可得到不同温度下纳米TiO2吸附Cd(Ⅱ)的k2、q2以及相关系数r,实验数据如表1。从表1可看出,在3种温度下,动力学实验数据与二级反应动力学模型有较好的拟合(r2>0.999)。
根据不同温度下镉吸附动力学实验数据,用阿伦尼物乌斯(Arhenius)公式对吸附反应的活化能求解,求得纳米TiO2对Cd(Ⅱ)吸附的活化能Ea为3.16 kJ/mol。

表1 不同温度下纳米TiO2吸附Cd(Ⅱ)的动力学参数Table 1 Kinetic parameters for Cd(Ⅱ)adsorption on nano-TiO2 at different temperatures
2.5 扩散模型
粒子内部扩散方程:

式中:F=qt/qe;qt和 qe分别为 t 时刻的吸附容量和平衡吸附容量,mg·g−1;B=π2Di/d2(Di为内部扩散系数,d 为粒子半径)。将动力学数据用粒子扩散方程进行拟合,根据式(3),用−ln(1−F)−0.497 7 对 t做图(见图6)。图6中直线近似通过原点,表明粒子内部扩散是吸附过程的主要控制步骤[12]。

图6 粒子内部扩散拟合曲线Fig.6 Fitted curve of intraparticle diffusion
Cd(Ⅱ)在吸附剂内部的扩散过程可进一步用Weber-Morris 模型来描述[13],方程式如下:

式中:Kd为内部扩散速度常数,mg·g−1·min−1/2;I 表示与边界层厚度有关的常数,I值越大,边界层对吸附的影响越大[14−15]。将Weber-Morris模型数据进行分段线性拟合,拟合曲线如图7所示,由模型得到的内部扩散速度常数和线性相关系数r 如表2 所列。从图7可以看出,Weber-Morris模型曲线的2段线性拟合情况较好,说明粒子内部扩散过程是吸附过程的控制步骤;但扩散模型拟合直线并不经过原点,说明纳米TiO2吸附Cd(Ⅱ)机理比较复杂,吸附剂周围液相边界层向粒子表面的扩散过程不可以忽略。

图7 在不同温度下Weber-Morris 模型拟合曲线Fig.7 Fitted curves of Weber-Morris at different temperatures
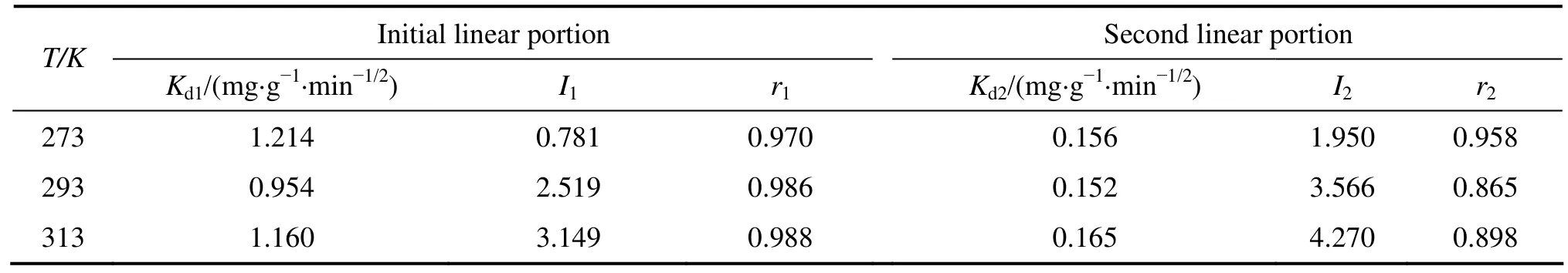
表2 不同温度下Weber-Morris模型多段线性拟合曲线系数及相关系数Table 2 Calculated parameters for Cd(Ⅱ)adsorption on nano-TiO2 at different temperatures
2.6 吸附热力学研究
2.6.1 吸附等温模型和吸附容量
分别在不同温度下(0、20和40 ℃),按吸附方法(1.2.5)进行吸附实验,吸附等温线见图 8。根据Langmuir吸附等温模型[16],以ρe/qe对Ce做直线可得qm和 b。

式中:qm为饱和吸附量,mg·g−1;ρe为 Cd(Ⅱ)吸附平衡时的质量浓度,mg·L−1;b 为吸附平衡常数,L·mg−1。Langmuir 吸附等温模型拟合结果如表3所列。由表3可知,在3种温度下,实验数据与Langmuir 等温吸附线有较好的拟合(r≥0.99),饱和吸附容量随着温度的升高而增加,说明纳米 TiO2对 Cd(Ⅱ)的吸附是吸热过程。

图8 不同温度下的吸附等温线Fig.8 Isotherm of Cd(Ⅱ)adsorption on nano-TiO2 at different temperatures

表3 不同温度下Langmuir等温吸附曲线的参数Table 3 Langmuir isotherm constants at different temperatures
2.6.2 吸附过程中的热力学参数
实验考察了在273、293和313 K下不同初始浓度的Cd(Ⅱ)的吸附情况。热力学函数计算,从吸附等温线求出吸附等量线,以 ln ρ对 1/T作图,根据Clausius-Clapeyron方程可得[17]:

式中:ρ为不同温度时Cd(Ⅱ)的吸附平衡浓度(mg·L–1)。用线性回归法求出斜率,求标准吸附焓ΔHΘ,根据如下关系计算其它热力学函数值,计算结果列于表4。
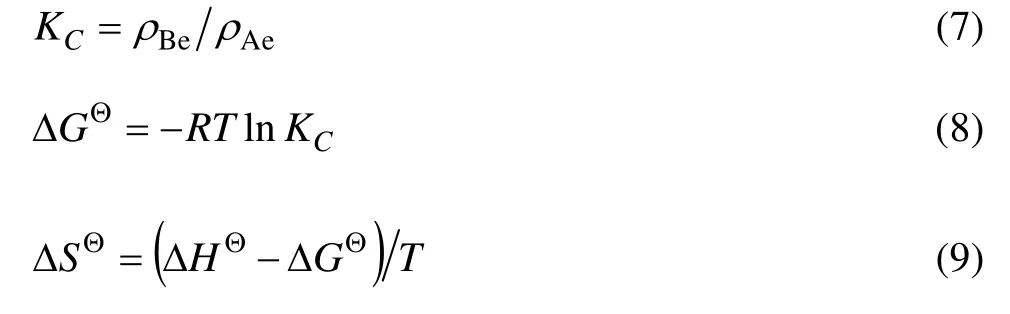
式中:ρBe和ρAe分别是Cd(Ⅱ)在吸附剂中的平衡浓度(mg·L–1)和在溶液中的平衡浓度(mg·L–1);KC为平衡常数。
由表4可知,纳米TiO2吸附Cd(Ⅱ)离子的吸附是自发过程(ΔGΘ<0),且ΔGΘ的绝对值随着温度的升高而增加,这与等温吸附线表现出的温度升高,吸附量增加的实验结果一致,此吸附反应为吸热过程(ΔHΘ>0),且熵变皆为正值(ΔSΘ>0)。
2.6.3 平均吸附能
平均吸附能E 是判断吸附类型的重要指标,其计算式为[18]

根据D-R模型的线性形式(见式(11)),以lnqe对ε2作直线(见图9),由直线斜率求得K:

式中:E为平均吸附能,kJ/mol;K为与吸附能有关的常数;ε为Polanyi势能,kJ。根据式(10),在273、293和313 K条件下,纳米TiO2对Cd(Ⅱ)的平均吸附能分别为13.36、11.54和10.82 kJ/mol,离子交换反应的能量范围为 8~16 kJ/mol,故该吸附反应属于离子交换[19]。

表4 镉吸附于纳米TiO2的热力学表观参数Table 4 Thermodynamic parameters for adsorption of Cd(Ⅱ)on nano-TiO2
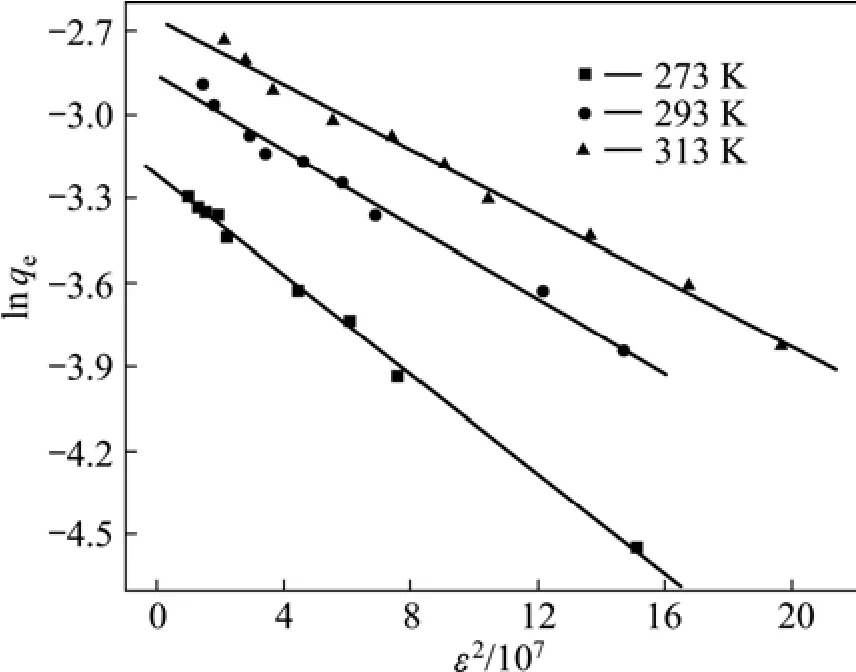
图9 在不同温度下的D-R吸附等温线Fig.9 D-R adsorption isotherms at different temperatures
3 结论
1) 在 pH 4~7 范围内,纳米 TiO2对 Cd(Ⅱ)的吸附率可达97%以上,强酸性条件不利于Cd(Ⅱ)的吸附,7.0 mL 0.1 mol/L HCl 溶液可定量解析Cd(Ⅱ),解析率为95%。
2) 该吸附过程符合准二级反应动力学模型,常温下,其反应速率常数为 1.89 g·mg−1·min−1,反应活化能为3.16 kJ/mol,吸附机理比较复杂,粒子内部扩散过程是其吸附控制步骤,但液相边界层向粒子表面的扩散过程亦不可忽略。
3) 纳米 TiO2对 Cd(Ⅱ)的吸附符合 Langmuir、D-R等温式,在273、293 和313 K 条件下,其饱和吸附容量分别为 4.78、6.34、7.76 mg·g−1,平均吸附能分别为 13.36、11.54、10.82 kJ·mol−1,饱和吸附容量随体系温度升高而增大,说明此吸附反应为吸热过程,平均吸附能范围为8~16 kJ·mol−1,故该吸附反应属于离子交换过程。
4) 纳米 TiO2对 Cd(Ⅱ)的吸附热力学参数分别为ΔHΘ>0,ΔGΘ<0,ΔSΘ>0,表明吸附反应为自发的吸热过程。
[1]卢莲英, 邹光中, 叶宋娣. 铁氧体与镉共沉淀的试验研究[J].化学与生物工程, 2004, 6: 44−45.LU Lian-ying, ZOU Guang-zhong, YE Song-di. Experiment research on concomitance deposition of cadmium and ferrite[J].Chemistry & Bioengineering, 2004, 6: 44−45.
[2]易晓明, 李建文. 铁置换−硫酸铵−碘化钾−丁基罗丹明B浮选分离镉[J]. 岩矿测试, 2007, 26(2): 126−128.YI Xiao-ming, LI Jian-wen. Separation of Cadmium(II)with replacement -flotation[J]. Rock and Mineral Analysis, 2007,26(2): 126−128.
[3]刘 阁, 周 凯. Tween80-(NH4)2SO4-H2O体系萃取镉的研究[J].湿法冶金, 2007, 26(2): 92−95.LIU Ge, ZHOU Kai. Extraction of Cd(Ⅱ)in Tween80-(NH4)2SO4-H2O system[J]. Hydrometallurgy of China, 2007,26(2): 92−95.
[4]杨莉丽, 康海彦, 李 娜, 张德强. 离子交换树脂吸附镉的动力学研究[J]. 离子交换与吸附, 2004, 20(2): 138−143.YANG Li-li, KANG Hai-yan, LI Na, ZHANG De-qiang.Study on the kinetics of adsorption of cadmium by ion-exchange resin[J]. Ion Exchange and Adsorption, 2004, 20(2): 138−143.
[5]刘新芳, 张晓宇, 何鼎胜. 组合液膜分离镉锌的动力学分析[J]. 电镀与涂饰, 2009, 28(6): 44−47.LIU Xin-fang, ZHANG Xiao-yu, HE Ding-sheng. Dynamic analysis on the separation of cadmium and zinc with hybrid liquid membrane[J]. Electroplating & Finishing, 2009, 28(6):44−47.
[6]侯 明, 刘振国. 接枝壳聚糖对铅, 镉吸附行为研究及应用[J].分析试验室, 2006, 25(10): 1−6.HOU Ming, LIU Zhen-guo. Study on adsorption properties of carboxyl-containing grafted chitosan polymer toward Pb(II)and Cd(Ⅱ)and its application[J]. Chinese Journal of Analysis Laboratory, 2006, 25(10): 1−6.
[7]张中太, 林元华, 唐子龙, 张俊英. 纳米材料及其技术的应用前景[J]. 材料工程, 2000, 3: 42−48.ZHANG Zhong-tai, LIN Yuan-hua, TANG Zi-long, ZHANG Jun-ying. Nanometer materials & nanotechnology and their application prospect[J]. Materials Engineering, 2000, 3: 42−48.
[8]梁 沛, 李春香, 秦永超, 胡 斌, 江祖成. 纳米二氧化钛分离富集和 ICP-AES 测定水样中 Cr(VI)/ Cr(III)[J]. 分析科学学报, 2000, 16(4): 300−303.LIANG Pei, LI Chun-xiang, QIN Yong-chao, HU Bin, JIANG Zu-cheng. Selective adsorption on nanometer size TiO2powders for the chromium speciation using ICP-AES[J]. Journal of Analytical Science, 2000, 16(4): 300−303.
[9]张 东, 侯 平. 纳米钛酸钙粉体的制备及其对水中铅和镉的吸附行为[J]. 化学学报, 2009, 12(67): 1336−1342.ZHANG Dong, HOU Ping. Preparation of nano-calcium titanate powder and its adsorption behavior for lead ion and cadmium ion in water[J].Acta Chimica Sinica, 2009, 12(67): 1336−1342.
[10]MATŠÚ P, HAGAROVÁ I, BUJDOŠ M, DIVIŠ P, KUBOVÁ J.Determination of trace amounts of total dissolved cationic aluminium species in environmental samples by solid phase extraction using nanometer-sized titanium dioxide and atomic spectrometry techniques[J]. Journal of Inorganic Biochemistry,2009, 103: 1473−1479.
[11]张 蕾, 刘雪岩, 姜晓庆, 李 绮, 康平利. 纳米 TiO2对钼(Ⅵ)的吸附性能[J]. 中国有色金属学报, 2010, 20(2): 301−307.ZHANG Lei, LIU Xue-yan, JIANG Xiao-qing, LI Qi, KANG Ping-li. Adsorption properties of nano-TiO2for Mo(Ⅵ)[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(2): 301−307.
[12]AKSU Z. Application of biosorption for the removal of organic pollutants: A review[J]. Process Biochemistry, 2005, 40(3/4):997−1026.
[13]SHAUHA M S, SARWAR M I, QADEER R. Adsorption of strontium ions from aqueous solution on Pakistani coal[J].Journal of Radioanalytical and Nuclear Chemistry, 2005, 265(1):73−79.
[14]ÖZER A, AKKAYA G, TURABIK M. The biosorption of acid red 337 and acid blue 324 on enteromorpha prolifera: The application of nonlinear regression analysis to dye biosorption[J].Chemical Engineering Journal, 2005, 112(1/3): 181−190.
[15]MALL I D, SRIVASTAVA V C, AGARWAL N K, MISHRA I M. Removal of congo red from aqueous solution by bagasse fly ash and activated carbon: Kinetic study and equilibrium isotherm analyses[J]. Chemosphere, 2005, 61(4): 492−501.
[16]邹卫华, 陈宗璋, 韩润平, 谢 霜, 石 杰. 锰氧化物/石英砂(MOCS)对铜和铅离子的吸附研究[J]. 环境科学学报, 2005,25(6): 779−784.ZOU Wei-hua, CHEN Zong-zhang, HAN Run-ping, XIE Shuang,SHI Jie. Removal of copper cation and lead cation from aqueous solution by manganese-oxide-coated-sand [J]. Acta Scientiae Circumstantiae, 2005, 25(6): 779−784.
[17]BEREKET G, AROGUZ A Z, ÖZEL M Z. Removal of Pb(Ⅱ),Cd(Ⅱ), Cu(Ⅱ)and Zn(Ⅱ)from aqueous solutions by adsorption on bentonite [J]. Journal of Colloid and Interface Science, 1997, 187: 338−343.
[18]KILISLIOGLB A, BILGIN B. Thermodynamic and kinetic investigations of uranium adsorption on amberlite IR-118H resin[J]. Applied Radiation and Isotopes, 2003, 58(2): 155−160.
[19]EL-SHAHAWI M S, NASSIF H A. Retention and thermodynamic characteristics of mercury(Ⅱ)complexes onto polyurethane foams[J]. Analytica Chimica Acta, 2003, 481(1):29−39.
——以金红石为例

