快速共沉淀过程pH值对Ni0.8Co0.1Mn0.1(OH)2及LiNi0.8Co0.1Mn0.1O2性能的影响
王接喜, 李新海, 王志兴, 李灵均, 郭华军, 岳 鹏, 伍 凌
(中南大学 冶金科学与工程学院,长沙 410083)
体积小、能量密度大的锂离子电池在便携电子设备和电动汽车等领域具有很好的发展前景。其中层状结构正极材料LiCoO2已经得以大规模商业化应用,但是由于钴的毒性和高成本,其进一步的发展受到了限制[1−2];LiMn2O4材料由于在充放电过程中产生Jahn-Teller效应,发生形变,使其容量衰减较快,循环性能较差[3];LiNiO2具有与 LiCoO2相似的层状结构,毒性小,成本低,容量大,但因镍倾向于形成Ni2+,Ni2+过量时会占据Li+的位置,影响锂离子电池的电化学性能,另外,其安全问题也有待进一步解决[4]。
具有层状结构的 LiNi1−xMxO2(M=Co, Mn)和LiNi1−x−yCoxMnyO2多金属氧化物正极材料,不仅继承了 LiCoO2良好的循环性能、LiNiO2的高比容量和LiMn2O4的高安全性[5−6],而且还具有成本低、毒性小等优点[7],被认为是可替代 LiCoO2的正极材料之一[8−9]。NA 等[10]采 用 氢 氧 化 物 泥 浆 法 合 成LiNi0.5Mn0.5O2,在截止电压为4.6 V时的放电比容量明显高于4.3 V,但其循环性能基本不变;XIAO等[11]报道了聚合物热解法合成LiNi0.8Co0.2O2,在3.0~4.3 V电压区间内首次放电比容量为 189 mA·h/g;ZHANG等[12]利用草酸盐共沉淀法合成具有电化学活性的LiNi1/3Co1/3Mn1/3O2材料,在2.75~4.30 V电压区间内放电容量达到159.7 mA·h/g,在2.75~4.50 V电压区间内可达196.9 mA·h/g,循环性能好。
作为锂离子电池正极材料,LiNi0.8Co0.1Mn0.1O2在混合动力汽车的应用具有很好的发展前景,其研究受到广泛关注[13−14]。然而,容量衰减较快、循环性能差、低倍率性能等缺点制约着 LiNi0.8Co0.1Mn0.1O2的发展应用[13]。合成粒度细小的LiNi0.8Co0.1Mn0.1O2是提高其电化学性能的有效方法[15−16],因为小颗粒活性物质有利于锂离子的嵌入和脱出,充放电的可逆程度高[17−18]。传统的共沉淀法制备 Ni0.8Co0.1Mn0.1(OH)2前驱体时,由于反应时间长,合成材料颗粒粒径大,从而难以获得颗粒细小、具有优良电化学性能的正极材料[14, 19]。
在材料合成过程中,pH值对材料性能的影响较大。胡国荣等[20]报道了控制结晶法合成LiNi0.8Co0.2O2过程中,pH值是影响Ni0.8Co0.2(OH)2晶粒形貌和结晶程度的重要因素;郑俊超等[21]研究了制备过程中 pH对LiFePO4性能的影响,在pH值为2~5的范围内,合成的材料性能相差很大。本文作者以合成具有优良电化学性能的LiNi0.8Co0.1Mn0.1O2为目的,通过快速共沉淀(反应时间为1 min)合成氢氧化物前驱体,探讨合成过程中 pH值的影响,并对合成的前驱体和LiNi0.8Co0.1Mn0.1O2材料的结构、形貌及电化学性能进行研究。
1 实验
1.1 LiNi0.8Co0.1Mn0.1O2的合成
合成 Ni0.8Co0.1Mn0.1(OH)2前驱体主要包括以下几个步骤:1)将 NiCl2·6H2O、CoCl2·6H2O 和 MnCl2·4H2O按照摩尔比为8:1:1配成总金属浓度为2 mol/L的水溶液;2)将配成的溶液在50 ℃的恒温水浴锅中,在Ar保护气体下,将 NH3·H2O (2 mol/L)和 NaOH (2 mol/L)快速加入到溶液中,并控制pH值分别稳定在11.00、11.30、11.50、11.80和12.00;3)充分搅拌,反应 1 min后,过滤;4)滤渣用 pH值为 10.00~11.00的 NaOH水溶液洗涤3次,然后置于80 ℃烘箱中干燥24 h。得到的样品分别标记为A、B、C、D、E。
按照化学当量配比,称取 LiOH·H2O(过量系数取1.05),并将其与Ni0.8Co0.1Mn0.1(OH)2前驱体置于研钵中研磨40 min,充分混合均匀。将混合物置于管式炉中,通以氧气,首先在480 ℃保温5 h,然后在750 ℃下保温15 h,冷却至室温。得到的LiNi0.8Co0.1Mn0.1O2材料分别标记为a、b、c、d、e。
1.2 Ni0.8Co0.1Mn0.1(OH)2和 LiNi0.8Co0.1Mn0.1O2的分析与表征
利用等离子体发射光谱仪(ICP, IRIS intrepid XSP,Thermo Electron Corporation)分析样品的Ni、Co、Mn含量;采用日本Rint−2000型X射线衍射仪分析样品的物相组成(Cu Kα辐射,扫描速率 5(°)/min,管电压40 kV,管电流 250 mA,扫描范围2θ为 10°~85°),利用扫描电镜(SEM,JEOL,JSM−5600LV)对样品的形貌进行分析。
1.3 LiNi0.8Co0.1Mn0.1O2的电化学性能测试
将正极活性物质、乙炔黑和聚偏氟乙烯(PVDF)按质量比 8:1:1混合,加入溶剂 N−甲基−2−吡咯烷酮(NMP),研磨均匀,均匀刮涂于铝箔上,置于120 ℃烘箱中干燥后,切成直径为14 mm的正极片;以金属锂片为负极,聚丙烯膜为隔膜;以1 mol/L LiPF6的碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)和碳酸乙烯酯(EC)的混合液为电解液(DMC、EMC和EC体积比为1:1:1)。将上述材料在充满氩气的手套箱内组装成 2025型扣式电池,采用深圳新威电池测试仪进行恒电流充放电测试,充放电电压范围为2.7~4.3 V。对样品c做成的扣式电池进行了循环伏安测试,扫描范围为 2.7~4.5 V,扫描速率为0.1 mV/s.
2 结果与讨论
2.1 Ni0.8Co0.1Mn0.1(OH)2的成分分析
对不同pH值条件下合成的前驱体中Ni、Co、Mn含量进行了分析,所得结果见表1。
从表1中可以看出,随着pH值的增加,Ni、Co、Mn元素的总含量随着pH值的升高而增加,但三者各自的变化规律不一致。根据以下反应式:得知,溶液中金属离子的沉淀和络合平衡都受到 pH值的影响[21],随着pH值增加,溶液中OH−浓度增加,金属离子沉淀率增大;同时溶液中NH3浓度也增加,有利于金属离子与氨的络合,降低了溶液中金属自由离子的浓度,从而减少了金属氢氧化物的沉淀量。而金属氢氧化物的溶度积(Ksp)与金属离子氨配合物的配位常数(K1)变化规律不一致,在这两个因素的共同影响下,Ni、Co、Mn的沉淀呈现出不同的规律。
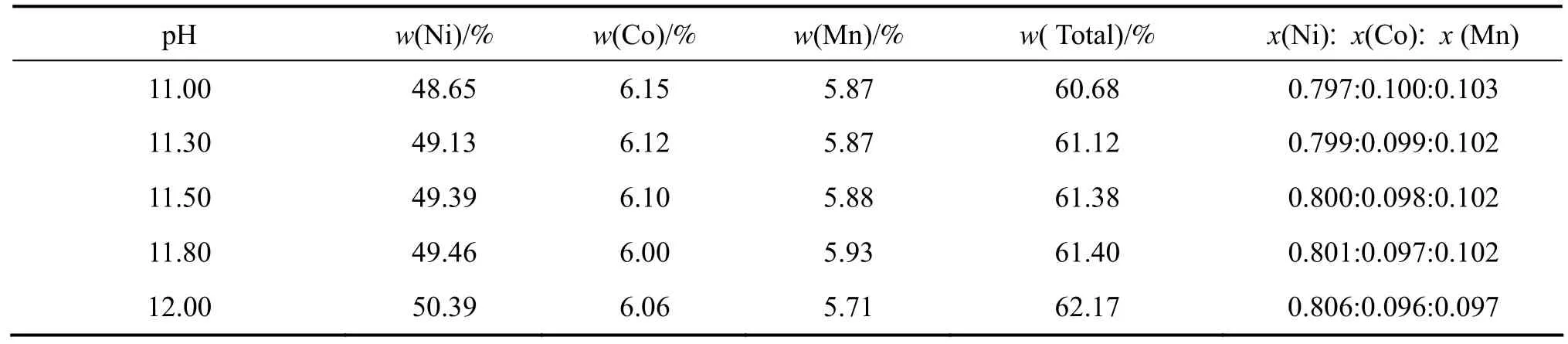
表1 不同pH值条件下合成Ni0.8Co0.1Mn0.1(OH)2前驱体的Ni、Co、Mn含量Table 1 Contents of Ni, Co, Mn in Ni0.8Co0.1Mn0.1(OH)2 prepared at different pH values
2.2 合成产物的XRD物相分析
为了探讨pH值对产物结构的影响,对不同pH值条件下合成的 Ni0.8Co0.1Mn0.1(OH)2前驱体和LiNi0.8Co0.1Mn0.1O2材料进行XRD分析,所得结果分别如图1和2所示。
图1所示为不同 pH值条件下合成的前驱体的XRD谱。从图 1可以看出,所有样品的谱线均与β-Ni(OH)2标准谱线几乎相同,并没有出现杂质峰。这表明,Co2+和Mn2+取代了部分Ni2+在Ni(OH)2中的位置,而不改变其本身晶体结构,所得前驱体均无杂相。
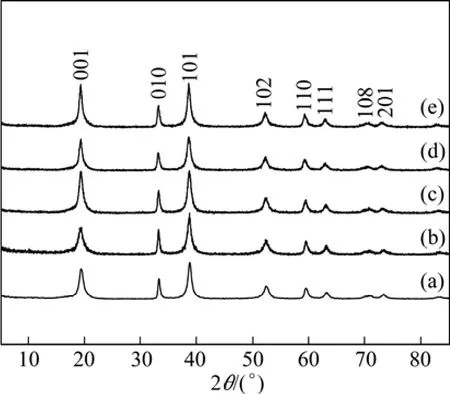
图1 不同pH条件下合成的Ni0.8Co0.1Mn0.1(OH)2的XRD谱Fig.1 XRD patterns of Ni0.8Co0.1Mn0.1(OH)2 prepared at different pH values: (a)pH=11.00; (b)pH=11.30; (c)pH=11.50; (d)pH=11.80; (e)pH=12.00
图2所示为不同 pH值条件下合成的正极材料LiNi0.8Co0.1Mn0.1O2的XRD谱。从图2可以看出,合成材料属于α-NaFeO2层状结构,各峰值符合六方晶系特征[22]。(006)/(102)峰、(108)/(110)峰分裂明显且没有杂质峰出现,为排列规则的六方晶型结构[23−24],以图2(c)中的谱线最为明显。
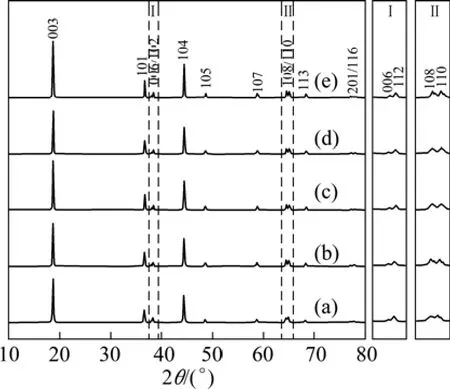
图2 不同pH条件下合成的LiNi0.8Co0.1Mn0.1O2的XRD谱Fig.2 XRD patterns of LiNi0.8Co0.1Mn0.1O2 prepared at different pH values: (a)pH=11.00; (b)pH=11.30; (c)pH=11.50; (d)pH=11.80; (e)pH=12.00
LiNi0.8Co0.1Mn0.1O2具有与 LiCoO2类似的层状结构。锂离子占据3a位置,过渡金属离子(Ni, Co, Mn)占据3b位置,氧原子占据6c位置。3a位置上的Li+与 3b位置上的 Ni2+由于半径相近,容易发生部分交错占据,这种晶体结构的位错现象叫做“阳离子混排”[5,25]。这种位错现象可用I(003)/I(104)值和c/a值来表征。一般情况下,I(003)/I(104)越大,c/a值越大,材料的结构位错越小,其层状结构越理想,电化学性能越好[16,26]。表2列出了LiNi0.8Co0.1Mn0.1O2样品的晶胞参数与其XRD谱线的I(003)/I(104)值。从表2可以看出,样品的I(003)/I(104)值均大于1.2,c/a值均大于4.9,说明合成样品的阳离子混排程度低,具有排列规则的层状结构;随着pH值的增加,I(003)/I(104)值和c/a值均先增加后减小,在pH值为11.50时同时达到最大值,说明样品c的阳离子混排程度最低,层状结构最为完善。
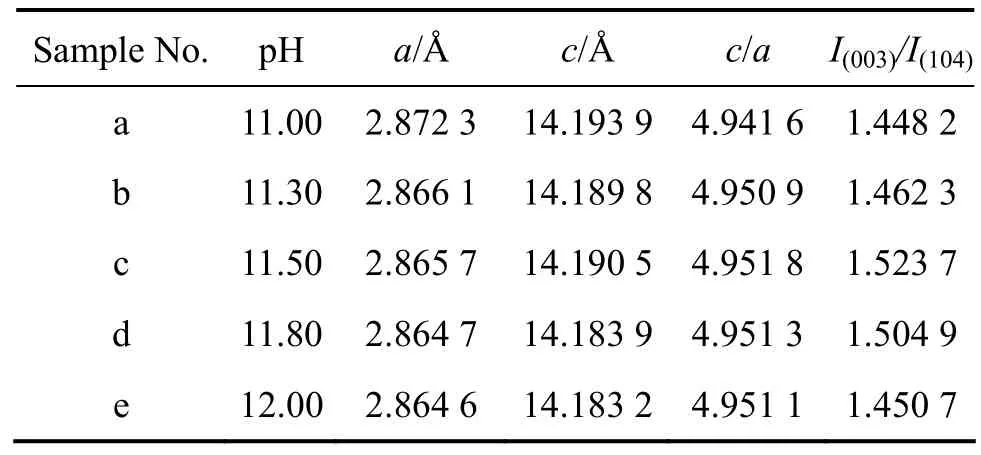
表2 不同pH条件下合成的LiNi0.8Co0.1Mn0.1O2样品的晶胞参数和I(003)/I(104)值Table 2 Comparison of lattice parameters of LiNi0.8Co0.1Mn0.1O2 synthesized at different pH values
2.3 合成产物的SEM分析
为了探讨pH值对产物粒度和形貌的影响,对不同 pH值条件下合成的前驱体与 LiOH·H2O 烧成的LiNi0.8Co0.1Mn0.1O2进行扫描电镜分析,所得结果如图3所示。
由图3可知,所合成的LiNi0.8Co0.1Mn0.1O2一次颗粒细小,约300~500 nm,粒径分布较均匀。与传统共沉淀方法(陈化时间 12 h)合成的材料粒径(500 nm~1 μm相比,该方法合成的材料颗粒明显细小[5−6]。随着pH值的升高,合成的LiNi0.8Co0.1Mn0.1O2二次颗粒尺寸呈略微增大的趋势,这与相关文献报道一致[20];pH值越大,对颗粒团聚的影响越不明显。样品形貌呈不规则形态,这是因为在制备前驱体时,反应时间短,颗粒生长不规则,从而使合成的 LiNi0.8Co0.1Mn0.1O2呈现不规则态。

2.4 合成产物的电化学性能测试
图4和 5所示分别为不同 pH值条件下合成的LiNi0.8Co0.1Mn0.1O2正极材料在 0.1C倍率下的首次充放电曲线和充放电循环图。其中pH值为11.00、11.30、11.50、11.80和12.00时合成的材料做成的扣式电池分别用P1、P2、P3、P4和P5表示。
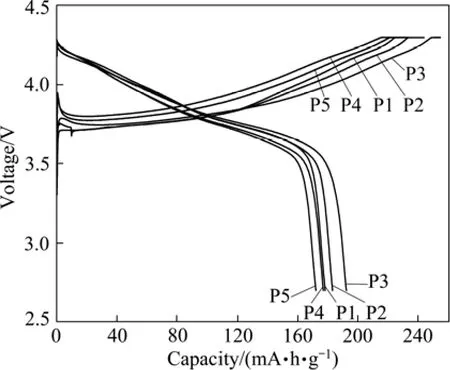
图4 不同pH值条件下合成的LiNi0.8Co0.1Mn0.1O2的首次充放电曲线Fig.4 Initial charge-discharge curves of LiNi0.8Co0.1Mn0.1O2 prepared at different pH values: P1—pH=11.00; P2—pH=11.30; P3—pH=11.50; P4—pH=11.80; P5—pH=12.00
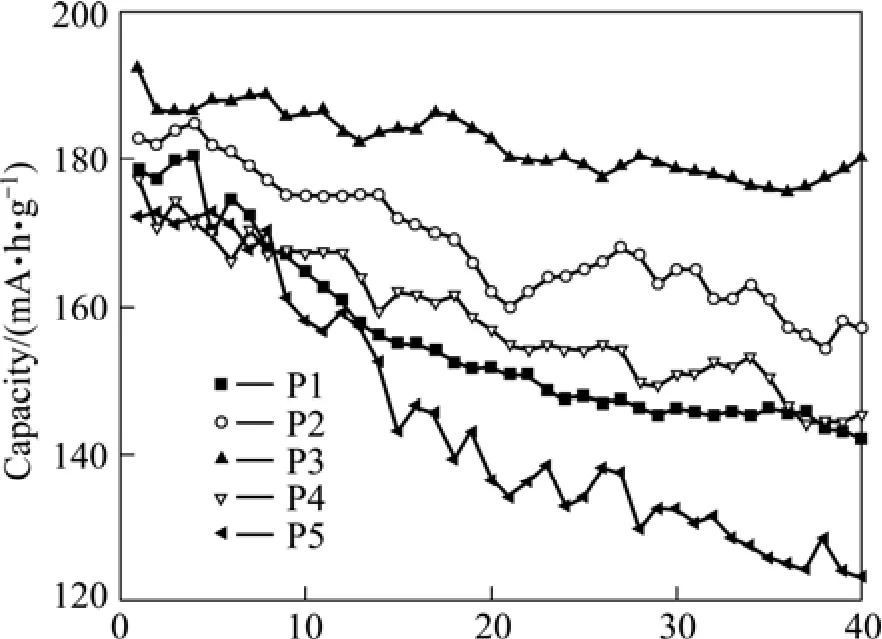
图5 不同pH值条件下合成的LiNi0.8Co0.1Mn0.1O2的充放电循环图Fig.5 Cycling performance of LiNi0.8Co0.1Mn0.1O2 prepared at different pH values: P1—pH=11.00; P2—pH=11.30;P3—pH=11.50; P4—pH=11.80; P5—pH=12.00
由图4可以看出,P1、P2、P3、P4和P5的首次充电比容量分别为231.1、244.1、254.9、233.4和234.8 mA·h/g;放电比容量分别为 178.3、183.0、192.4、177.0和 172.1 mA·h/g;首次充放电效率分别为 77.06%、74.97%、75.59%、75.83%和73.30%。其中P3的首次放电比容量最高,即当 pH值为11.50时,以合成的Ni0.8Co0.1Mn0.1(OH)2前驱体为原料制备出的LiNi0.8Co0.1Mn0.1O2正极材料首次充放电性能最佳。
由图5可以看出,在0.1C倍率下经40次充放电循环后,P1、P2、P3、P4和P5的容量保持率分别为79.6%,85.79%,91.56%,82.1%和71.6%。
图6所示为P3的循环伏安图。从图3可以看出,在3 V附近没有出现还原峰,说明循环过程中没有发生Mn3+/Mn4+的转换[27]。 同时还可以看出,在首次循环时,其氧化峰电位约为3.90 V,而在随后的循环过程中,其氧化峰电位降低到3.84 V左右,峰强度相对首次循环明显减弱;然而其还原峰始终保持不变。这种氧化峰的衰减可能是在首次循环过程中“阳离子混排”引起的,首次循环后,随后二、三次循环伏安曲线几乎重叠,表明在制备出的 LiNi0.8Co0.1Mn0.1O2材料中,锂离子在嵌入/脱出过程中具有较好的可逆性。
综上所述,制备过程中 pH 值对Ni0.8Co0.1Mn0.1(OH)2及 LiNi0.8Co0.1Mn0.1O2性能的影响较大,当pH值控制在11.50左右时,可以获得具有优异性能的LiNi0.8Co0.1Mn0.1O2正极材料。
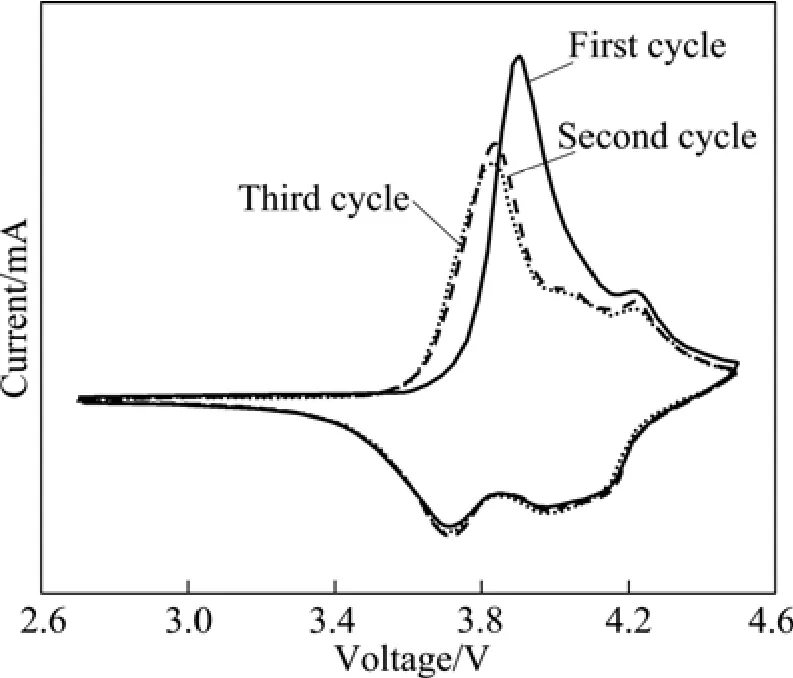
图6 样品P3的循环伏安图Fig.6 Cyclic voltammetry of sample P3
3 结论
1) 采用快速共沉淀法在不同 pH值条件下合成Ni0.8Co0.1Mn0.1(OH)2前驱体,结果表明,在 pH值为11~12时,合成的 Ni0.8Co0.1Mn0.1(OH)2特征峰均与β-Ni(OH)2相符合,无杂质峰。随着pH值的变化,前驱体中Ni、Co、Mn沉淀率分别呈现不同的变化规律,但Ni、Co、Mn总含量随着pH值的升高而增加。
2) 可以通过控制制备过程中 pH值来控制Ni0.8Co0.1Mn0.1(OH)2及 LiNi0.8Co0.1Mn0.1O2颗粒的团聚程度和晶体结构,利用快速共沉淀法合成的LiNi0.8Co0.1Mn0.1O2材料一次颗粒细小,约为 300~500 nm,二次颗粒随着pH值的升高而略微变大,合成的LiNi0.8Co0.1Mn0.1O2特征峰与 α-NaFeO2相符合,具有完善的层状结构,表明细化颗粒、降低结晶度有利于前躯体和锂源的均匀混合,降低 LiNi0.8Co0.1Mn0.1O2材料的阳离子混排程度。
3) 不同pH值条件下合成LiNi0.8Co0.1Mn0.1O2电化学性能差异较大,以pH值为11.50条件下合成的前驱体制备出的 LiNi0.8Co0.1Mn0.1O2正极材料晶粒结构最完善,电化学性能最优。该样品在0.1C倍率下的首次放电比容量达到了192.4 mA·h/g,40次循环后容量保持率为91.56%,循环过程中并没有出现Mn3+/Mn4+的转换,经一次循环后,材料结构趋于稳定。
[1]GOODENOUGH J B, KIM Y. Challenges for rechargeable Li batteries[J]. Chemistry of Materials, 2010, 22(3): 587−603.
[2]YUE Hong-jun, HUANG Xing-kang, LÜ Dong-ping, YANG Yong. Hydrothermal synthesis of LiMn2O4/C composite as a cathode for rechargeable lithium-ion battery with excellent rate capacity[J]. Electrochimica Acta, 2009, 54(23): 5363−5367.
[3]ZHENG Jun-chao, LI Xin-hai. LiFePO4with enhanced performance synthesized by a novel synthetic route[J]. Journal of Power sources, 2008, 184(2): 574−577.
[4]SUBRAMANIAN V, KARKI K, RAMBABU B. Synthesis and electrochemical properties of submicron LiNi0.5Co0.5O2[J]. Solid State Ionics, 2004, 175(1/4): 315−318.
[5]王希敏, 王先友, 易四勇, 曹俊琪. 层状锂离子电池正极材料LiNi0.8Co0.1Mn0.1O2的制备及性能[J]. 过程工程学报, 2007,7(4): 817−821.WANG Xi-min, WANG Xian-you, YI Si-yong, CAO Jun-qi.Synthesis and characteristics of layered LiNi0.8Co0.1Mn0.1O2cathode material for lithium rechargeable batteries[J]. Chinese Journal of Process Engineering, 2007, 7(4): 817−821.
[6]LEE M H, KANG Y J, MYUNG S T, SUN Y K. Synthetic optimization of Li[Ni1/3Co1/3Mn1/3]O2via co-precipitation[J].Electrochimica Acta, 2004, 50(4): 939−948.
[7]SAAVEDRA-ARIAS J J, KARAN N K, PRADHAN D K,KUMAR A, NIETO S, THOMAS R, KATIYAR R S. Synthesis and electrochemical properties of Li(Ni0.8Co0.1Mn0.1)O2cathode material: Ex situ structural analysis by Raman scattering and X-ray diffraction at various stages of charge-discharge process[J].Journal of Power Sources, 2008, 183(2): 761−765.
[8]LIU Z L, YU A S, LEE J Y. Synthesis and characterization of LiNi1-x-yCoxMnyO2as the cathode materials of secondary lithium batteries[J]. Journal of Power Sources, 1999, 81/82: 416−419.
[9]LIAO P Y, DUH J G, SHEEN S R. Effect of Mn content on the microstructure and electrochemical performance of LiNi0.75-xCo0.25MnxO2cathode materials[J]. Journal of the Electrochemical Society A, 2005, 152(9): 1695−1700.
[10]NA S H, KIM H S, MOON S I. A new synthetic route of LiNi0.5Mn0.5O2as the cathode material of secondary lithium batteries[J]. Electrochimica Acta, 2004, 50(2/3): 449−452.
[11]XIAO Li-fen, YANG Yan-yan, ZHAO Yan-qiang, AI Xin-ping,YANG Han-xi, CAO Yu-liang. Synthesis and electrochemical properties of submicron LiNi0.8Co0.2O2by a polymer-pyrolysis method[J]. Electrochimica Acta, 2008, 53(6): 3007−3012.
[12]ZHANG Chuan-fu, YANG Ping, DAI Xi, XIONG Xuan, ZHAN Jing, ZHANG Yin-liang. Synthesis of LiNi1/3Co1/3Mn1/3O2cathode material via oxalate precursor[J].Transactions of Nonferrous Metals Society of China, 2009, 19(3): 635−641.
[13]LI Ling-jun, LI Xin-hai, WANG Zhi-xing, WU Ling, ZHENG Jun-chao, LI Jin-hui. Synthesis of LiNi0.8Co0.1Mn0.1O2cathode material by chloride co-precipitation method [J]. Transactions of Nonferrous Metals Society of China, 2010, 20(Supplement 1):s279−s282.
[14]KIM M H, SHIN H S, SHIN D, SUN Y K. Synthesis and electrochemical properties of Li[Ni0.8Co0.1Mn0.1]O2and Li[Ni0.8Co0.2]O2via co-precipitation [J]. Journal of Power Sources, 2006, 159(2): 1328−1333.
[15]LI Ling-jun, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun, YUE Peng, CHEN Wei, WU Ling. Synthesis, structural and electrochemical properties of LiNi0.79Co0.1Mn0.1Cr0.01O2via fast co-precipitation [J]. Journal of Alloys and Compounds, 2010,507(1): 172−177.
[16]OH S W, PARK S H, PARK C W, SUN Y K. Structural and electrochemical properties of layered Li[Ni0.5Mn0.5]1−xCoxO2positive materials synthesized by ultrasonic spray pyrolysis method[J]. Solid State Ionics, 2004, 171(3/4): 167−172.
[17]LI Jian-gang, HE Xiang-ming, ZHAO Ru-song, WAN Chun-rong, JIANG Chang-yin, XIA Ding-guo, ZHANG Shi-chao. Stannum doping of layered LiNi3/8Co2/8Mn3/8O2cathode materials with high rate capability for Li-ion batteries[J].Journal of Power Sources, 2006, 158(1): 524−528.
[18]DILLON A C, MAHAN A H, DESHPANDE R, PARILLA P A,JONES K M, LEE S H. Metal oxide nano-particles for improved electrochromic and lithium-ion battery technologies[J]. Thin Solid Films, 2008, 516(5): 794−797.
[19]LUO Xu-fang, WANG Xian-you, LIAO Li, GAMBOA S,SEBASTIAN P J. Synthesis and characterization of high tap-density layered Li[Ni1/3Co1/3Mn1/3]O2cathode material via hydroxide co-precipitation [J]. Journal of Power Sources, 2006,158(1): 654−658.
[20]胡国荣, 刘艳君, 彭忠东, 杜 柯, 高旭光. 控制结晶法合成球形正极材料 LiNi0.8Co0.2O2及其电化学性能[J]. 中国有色金属学报, 2007, 17(1): 59−67.HU Guo-rong, LIU Yan-jun, PENG Zhong-dong, DU Ke, GAO Xu-guang. Synthesize and properties of spherical cathode materials LiNi0.8Co0.2O2by controlled crystallization method[J].The Chinese Journal of Nonferrous Metals, 2007, 17(1): 59−67.
[21]郑俊超, 李新海, 王志兴, 郭华军, 王丹琴. 制备过程 pH 值对FePO4·xH2O及 LiFePO4性能的影响[J]. 中国有色金属学报,2008, 18(5): 867−872.ZHENG Jun-chao, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun,WANG Dan-qin. Effect of pH value on performance of FePO4·xH2O and LiFePO4in synthesis process[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(5): 867−872.
[22]胡学山, 刘兴泉. LiNi1/3Co1/3Mn1/3O2的制备及电化学性能[J].电源技术, 2006, 30(3): 183−186.HU Xue-shan, LIU Xing-quan. Synthesis of cathode material LiNi1/3Co1/3Mn1/3O2and its electrochemical performances[J].Chinese Journal of Power Sources, 2006, 30(3): 183−186.
[23]PARK S H, YOON C S, KANG S G, KIM H S, MOON S I, SUN Y K. Synthesis and structural characterization of layered Li[Ni1/3Co1/3Mn1/3]O2cathode materials by ultrasonic spray pyrolysis method[J]. Electrochimica Acta, 2004, 49(4): 557−563.
[24]LIAO Li, WANG Xian-you, LUO Xu-fang, WANG Xi-ming,GAMBOA S, SEBASTIAN P J. Synthesis and electrochemical properties of layered Li[Ni0.333Co0.333Mn0.293Al0.04]O2−zFzcathode materials prepared by the sol-gel method[J]. Journal of Power Sources, 2006, 160(1): 657−661.
[25]WHITFIELDP S,DAVIDSON I J,CRANSWICK L M D,SWAINSON I P, STEPHENS P W. Investigation of possible superstructure and cation disorder in the lithium battery cathode material LiMn1/3Ni1/3Co1/3O2using neutron and anomalous dispersion powder diffraction[J]. Solid State Ionics, 2005,176(5/6): 463−471.
[26]CHOI Y M, IIPYUN S, MOON S I. Effects of cation mixing on the electrochemical lithium intercalation reaction into porous Li1−δNi1−yCoyO2electrodes[J]. Solid State Ionics, 1996, 89(1/2):43−52.
[27]OHZUKU T, UEDA A, NAGAYAMA M.Electrochemistry and structural chemistry of LiNiO2(R3-m)for 4 volt secondary lithium cells[J]. Journal of the Electrochemical Society, 1993,140(7): 1862−1870.

