SO2还原沉金后液回收硒碲及捕集铂钯
郑雅杰, 陈昆昆, 孙召明
(中南大学 冶金科学与工程学院,长沙 410083)
铜阳极泥是电解精炼粗铜时所产生的不溶物,它的产率一般为电解铜产量的0.2%~1.0%,因其中含有大量的贵金属和稀有元素而成为提取稀贵金属的重要原料[1]。目前,国内采用湿法流程处理铜阳极泥的工厂已达 40%以上。铜阳极泥经预处理[2−4]脱铜(硒碲)之后,采用亚硫酸钠或氨水浸出银、氯酸钠浸出金工艺分别得到分银液和分金液,分银液用水合肼或甲醛还原得到银粉,分金液用亚硫酸钠或草酸还原得到金粉和沉金后液[5]。沉金后液含有大量的硒碲铂钯,目前一般在沉金后液中加入锌粉置换铂钯得到铂钯精矿,其工艺简单,操作方便;但是,锌粉置换法得到的铂钯精矿中铂钯含量低,回收铂钯时损失大,造成硒碲流失,锌粉用量大,生产成本高[6−12]。此外,有报道采用铜粉或铜片置换沉淀溶液中的硒碲,不过沉淀物中的硒和碲是以硒化铜和碲化铜的形式存在,不利于后续硒碲分离,延长了工艺流程[13−15]。本文作者采用SO2直接还原沉金后液回收硒碲和捕集铂钯[16],该处理工艺使硒和碲得到回收,所得还原产物硒碲品位高,有利于硒碲分离回收;另外,铂、钯等贵金属得到完全回收并高度富集,为含稀贵金属溶液的有效综合利用提供一条可行途径。
1 实验
1.1 实验步骤
实验取某铜冶炼厂草酸还原分金液得到的沉金后液,其成分如表1所列。
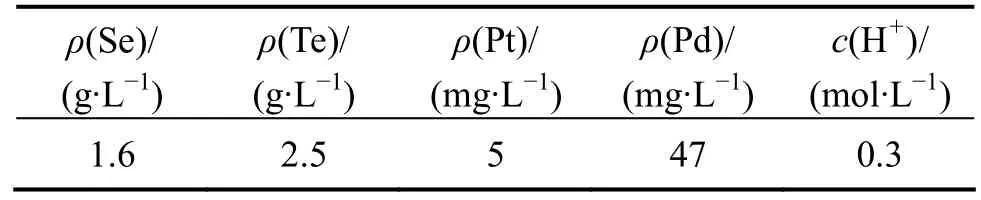
表1 沉金后液主要化学成分Table 1 Main chemical compositions of solution after precipitating gold
准确量取一定量的沉金后液,倒入容量为1 L的三颈瓶中,启动搅拌,使用硫酸调整原料酸度,使用氯化钠增加溶液 Cl−浓度,并在电热套中加热至一定温度,通入恒定流量的SO2还原,反应一段时间后过滤、洗涤、烘干得到硒碲精矿用于分别回收硒碲和铂钯,滤液返回用于调整酸度。其工艺流程如图1所示。
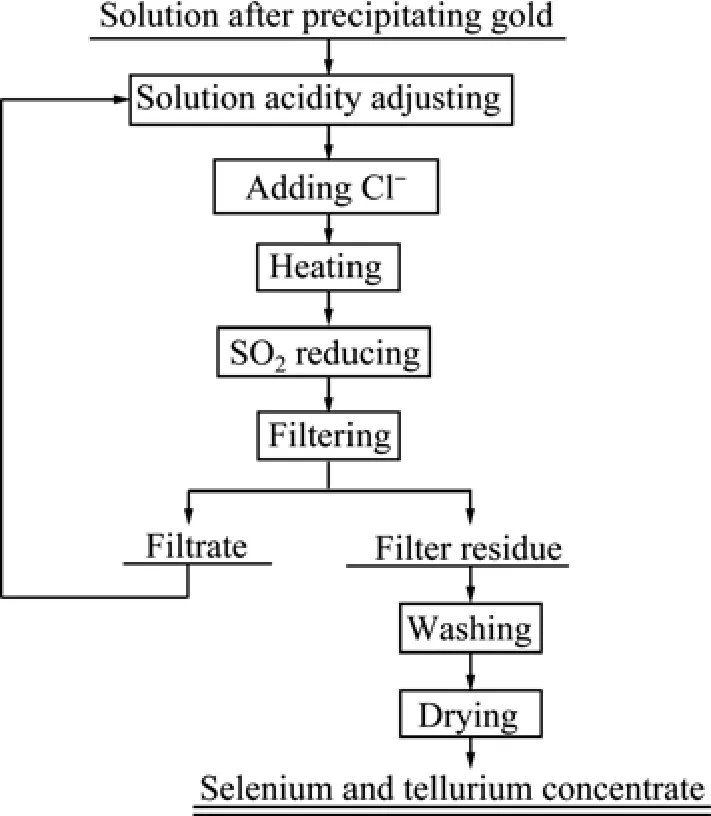
图1 沉金后液回收硒碲精矿工艺流程Fig.1 Flow sheet of recovering selenium and tellurium concentrate from solution after precipitating gold
1.2 分析与检测
采用美国热电元素公司的Intrepid II XSP型电感耦合等离子体发射光谱仪(ICP)分析溶液化学成分;X射线荧光光谱仪(XRF)分析固体物质成分;日本理学D/max-TTR III型X射线衍射仪(XRD)分析固体物质物相;日本电子株式会社JSM−6300型扫描电镜(SEM)观察固体产物微观形貌。
2 结果与讨论
2.1 反应温度对硒和碲回收率的影响
实验取500 mL沉金后液,根据SO2完全还原溶液中 Se(Ⅳ)、Te(Ⅳ)及电子得失平衡可以计算出 SO2流量应控制在 0.2~0.5 L/min,加入 Cl−有利于碲还原[17];当反应时间为2.5 h,SO2流量为0.2 L/min,Cl−浓度为0.72 mol/L时,考察反应温度对硒和碲回收率的影响,如图2所示。
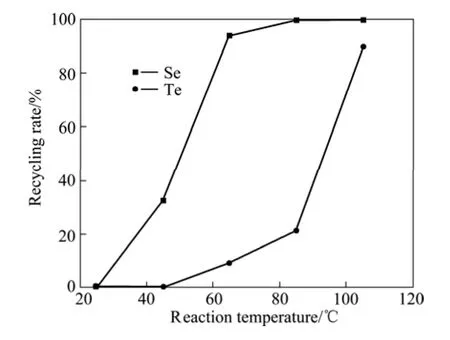
图2 反应温度对硒和碲回收率的影响Fig.2 Effect of reaction temperature on recycling rate of selenium and tellurium
由图2可知,硒碲的回收率均随反应温度的升高而增加,反应温度为65℃时硒回收率达到93.7%,继续升高反应温度,硒回收率变化不大;当反应温度≤85 ℃时,碲回收率≤21.4%,而当反应温度达到105 ℃时,碲回收率达到89.79%。由于反应温度为105 ℃时,水份蒸发快,酸雾大。因此,还原反应温度选择为85℃,硒回收率为99.67%,碲回收率为21.4%。
2.2 Cl−浓度对硒和碲回收率的影响
上述其它实验条件不变,当反应温度为85 ℃时,考察Cl−浓度对硒和碲回收率的影响,如图3所示。
由图3可知,硒和碲回收率随Cl−浓度增加而增加,当Cl−浓度从0 mol/L增加到0.96 mol/L时,硒回收率从66.57%增加到100%,碲回收率从15.35%增加到 22.25%。Cl−对 SO2还原 Se4+和 Te4+具有催化作用[18],因此增加 Cl-浓度有利于提高硒和碲回收率。当Cl−浓度为0.72 mol/L时,硒回收率为99.67%,碲回收率为21.4%;当Cl−浓度为0.96 mol/L时,硒和碲回收率增加不大。因此沉金后液 Cl−浓度选择为0.72 mol/L。
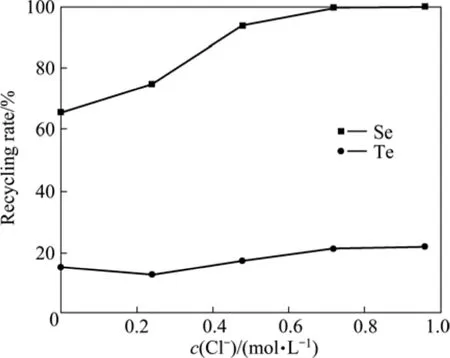
图3 Cl−浓度对硒和碲回收率的影响Fig.3 Effect of concentration of Cl− on recycling rate of selenium and tellurium
2.3 反应时间对硒和碲回收率的影响
上述其它实验条件不变,当Cl−浓度为0.72 mol/L时,考察反应时间对硒和碲回收率的影响,如图4所示。
由图4可知,硒和碲回收率随反应时间的延长而增加,反应时间为2.5h时硒回收率达到 99.67%,继续延长反应时间对硒回收率影响不大;反应时间≤4 h时,碲回收率≤66.47%,当反应时间延长到5 h时,碲回收率达到77.22%。由于反应时间过长会增加生产成本,因此还原反应时间选择为4 h。图4所示也反映出溶液中 Se(Ⅳ)、Te(Ⅳ)的还原顺序,很显然 Se(Ⅳ)先于Te(Ⅳ)被还原出来。
2.4 H+浓度对硒和碲回收率的影响
上述其它实验条件不变,当反应时间为4 h时,考察H+浓度对硒和碲回收率的影响,如图5所示。

图4 反应时间对硒和碲回收率的影响Fig.4 Effect of reaction time on recycling rate of selenium and tellurium

图5 H+浓度对硒和碲回收率的影响Fig.5 Effect of concentration of H+ on recycling rate of selenium and tellurium
由图5可知,H+浓度对硒回收率没有影响,而碲回收率随 H+浓度的增加而增加,当 H+浓度为 3.3 mol/L时,碲回收率达到了100%。沉金后液中Se(Ⅳ)和 Te(Ⅳ)分别以 SeO32−、HSeO3−、H2SeO3和 TeO32−、HTeO3−、H2TeO3和 H3TeO3+等形态存在,其热力学关系式[19−22 ]为

式中:KT为反应热力学平衡常数;νi为化学计量系数;为反应各物质标准吉布斯自由能。根据式(1)及[M(Ⅳ)]T= [MO32−]+[HMO3−]+[H2MO3]+[ H3MO3+],其中[M(Ⅳ)]T指溶液中M4+的总浓度而M指硒或碲,由此可以得到25 ℃时沉金后液中,Se(Ⅳ)和Te(Ⅳ)的不同形态组分浓度百分率对pH的关系式分别如下:

根据式(2)~(8),可以绘制出 25 ℃时沉金后液中Se(Ⅳ)和Te(Ⅳ)的不同形态组分浓度百分率对pH的关系图,分别如图6和7所示。

图6 Se(Ⅳ)浓度组分—pH曲线Fig.6 Curves of Se(Ⅳ)concentration—pH
由图6可知,pH≤2时,Se(Ⅳ)主要以H2SeO3形态存在;由图7可知,pH≤2时,Te(Ⅳ)主要以H3TeO3+形态存在。当H+浓度为 3.3 mol/L,即pH=−0.52时,由式(2)~(8)可以计算出不同形态组分浓度百分率,此时沉金后液中 SeO32−、HSeO3−、TeO32−、HTeO3−和H2TeO3含量很少,可以忽略不计,因此,Se(Ⅳ)主要以H2SeO3形式与SO2反应,Te(Ⅳ)主要以H3TeO3+形式与SO2反应。

图7 Te(Ⅳ)浓度组分—pH图Fig.7 Relationship between Te(Ⅳ)concentration and pH
在含 Se(Ⅳ)和 Te(Ⅳ)的沉金后液中通入 SO2后,所涉及氧化和还原反应如表2所列[22−23]:

表2 电极反应及标准电极电位Table 2 Electrode reaction and standard electrode potential
从上述标准电极电位判断,在沉金后液中还原电极电位 H2SeO3较 H3TeO3+正,H2SeO3更容易与 SO2反应,从而 Se(Ⅳ)比Te(Ⅳ)更快被还原出来,溶液中铂和钯在氯离子络合作用下容易被SO2还原出来,有关氧化还原反应如下:
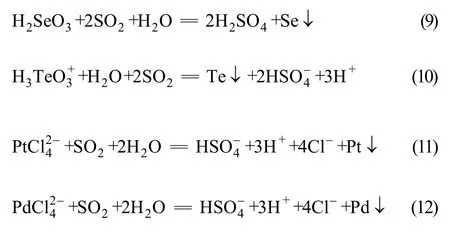
上述研究表明,SO2还原沉金后液回收硒碲适宜条件如下:反应温度为85 ℃,反应时间为4 h,H+浓度为3.3 mol/L,Cl−浓度为0.72 mol/L。
2.5 放大实验
实验取4 L溶液,在反应温度为85 ℃、反应时间4 h、H+浓度为3.3 mol/L、Cl−浓度为0.72 mol/L条件下进行放大实验,反应后溶液成分及回收率和所得固体产物成份分别如表3和4所列,对反应所得产物进行X衍射和表面电子扫描电镜(SEM)分析,其实验结果分别如图8和9所示。对某铜业公司提供的锌粉置换所得铂钯精矿进行化学成分分析,其结果如表5所列。

表3 放大实验还原后液主要成分Table 3 Main compositions of solution obtained by amplification experiment

表4 放大实验还原产物主要成分Table 4 Main compositions of product obtained by amplification experiment (mass fraction, %)
由表3可知, 硒和碲几乎全部被还原,同时铂和钯也得到完全回收,硒回收率为 99.5%,碲回收率为96.64%,铂和钯回收率均达到了100%;由表4可知,还原产物中硒、碲、铂和钯的质量分数分别为28.06%、52.3%、0.084%和0.588%。由表4和5比较可知,采用SO2直接还原法得到的铂钯精矿中硒碲含量远高于采用锌粉置换法得到的铂钯精矿中硒碲含量,使硒碲得到有效富集,有利于硒碲分离回收;此外,采用锌粉置换法得到的铂钯精矿残留大量的锌粉,不利于后续硒碲铂钯的分离,而采用SO2直接还原法可以避免锌粉浪费,可降低生产成本。

图8 还原产物XRD谱Fig.8 XRD pattern of reduction product

图9 还原产物的SEM像Fig.9 SEM images of reduction product: (a)Spheroid body;(b)Columnar body

表5 某铜业公司锌粉置换所得还原产物主要成分Table 5 Main compositions of product obtained by zinc powder cementation (mass fraction, %)
由图8可知,SO2还原沉金后液中硒和碲,得到单质态硒和碲。由图9可知,还原产物微观形貌为球状体和柱状体。由于SO2还原沉金后液回收硒碲和捕集铂钯技术的优点和先进性,目前该技术已申请国家发明专利[16]并在我国应用于工业生产。
3 结论
1) 采用SO2还原沉金后液回收硒碲,并捕集铂钯,硒碲回收率随反应温度升高而增加,随 Cl−浓度增加而增加,随反应时间延长而增加;碲回收率随H+浓度的增加而增加,而H+浓度对硒回收率没有影响。
2) SO2直接还原沉金后液回收硒和碲的适宜条件如下:反应温度为85 ℃,SO2流量为0.2 L/min,反应时间 4 h,H+浓度为 3.3 mol/L,Cl−浓度为 0.72 mol/L。沉金后液在此条件下处理后,其浓度中 Se为 0.008 g/L,Te为0.084 g/L,Pt为0 g/L,Pd为0 g/L,Se和Te回收率分别为99.5%和96.64%,Pt和Pd回收率均达到了100%。
3) 所得黑色还原产物中硒、碲、铂和钯的质量分数分别为 28.06%、52.3%、0.084%和 0.588%;采用SO2还原沉金后液中硒和碲,得到单质态硒和碲,还原产物形貌为球状体和柱状体。
[1]郭学益, 肖彩梅, 钟菊芽, 田庆华. 铜阳极泥处理过程中贵金属的行为[J]. 中国有色金属学报, 2010, 20(5): 990−998.GUO Xue-yi, XIAO Cai-mei, ZHONG Ju-ya, TIAN Qing-hua.Behaviors of precious metals in process of copper anode slime treatment[J]. The Chinese Journal of Nonferrous Metals, 2010,20 (5): 990−998.
[2]郑雅杰, 孙召明, 汪 蓓, 滕 浩, 洪 波. 阳极泥预处理及回收稀散金属的方法: CN, 101338368A[P]. 2009-01-07.ZHENG Ya-jie, SUN Zhao-ming, WANG Bei, TENG Hao,HONG Bo. The method to pretreat the anode slime and recycle rare metals: CN, 101338368A[P]. 2009-01-07.
[3]张博亚, 王吉坤. 加压酸浸预处理铜阳极泥的工艺研究[J].矿冶工程, 2007, 27(5): 41−43.ZHANG Bo-ya, Wang Ji-kun. The technological research on pre-treating copper anode slime with pressure acid leaching method[J]. Mining and Metallurgical Engineering, 2007, 27 (5):41−43.
[4]HOFFMANN J E. Recovering selenium and tellurium from copper refinery slimes[J ]. The Journal of the Minerals Material Society, 1989, 41(7): 33−38.
[5]王吉坤, 张博亚. 铜阳极泥现代综合利用技术[M]. 北京: 冶金工业出版社, 2008.WANG Ji-kun, ZHANG Bo-ya. Modern utilization technology of copper anode slime[M]. Beijing: Metallurgical Industry Press,2008.
[6]胡建辉. 从金还原后液中置换铂钯的工艺优化研究[J]. 湿法冶金, 2000, 19(2): 22−25.HU Jian-hui. Study on optimum process for displacing Pt and Pd from the solution Au reduced[J]. Hydrometallurgy of China,2000, 19(2): 22−25.
[7]叶跃威, 杨建国. 用锌粉从高铜铅含氰贵液中置换金银[J].湿法冶金, 2007, 26(3): 150−153.YE Yue-wei, YANG Jian-guo. Displacement of gold and silver from cyanide leaching solution containing copper and lead with zinc powder[J]. Hydrometallurgy of China, 2007, 26(3):150−153.
[8]王爱荣, 李春侠. 从铂钯精矿中提取 Au, Pt, Pd[J]. 贵金属,2005, 26(4): 14−17.WANG Ai-rong, LI Chun-xia. Abstraction of gold, platinum and palladium from platinum and palladium concentrate[J]. Precious Metals, 2005, 26(4): 14−17.
[9]张钦发, 龚竹青, 陈白珍. 从铂钯精矿中提取金铂钯的研究-铂钯精矿的预处理[J]. 矿冶工程, 2002, 22(2): 70−72.ZHANG Qin-fa, GONG Zhu-qing, CHEN Bai-zhen.Investigation on extraction of Au, Pt and Pd-Pretreatment of the concentrate[J]. Mining and Metallurgical Engineering, 2002,22(2): 70−72.
[10]HUANG Kun, CHEN Jing, CHEN Yi-ran, ZHAO Jia-chuang, LI Qi-wei, YANG Qiu-xue, ZHANG Yong. Enrichment of platinum group metals (PGMs)by two-stage selective pressure leaching cementation from low-grade Pt-Pd sulfide concentrates[J].Minerals, Metals & Mater Soc & ASM Int B, 2006, 37(5):697−701.
[11]FLEMING C A. Hydrometallurgy of precious metals recovery[J].Hydrometallurgy, 1992, 30(3): 127−162.
[12]CHEN Jing, HUANG Kun. A new technique for extraction of platinum group metals by pressure cyanidation[J].Hydrometallurgy, 2006, 82(3): 164−171.
[13]李运刚. 湿法处理铜阳极泥工艺研究(Ⅰ)—铜, 硒, 碲的浸出[J]. 湿法冶金, 2000, 19(1): 41−45.Li Yun-gang. Study on hydrometallurgical processing for copper-bearing anode mud(Ⅰ)—selective leaching of Cu, Se and Te[J]. Hydrometallurgy of China, 2000, 19(1): 41−45.
[14]SHIBASAKI T, ABE K, TAKEUCHI H. Recovery of tellurium from decopperizing leach solution of copper refinery slimes by a fixed bed reactor[J]. Hydrometallurgy, 1992, 29(3): 339−412.
[15]WANG Shi-jie, WESSTROM B, FEMANDEZ J. A novel process for recovery of Te and Se from copper slimes autoclave leach solution[J]. Journal of Minerals & Materials Characterization & Engineering, 2003, 2(1): 53−64.
[16]郑雅杰, 陈昆昆. 从溶液中回收稀贵金属的一种方法: CN,201010266679.0[P]. 2010-08-30.ZHENG Ya-jie, CHEN Kun-kun. The method to recover rare and noble metals from the solution: CN, 201010266679.0[P].2010-08-30.
[17]马玉天, 龚竹青, 陈文汨, 李宏煦, 阳征会, 黄 坚. 从硫酸溶液中还原制取金属碲粉[J]. 中国有色金属学报, 2006, 16(1):189−194.MA Yu-tian, GONG Zhu-qing, CHEN Wen-mi, LI Hong-xu,YANG Zheng-hui, HUANG Jian. Preparation of powdered-tellurium by reduction from sulfuric acid solution[J].The Chinese Journal of Nonferrous Metals, 2006, 16(1):189−194.
[18]CLARKE A G, RADOJEVIC M. Chloride ion effects on the aqueous oxidation of SO2[J]. Atmospheric Environment, 1983,17(3): 617−624.
[19]MCPHAIL D C. Thermodynamic properties of aqueous tellurium species between 25 and 350℃[J]. Geochimica et Cosmochimica Acta, 1995, 59(5): 851−866.
[20]SEBY F, POTIN-GAUTIER M, GIFFAUT E, BORGE G,DONARD O F X. A critical review of thermodynamic data for selenium species at 25 ℃[J]. Chemical Geology, 2001, 171(3/4):173−194.
[21]XIONG Yong-Liang. Predicted equilibrium constants for solid and aqueous selenium species to 300 ℃: Applications to selenium-rich mineral deposits[J]. Ore Geology Reviews, 2003,23(3/4): 259−276.
[22]杨显万, 何蔼平, 袁宝州. 高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983.YANG Xian-wan, HE Ai-ping, YUAN Bao-zhou.High-temperature thermodynamic data of aqueous solution manual[M]. Beijing: Metallurgical Industry Press, 1983.
[23]BOUROUSHIAN M. Electrochemistry of metal chalcogendies[M]. Berlin: Springer-Verlag, 2010.

