患子宫内膜炎奶牛免疫应答变化规律的研究
李德军,刘运枫,周晓玲,郭定宗
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江省动物卫生监督所,哈尔滨 150010;3.华中农业大学动物医学院,武汉 430070)
子宫内膜炎是奶牛最为常见的一种产科疾病,是引起奶牛不孕的重要原因之一,特别是患有隐性子宫内膜炎的奶牛,由于没有明显的临床症状,大多数情况下都延误了最佳治疗时机,导致患牛因久治不育而被淘汰,给养殖户造成严重的经济损失[1]。
正常情况下,子宫通过机械性保护屏障和免疫功能阻止和消灭侵入的病原体,以维持正常生理活动的进行。一旦这两种防御体系受到破坏,就会发生子宫内的炎症过程。子宫具有区别于其他器官的防御机制,但非特异性免疫和特异性免疫仍然是子宫免疫反应的两大主要类型。病原菌侵入机体要通过两道屏障:第一道屏障即子宫的物理排除能力,若细菌突破这道防线,就会遇到第二道防线即子宫内膜中分布的免疫细胞如巨噬细胞、自然杀伤细胞和T淋巴细胞及由他们分泌的细胞因子,从而激发了免疫应答,产生免疫球蛋白[2]。本研究通过对血液中淋巴细胞亚型(CD4+、CD8+)、血液和子宫分泌物中免疫球蛋白(IgA、IgG、IgM)的含量变化的监测,探讨患子宫内膜炎的奶牛特异性防御系统的变化过程。
1 材料与方法
1.1 试验动物的选择及分组
在某大型奶牛场选择膘情良好,没有外伤、乳房炎、营养代谢不良等疾病及未经抗生素治疗的3~8岁产后表现健康的荷斯坦奶牛,分别于产后7、14、21、28、35、42、49 d 七个时间点进行血液及子宫分泌物的采集。并在21 d时对实验牛的阴道分泌物进行检查,将阴道内有粘液脓性和脓性分泌物排出的奶牛作为临床型子宫内膜炎组(CE),共有30头;将阴道分泌物中中性粒细胞大于18%作为亚临床型子宫内膜炎组(SE),共有28头;将阴道分泌物中中性粒细胞小于18%作为对照组(N),共有10头[3]。
1.2 血液样品的采集及处理
肝素抗凝血1 mL,缓慢加入含有等体积的淋巴细胞分离液的离心管中,1 500 r·min-1,离心15 min。小心吸取中间白膜层,加入PBS,1 500 r·min-1,离心10 min,重复2次,制成淋巴细胞悬液,调整细胞浓度为1×106个·mL-1。取1 mL细胞悬液,1 000 r·min-1,离心10 min,弃上清。加入100 μL PBS悬浮细胞。将细胞悬液加入已含有10 μL特异性FITC标记的CD4+或CD8+抗体的塑料离心管,4℃孵育30 min,洗涤2次。加入300 μL PBS,避光,1 h内上BD FACS Calibur流式细胞仪进行检测。
另取2 mL非抗凝血,水浴30 min,4 000 r·min-1,离心5 min,取血清,按照潍坊三维生物工程集团有限公司检测免疫球蛋白(IgG/IgA/IgM)的试剂盒进行测定。
1.3 子宫分泌物样本的采集及处理
消毒外阴,借助开口器,将含有20 mL灭菌乳酸林格氏液的子宫清洗器送入子宫体内,通过直肠内的另一只手将子宫内的液体由子宫体移到子宫角进行反复冲洗。然后用一个长60 cm的硬质塑料管将分泌物吸出,取一滴滴于载玻片上,风干、染色、镜检;剩余部分贮存于无菌试管中,-20℃保存备用。测定方法同血液样本。
1.4 数据处理
应用SAS for Windows 6.12软件对数据进行统计分析,结果以平均数±标准差(X±S)表示。
2 结果与分析
2.1 血液中CD4+、CD8+细胞变化
CE组血液中CD4+百分数除第14天外,其他各时间点均极显著高于对照组(P<0.01)。SE组在产后第7和第21天时与对照组比差异极显著(P<0.01),其他时间点均无显著性差异(P>0.05)。CE组和SE组比较,仅在28和49 d时存在显著性差异(P<0.01)(见图 1) 。
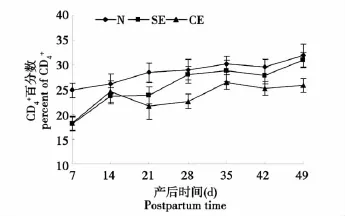
图1 子宫内膜炎奶牛血液中CD4+百分数变化Fig.1 Percentage change of CD4+T cells in blood of cows with endometritis
CE组CD8+百分数与对照组比较差异极显著(P<0.01)。SE组在第28、35和42天时与对照组比较差异极显著(P<0.01),除第21天无显著性差异外(P>0.05),其他各时间点表现差异显著(P<0.05)(见图2)。

图2 子宫内膜炎奶牛血液中CD8+百分数变化Fig.2 Percentage change of CD8+T cells in blood of cows with endometritis
2.2 血液中CD4+/CD8+变化
由图3可知,SE组和CE组CD4+/CD8+比值显著低于对照组,SE组CD4+/CD8+比值高于CE组。
2.3 血液和子宫分泌物中IgG、IgA、IgM浓度的变化
从表1可见,SE组和CE组IgG浓度极显著低于N组(P<0.01)。SE组和CE组变化比较在21和35 d时无显著性差异(P>0.05)。
三组IgA浓度变化虽然较缓慢,但SE、CE组与N组间均存在极显著性差异(P<0.01)。SE组变化较其余两组显著,在产后28 d时,IgA的浓度有所降低,随后很快又呈升高趋势。
CE组血清中IgM浓度极显著低于N组(P<0.01),产后第49天时达到峰值。SE组血清中IgM浓度产后第2周有所下降,之后又开始回升,升高幅度极显著高于CE组,且在产后第6周时,浓度值高于N组。
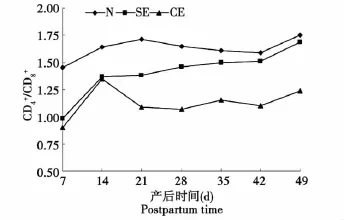
图3 子宫内膜炎奶牛血液中CD4+/CD8+比值的变化Fig.3 Ratio Change of CD4+/CD8+in blood of cows with endometritis
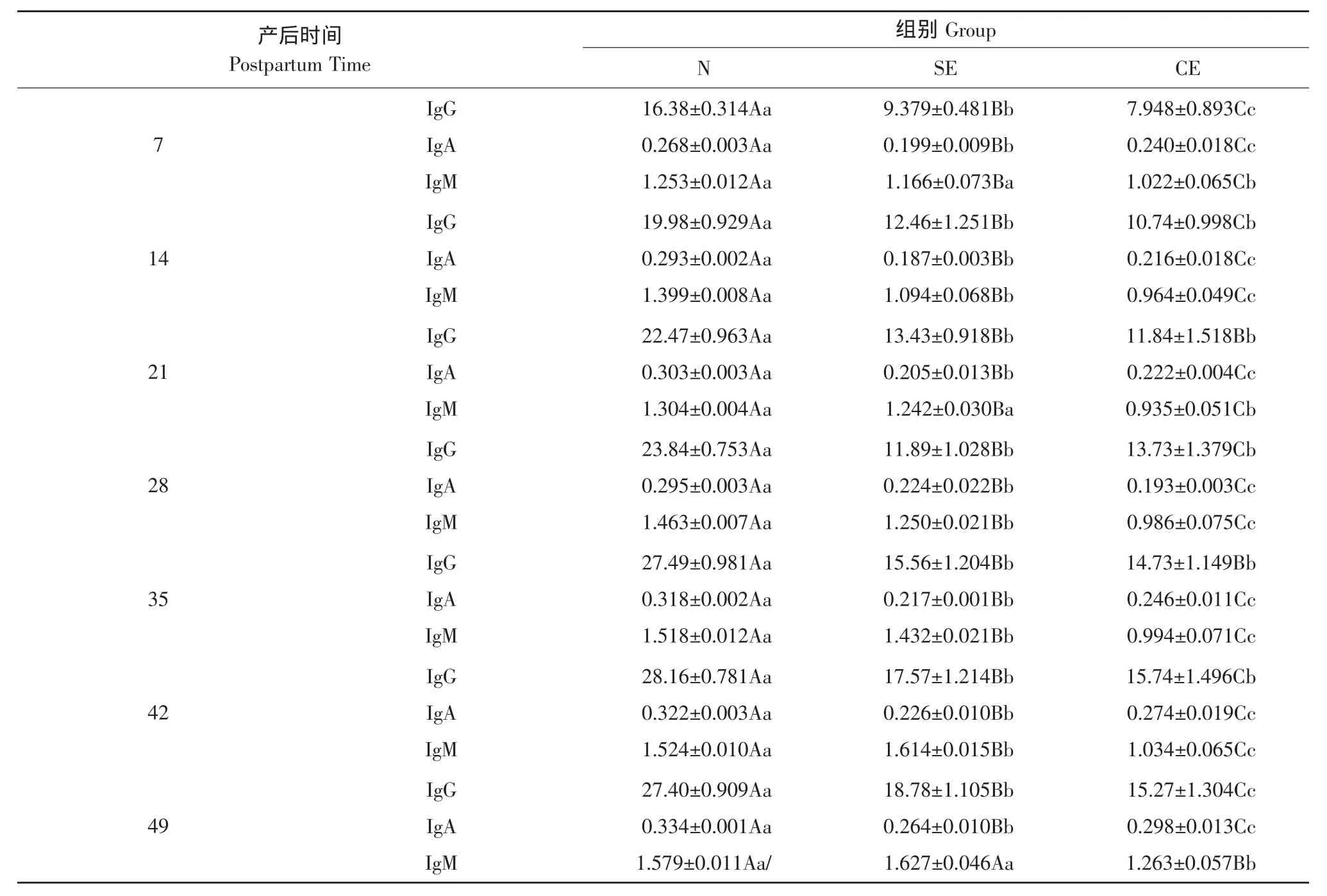
表1 子宫内膜炎奶牛血清中IgG、IgA、IgM浓度的变化Table 1 Concentration change of IgG,IgA,IgM in serum of cows with endometritis (mg·mL-1)

表2 子宫内膜炎奶牛子宫分泌物中IgG、IgA、IgM浓度的变化Table 2 Concentration change of IgG、IgA、IgM in uterine secretion of cows with endometritis (mg·mL-1)
由表2可知,SE组和CE组子宫分泌物中,IgA和IgM的浓度变化高于N组,而IgG的浓度变化没有规律性。SE组和CE组子宫分泌物中IgG浓度变化呈上升趋势,在产后头3周均低于N组,之后CE组极显著高于对照组(P<0.01),SE组也在产后第35天开始与对照组存在显著性差异(P<0.05)。
3 讨论
3.1 子宫的细胞免疫防御机制
健康、未孕的动物子宫内最主要的白细胞亚型是T淋巴细胞、巨噬细胞和中性粒细胞,其中T淋巴细胞主要是CD4+(辅助型)、CD8+(细胞毒素型)和CD2+亚群,这些细胞的迁移和分布,在子宫局部免疫中起着重要作用。T细胞亚群能反映宿主免疫调节能力,CD4+/CD8+比值更能反映宿主细胞免疫状态,为预后提供参考。当局部体液免疫应答的作用受到限制时,细胞免疫在子宫免疫防御方面就变得很重要[4]。T淋巴细胞是细胞免疫和体液免疫的重要环节,能在抗原刺激下活化产生功能各异的淋巴因子,调节体液免疫[5]。
本试验结果表明,SE组血液中CD4+比例显著升高;CD8+细胞呈现先降低后升高趋势,说明感染初期,CD4+和CD8+T淋巴细胞均被活化,但CD4+细胞被活化的程度比CD8+明显,所以CD4+/CD8+比值也呈现升高趋势。说明SE组辅助性T淋巴细胞的作用要强于细胞毒性T淋巴细胞的作用,此时机体的免疫力主要由辅助性T淋巴细胞激活细胞因子,产生大量可以中和抗原的抗体。辅助性T淋巴细胞还可以诱导T和B淋巴细胞在局部淋巴结的增殖。这些淋巴细胞随后迁移到子宫内膜作为细胞介导和抗体介导的免疫应答的效应器。
而CE组血液中CD4+、CD8+细胞比例变化的波动,决定了CD4+/CD8+比值呈现相应的变化。说明CE组产后以辅助T淋巴细胞的作用为主,接着CD8+被活化激活后,抑制了CD4+的作用,从而机体表现免疫力降低,但在产后第7周后,机体又开始逐渐恢复到原来的水平。
3.2 子宫的体液免疫防御机制
产后生殖道疾病的发展在很大程度上取决于奶牛本身的天然抵抗力。而且依赖于局部子宫的免疫机制。而了解这一机制,就要研究IgS的水平和分泌。一些研究已经证明了牛子宫分泌物中有Ig存在并且具有抵抗感染的作用,本试验对子宫分泌物中三种免疫球蛋白的检测结果也说明了这点。这些免疫球蛋白可作为调理素增强吞噬作用来直接溶解细菌或者刺激补体途径来完成对细菌的消灭作用[6-7]。
本试验结果表明,三种免疫球蛋白在血中和子宫分泌物中的含量各不相同。血液中主要以IgG、IgM为主,IgA含量很少。而子宫分泌物中,主要以IgG和IgA为主,IgM占少数。说明当炎症发生时,子宫分泌物中IgA的量超过了IgM的生成量,此结果表明IgA在炎症过程中,除由外周血中转入子宫腔内外,还可由子宫粘膜进行表达,这也证明了当炎症发生后,子宫粘膜的局部免疫发挥着主要的作用,这与Pierce研究的结果相似[8]。
本试验中,子宫分泌物IgA和IgM的含量在炎症过程中呈现降低趋势,而IgG呈现升高变化,这与Kowald等的报道不完全相同,这可能是由于IgG除了可由子宫内膜合成外,还可由血液转运而来,而IgA和IgM主要由子宫内膜合成,由于子宫内膜受损导致二者的生成减少[9-10]。Butt等经过试验证明,子宫中多数IgG2和一半IgG1来自血清。由此可见,当子宫发生炎症时,机体会动员免疫防御系统来参与免疫应答[11]。
4 结论
通过本试验我们发现,当CD4+/CD8+比值降低时,血液中免疫球蛋白(IgG、IgM、IgA) 的含量呈升高趋势,说明细胞免疫降低时,体液免疫正在加强,机体通过对免疫系统的调节来抵御炎症反应的过程。
[1] 史同瑞.奶牛子宫内膜炎研究新进展[J].中国奶牛,2006(6):36-40.
[2] 贾杏林,齐长明.奶牛子宫内膜炎研究进展[J].中国兽医杂志,2005(2):43-45.
[3] Kasimanickam R,Duffield T F,Foster R A,et al.Endometrial cytology and ultrasonography for the detection of subclinical endometritis in postpartum dairy cows[J].Theriogenology,2004,62:9-23.
[4] MesteckyJ,MoldoveanuZ,Russell M W.Immunological uniqueness of the genital tract:challenge for vaccine development[J].American Journal of Reproductive and Immunology,2005,53:208-214.
[5] Sato S.Immunosuppression in periparturient cows and the effects of immunostimulation[J].Tohoku J Veterinary Clnics,1998,21:61-70.
[6] Dhaliwal G S,Murray R D,Dobson H,et al.Presence of antigen and antibodies in serum and genital discharges of heifers after intrauterine inoculation of Leptospira interrogans serovar hardjo[J].Research in Veterinary Science,1996,60:157-162.
[7] Butler J E.Bovine immunoglobulins:an augmented review[J].Veterinary Immunology and Immunopathology,1983,43:43-52.
[8] Pierce A E.Specific antibodies at mucous surfaces[J].Vet.Rec.Annot,1999(5):17-36.
[9] Kowald A and Kirkwood T B L.Mitochondrial mutations,cellular instability and aging:modeling the population dynamics of mitochondria[J].Mutat Res,1993,295:93-103.
[10] Williams E J,Fischer D P,Pfeiffer D U.Clinical evaluation of postpartum vaginal mucus reflects uterine bacterial infection and the immune response in cattle[J].Theriogenology,2005,63:102-117.
[11] Butt B,Besser M T E,Senger P L,et al.Specific antibody to Haemophilus Somnus in the bovine uterus following intramuscular immunization[J].Infect Immun,1993,61:2 558-2 562.

