几种氨基酸对哲罗鱼生长、消化酶活性及血液生化指标的影响
王常安,徐奇友,许 红,尹家胜,孙大江
(中国水产科学研究院黑龙江水产研究所,哈尔滨 150070)
随着动物蛋白供应紧张,价格上涨,植物蛋白的研究与应用越来越引起人们的关注。而当饲料中植物蛋白添加比例增大后,一个突出的问题是,饲料的适口性下降。促摄食物质对改善饲料适口性,刺激嗅觉和味觉等感觉器官,提高饲料转化效率,促进鱼体生长等具有重要意义。日本、美国、前苏联早在60年代就开始采用多种方法对水产动物促摄食物质进行了研究[1],而国内起步较晚[2],仅在(Carassius auratus)[3]、泥鳅(Misgurnus anguillicaudatus)[3]、黄鳝 (Monopterus albus)[4]等进行过研究。
氨基酸及其混合物是较好的鱼类促摄食物质,而有关氨基酸对哲罗鱼的促生长研究鲜有报道。已有研究表明哲罗鱼配合饲料中鱼粉添加量应不小于40%[5],为降低鱼粉的添加比例,本试验研究了在低鱼粉配合饲料中添加4种晶体氨基酸对哲罗鱼的摄食、生长及生理生化指标的影响,以期为晶体氨基酸在哲罗鱼饲料中的合理应用奠定基础。
1 材料与方法
1.1 试验动物
选择体重为(9.29±0.34)g健康的哲罗鱼幼鱼750尾,随机分至15个玻璃钢水族箱(直径90 cm,水深45 cm)中,每缸50尾。
1.2 试验设计与试验饲料
试验共5个处理,每个处理3个重复。以鱼粉含量30%的基础饲料作为对照组,在此基础上分别添加0.5%L-Glu、0.5%L-Ala、0.5%Gly和0.5%L-Pro晶体氨基酸,其中氨基酸添加量参照文献[3-6]。饲料原料粉碎后过60目筛,制粒(1.5 mm),-20℃冰箱中保存。试验基础饲料配方及营养水平见表1[7]。基础饲料氨基酸组成及含量见表2(色氨酸未检)。L-谷氨酸纯度为99.6%,甘氨酸纯度为99.1%,L-丙氨酸纯度为95.8%,L-脯氨酸纯度为99.0%。

表1 基础饲料配方及营养组成(干重)Table 1 Ingredients and approximate composition in the basal diets(air-dry basis) (%)

续表
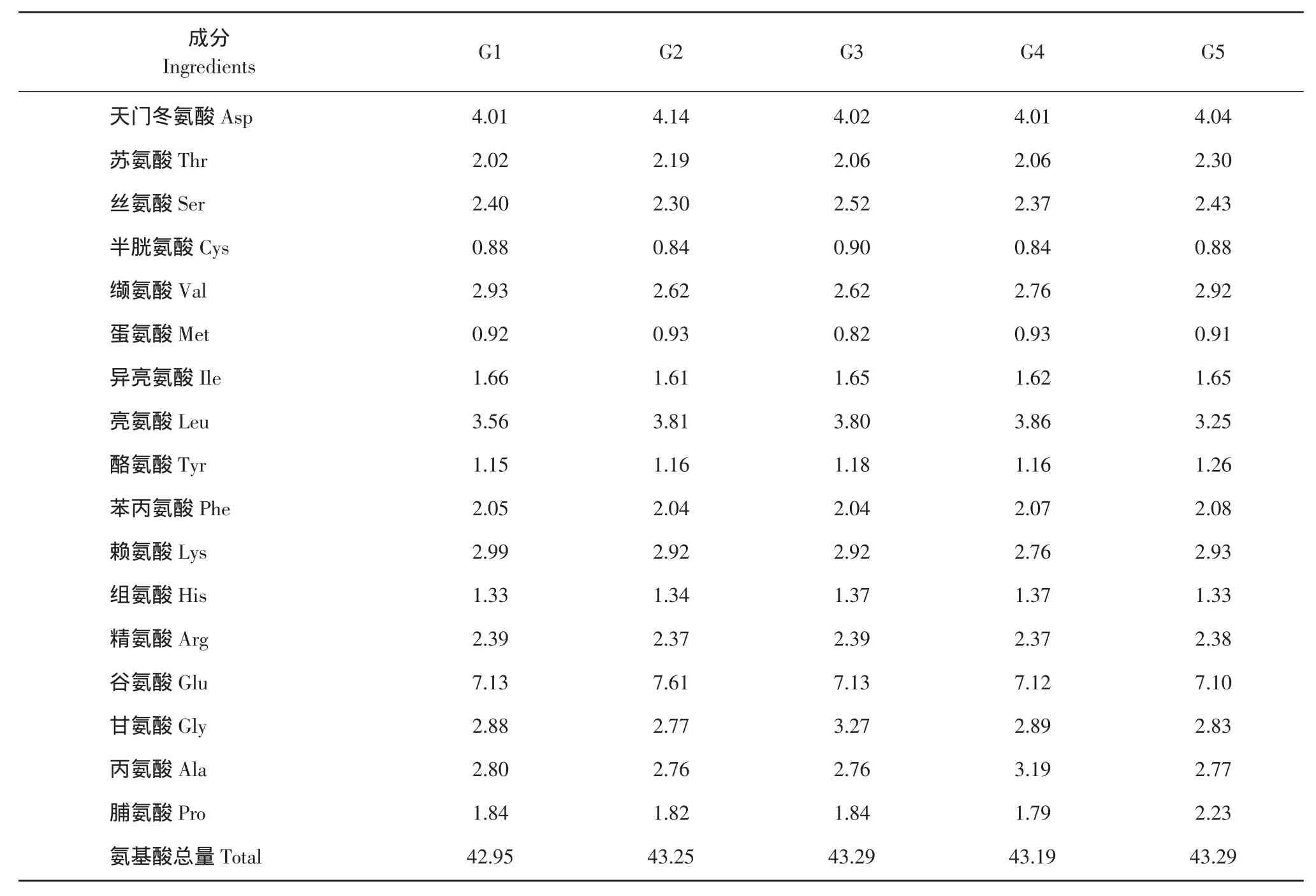
表2 饲料氨基酸分析结果(干重)Table 2 Analysis result of the amino acids in the basal diets(air-dry basis) (%)
1.3 饲养管理
以商用饲料驯化7 d后正式试验,流水饲养(0.3×10-3)~(0.4×10-3)m3·h-1,养殖周期为 56 d。水温9.8~14.2℃,进出水口溶氧8.0~9.0 mg·L-1,pH 7.5~7.8。每天投喂2次,分别在上午8:30和16:30进行,饱食投喂,各组尽量保持一致的投喂量。每14 d调整投喂量。试验结束后,鱼体饥饿24 h,称重。每重复随机采集8尾鱼,其中4尾用于体成分分析,另4尾用于消化酶活性分析和血液生化指标。
1.4 样品采集与分析
1.4.1 体成分
用105℃干燥恒重法测定水分含量;以凯氏定氮法测定粗蛋白;使用索氏乙醚抽提法测定粗脂肪;以马福炉550℃灼烧样品7 h测定粗灰分。
1.4.2 消化酶活性
冰盘上解剖,取出肝和消化道,剔除脂肪和内含物,用冰浴生理盐水洗净,以滤纸吸干水分后称重。加入9倍体积的预冷生理盐水,匀浆。4℃条件下,4 000 r·min-1离心10 min,取上清液放为粗酶液,置于-80℃冰箱待测。蛋白酶测定采用福林-酚法[8],脂肪酶用聚乙烯醇橄榄油乳化液水解法测定[9],淀粉酶以淀粉-碘比色法测定[10]。
1.4.3 血液生化指标
尾部采血[11]。静置30 min,在4℃条件,3 000 r·min-1离心10 min,分离血清,置于-80℃冰箱保存待测。血清生化指标采用生化分析仪(贝克曼ProCX4, 美 国)测 定 。 胆 固 醇(Cholesterol,CHOL)、甘油三酯(Glycerinate,TG)、血糖(Blood glucose,GLU)用酶法,补体C3和C4以免疫比色法,高密度脂蛋白(High density lipoprotein,HDL)、低密度脂蛋白(Low density lipoprotein,LDL)通过直接法,总蛋白(Total protein,TP)和球蛋白(Globulin,GLB)以化学法,白蛋白(Albumin,ALB)是计算值,碱性磷酸酶(Alkaline phosphatase,ALP)、谷丙转氨酶(Alanine transaminase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)采用速率法。
1.5 统计分析
生物指标计算:增重率(%)=100×(Wt-W0)/W0;特定生长率(%)=100×(LnWt-LnW0)/t;摄食率(%)=100×F/W0;成活率(%)=100×Nf/Ni;肥满度=100×Wt/Lt3;饵料系数=F/(Wt-W0)。
其中,W0为试验开始时鱼体质量(g);Wt为试验结束时鱼体质量(g);Nf为终末尾数;Ni为初始尾数;Lt试验结束时鱼体长(cm);F为饲料摄入量(g);t为饲养时间(d)。
试验结果以平均值±标准差(X±S)表示,采用SAS 8.2进行单因素方差分析和Duncan′s多重比较,显著性水平设为0.05。
2 结果与分析
2.1 氨基酸对哲罗鱼生长性能影响
基础饲料中分别添加0.5%的 L-Glu、L-Ala、Gly和L-Pro未显著提高哲罗鱼生长性能。各处理组哲罗鱼增重率、特定生长率、肥满度和成活率均未呈现显著差异(P>0.05)。从各处理组的摄食率数据看,饲料中分别添加晶体氨基酸L-Glu、L-Ala、Gly、L-Pro后未显著提高哲罗鱼摄食量(P>0.05)。同时,饲料系数亦未呈现显著变化(P>0.05)。在本试验条件下,几种晶体氨基酸单独添加在哲罗鱼基础饲料中,其促摄食和生长效果并不明显;几种非必需氨基酸的添加亦未显著提高饲料转化率。

表3 氨基酸对哲罗鱼生长性能的影响Table 3 Effects of amino acids on growth performances in taimen Hucho taimen
2.2 对体成分影响
基础饲料中分别添加0.5%L-Glu、0.5%LAla、0.5%Gly和0.5%L-Pro对哲罗鱼鱼体粗脂肪、粗灰分和水分均无显著影响(P>0.05),特别对鱼体粗蛋白亦均无显著影响(P>0.05)。可以看出,在本试验条件下,几种非必需氨基酸的添加对哲罗鱼的身体组成影响不大。
结果见表4。
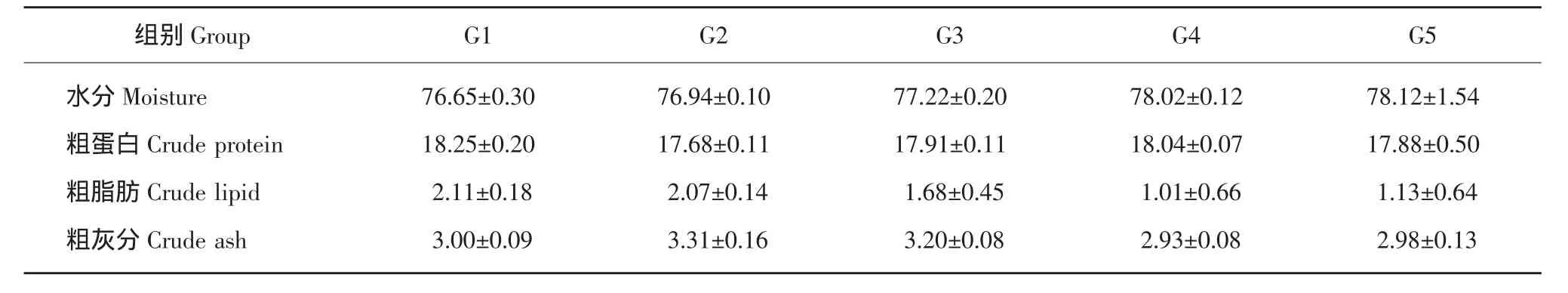
表4 氨基酸对哲罗鱼体成分的影响Table 4 Effects of amino acids on proximate composition in taimen Hucho taimen (%)
2.3 对消化酶影响
如表5所示,饲料中分别添加0.5%L-Glu、0.5%L-Ala、0.5%Gly和0.5%L-Pro对哲罗鱼肝蛋白酶、脂肪酶和淀粉酶活性均无显著影响(P>0.05);对胃蛋白酶、脂肪酶和淀粉酶活性均无显著影响(P>0.05);与对照组前肠+幽门盲囊(哲罗鱼的幽门盲囊个数较多,而且多分散在前肠部位,很难将两者分开,故将两者同时进行测定)蛋白酶、脂肪酶和淀粉酶活性均差异不显著(P>0.05);与对照组后肠蛋白酶、脂肪酶和淀粉酶活性均差异不显著(P>0.05)。可见,饲料中分别添加0.5%L-Glu、0.5%L-Ala、0.5%Gly和0.5%L-Pro未显著提高哲罗鱼消化道及消化腺的消化酶活性,因而,未显著改变机体消化能力。
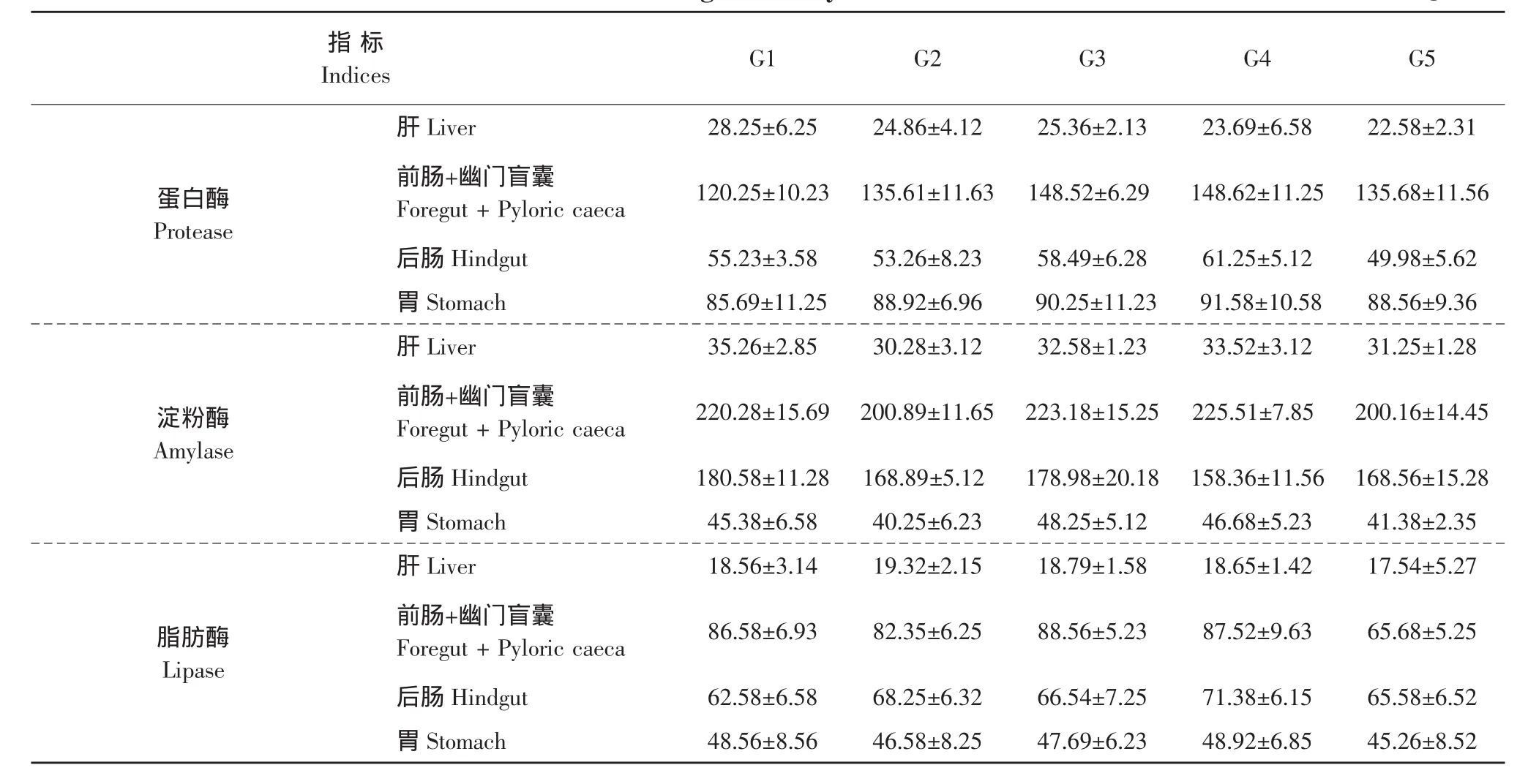
表5 氨基酸对哲罗鱼消化酶的影响Table 5 Effects of amino acids on digestive enzyme activities in taimen Hucho taimen (U·g-1)
2.4 对血液生化指标影响
饲料中分别添加0.5%L-Glu、0.5%L-Ala、0.5%Gly和0.5%L-Pro对哲罗鱼血清生化指标影响(见表6)。由表中可以看出,各处理组间血清生化指标无显著差异(P>0.05)。饲料中分别添加0.5%L-Glu、0.5%L-Ala、0.5%Gly和 0.5%L-Pro后并没有显著提高血清TP和ALB(P>0.05),未显著影响转氨酶ALT和AST水平(P>0.05);对血脂(TG、CHOL、HDL、LDL)及免疫指标(GLB、ALP、C3、C4)亦无显著影响(P>0.05)。由此可以得出,饲料中几种非必需氨基酸的添加,可能并未改变哲罗鱼机体的代谢水平及免疫力。
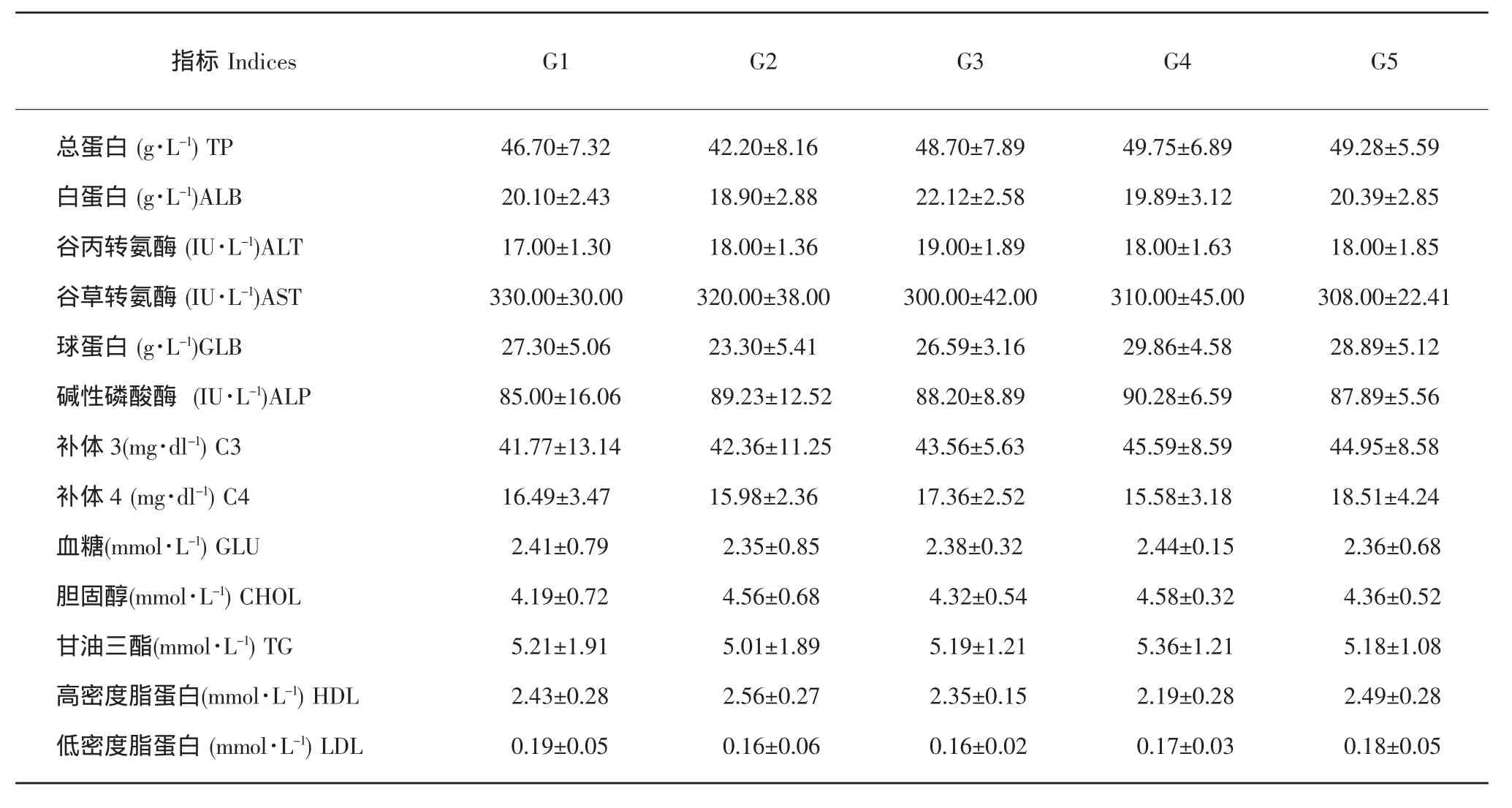
表6 氨基酸对哲罗鱼血液生化指标的影响Table 6 Effects of amino acids on serum indices in taimen Hucho taimen
3 讨论与结论
水产动物促摄食物质种类较多,而氨基酸是鱼类促摄食物质中主要的活性成分[12],其主要包括L-谷氨酸、L-丙氨酸、甘氨酸、L-精氨酸、L-组氨酸、L-脯氨酸、L-亮氨酸、L-酪氨酸、L-蛋氨酸等[13]。如,L-谷氨酸对虹鳟(Oncorhynchus mykiss)具有一定诱食效果[14];0.5 mmol·L-1L-丙氨酸对真鲷(Pagrosomus major)、条纹鲈(Moron saxasilis)和红鳍东方鲀 (Takifugu rubripes)有较强引诱作用;0.5 mmol·L-1甘氨酸对条纹鲈和红鳍东方鲀诱食效果较好[15];L-脯氨酸对大西洋鲑(Salmo salar)和河鳟(Salmo trutta)诱食效果强烈[16]。但是不同种水产动物对不同的氨基酸反应不同[13]。L-丙氨酸+L-精氨酸+甘氨酸在不同程度上抑制鲫的摄食,却可引诱泥鳅积极摄食;L-丙氨酸可明显引诱泥鳅摄食,而甘氨酸却有显著抑制作用[3]。本试验结果表明,饲料中分别添加0.5%L-谷氨酸、0.5%L-丙氨酸、0.5%甘氨酸和0.5%L-脯氨酸后,哲罗鱼的摄食率没有显著提高(P>0.05),可见,本试验条件下,几种晶体氨基酸对哲罗鱼的促摄食效果并不明显。一种原因可能是哲罗鱼对晶体氨基酸的利用效果不明显。徐奇友等研究表明,饲料中添加晶体氨基酸(L-苏氨酸、L-蛋氨酸、L-赖氨酸)无明显的促进生长作用[5]。其次,添加晶体氨基酸的浓度对哲罗鱼并不适宜。对黄鳝进行的诱食试验表明,随着氨基酸浓度从0.5%增加到10.0%,L-精氨酸、L-丙氨酸对黄鳝摄食的影响从微弱抑制转为促摄食作用,且促摄食作用随着浓度的增加而增加[4]。此外,可能氨基酸单独添加对哲罗鱼的促摄食效果不明显,而氨基酸与核苷酸等复合后对哲罗鱼具有促生长效果。这因为在作为促摄食物质——天然饵料提取物中,氨基酸、核苷酸和甜菜碱等共同存在[12]。日本鳗鲡(Anguilla japonicus)饲料中添加甘氨酸、L-脯氨酸、L-组氨酸、L-丙氨酸以及尿苷酸组成的复合诱食剂,可提高胃蛋白消化酶活性2倍,饲料效率2.16倍,蛋白质效率2.15倍,同时降低血液中血糖和游离氨基酸含量[17]。
在畜禽饲料中添加晶体氨基酸可提高机体对蛋白质的利用率和饲料转化效率,从而起到促进畜禽生长效果。然而,水产动物利用晶体氨基酸的能力至今仍无确切结论,可能水产动物肠道能吸收蛋白质分解出的氨基酸而不能直接吸收晶体氨基酸[18]。对虹鳟、鲤(Cyprinus carpio)、罗非鱼(Tilapia mossambica)和凡纳滨对虾(Litopenaeus vannamei)的研究结果表明,其利用晶体氨基酸的效率远低于结合蛋白质[18]。本研究表明,饲料中添加的0.5%L-谷氨酸、0.5%L-丙氨酸、0.5%甘氨酸、0.5%L-脯氨酸未被哲罗鱼很好吸收。哲罗鱼的肝、胃、肠道和幽门盲囊的蛋白酶、脂肪酶和淀粉酶活性无明显变化,说明几种晶体氨基酸的添加并没有明显改善鱼体消化机能。氨基酸如果被吸收后,大部分会用作蛋白质的合成,只有少部分多余的氨基酸会被脱去氨基,或转化成脂质和糖,或进入三羧酸循环被氧化释放出能量[19]。从本试验结果来看,添加几种晶体氨基酸后机体的体成分并没有发生显著变化(P>0.05),血清转氨酶、总蛋白未显著提高(P>0.05),说明几种晶体氨基酸并没有提高机体的蛋白合成能力,同时也证实晶体氨基酸可能并没有被充分吸收。饲料中添加氨基酸还可影响水产动物免疫力。如:谷氨酸盐在参与机体免疫作用中是一种重要的氨基酸,它在斑点叉尾鮰(Ictalurus punctatus)巨噬细胞噬菌及淋巴细胞分解作用所必需,也是免疫作用中重要的能量来源;精氨酸能显著影响斑点叉尾鮰体内和体外一氧化氮的合成,从而调节机体免疫力[20]。本试验饲料中添加0.5%L-谷氨酸、0.5%L-丙氨酸、0.5%甘氨酸和0.5%L-脯氨酸对哲罗鱼血清球蛋白、补体C3、补体C4、碱性磷酸酶等免疫指标未发生改变,一方面可能由于哲罗鱼的促摄食效果不明显,同时,氨基酸未被吸收或吸收率很低,导致添加的氨基酸对机体生理生化指标影响较小。从另一方面来看,这些指标未能完全反映鱼体的免疫力,因此,这几种氨基酸是否已对哲罗鱼鱼体氨基酸免疫力产生影响,需要进一步证实。
此外,关于鱼类促摄食物质作用的研究,人们所采用的方法不同,这在很大程度上造成结果可比性较差[21]。目前,研究的方法主要有摄食行为法、电生理法和生长试验法等,但各种方法各有利弊。薛敏等认为,首先应通过摄食行为装置和电生理方法,筛选出对鱼类具有明显有引诱作用的促摄食物质,然后经过长期生长试验进行精确验证[21]。哲罗鱼于2000年养殖驯化成功,对沉底饲料摄食不积极,而对缓慢沉降的饲料摄食积极,采用迷宫法和触球试验不是理想研究手段;而能引起强烈神经冲动的物质又未必具有促摄食作用,因而,以摄食生长试验研究哲罗鱼促摄食物质不失为一种较为有效的研究方法。
低鱼粉基础饲料中添加0.5%L-谷氨酸、0.5%L-丙氨酸、0.5%甘氨酸和0.5%L-脯氨酸对哲罗鱼:①促摄食效果不明显;②生长性能提高不显著;③全鱼的生化组成影响不明显;④消化道及消化腺的消化酶活性影响不显著;⑤血清生化指标影响不明显。
[1] 李柯懋.水产动物诱食剂的研究进展[J].中国水产,2005(8):57-58.
[2] 尹海富,范兆廷,韩英,等.氨基酸水产饵料诱食剂[J].饲料博览,2003,6:39-41.
[3] 伍一军.氨基酸对鲫鱼、泥鳅的诱食活性[J].水产学报,1993,17(4):337-339.
[4] 杨代勤,严安生,陈芳.几种氨基酸及香味物质对黄鳝诱食活性的初步研究[J].水生生物学报,2002,26(2):205-208.
[5] 徐奇友,王常安,许红,等.大豆分离蛋白替代鱼粉对哲罗鱼稚鱼生长、体成分和血液生化指标的影响[J].水生生物学报,2008,32(6):156-161.
[6] 唐丽花,王广军,余德光,等.几种氨基酸对日本鳗鲡摄食、消化和生长的影响[J].大连水产学院院报,2009,24(6):574-577.
[7] 王常安,徐奇友,畅雅萍,等.几种添加剂对哲罗鲑生长和血液生化指标的影响[J].大连水产学院院报,2009,24(6):1-5.
[8] 北京大学生物系生物化学教研室.生物化学试验指导[M].北京:高等教育出版社,1979:73-74.
[9] 朱俭,曹凯鸣,周润琦,等.生物化学试验[M].上海:上海科学技术出版社,1981:190-193.
[10] 桂远明.水产动物机能学试验[M].北京:中国农业出版社,2004:92-93.
[11] 杨兴棋.11鱼类的采血技术[J].淡水渔业,1979(增1):43-45.
[12] 荻野珍吉.鱼类的营养与饲料[M].北京:海洋出版社,1987:17-22.
[13] 王安利,苗玉涛,王维娜,等.水产动物诱食剂的研究进展[J].中国水产科学,2002,9(3):265-268.
[14] Yamashita S,Yamada T,Hara T J.Gustatory responses to feeding and non feeding stimulant chemicals,with an emphasis on amino acids,in rainbow trout[J].Journal of Fish Biology,2006(68):783-800.
[15] 梁萌青.不同诱食剂对3种鱼类诱食活性的研究[J].中国水产科学,2000,7(1):60-63.
[16] Hara T J,Kitada Y,Evans R E.Distribution patterns of palataltaste buds and their responses to amino acids in salmonids[J].Journal of Fish Biology,1994,45:453-465.
[17] 竹田正彦,陈维国.向鳗鱼饵料中添加摄饵促进物质的效果[J].国外水产,1989(2):20-24.
[18] 迟淑艳,谭北平.水生动物复基酸营养研究进展[J].饲料工业,2008,29(10):47-50.
[19] 霍湘,王安利,杨建梅.鱼类对氨基酸的吸收代谢与需求[J].水利渔业,2005,25(3):1-4.
[20] Buentello J A,Gatlin D M.Nitric oxide production in activated macrophages from channel catfish(Ictalurus punctatus):Influence of dietary arginine and culture media[J].Aquaculture,1999,179:513-521.
[21] 薛敏,解绶启,崔奕波,等.鱼类促摄食物质研究进展[J].水生生物学报,2003,27(6):639-643.

