阴外动脉灌注脂多糖对泌乳奶牛动脉血液中脂肪酸组成、摄取及血液脂质指标的影响
张养东,王加启,胡 涛,徐 俊,李珊珊,卜登攀,孙 鹏,周凌云
(1.东北农业大学动物营养研究所,哈尔滨 150030;2.中国农业科学院北京畜牧兽医研究所,北京 100193)
脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性细菌崩解时释放的一种主要成分,是诱发动物机体产生炎症反应的主要诱因之一[1-3],在机体发生炎症反应的同时,机体脂类代谢也受相应的调控[4-5]。研究表明,LPS能下调锯齿类动物的脂蛋白酯酶活性[6];脂蛋白酯酶不仅影响脂肪酸的吸收而且在清除循环血液中甘油三酯乳糜微粒和极低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDLD)上起着重要作用,甘油三酯乳糜微粒和极低密度脂蛋白又是机体抵御LPS毒性的一种重要的宿主防御机制[7]。在反刍动物上,瘤胃异常发酵产生的LPS可能迁移入血,影响血液中脂类代谢[3,8]。但LPS是否是诱发脂类代谢发生变化的主要因子还未获得充分证实。因此,本试验在避开反刍动物特有的瘤胃反应器的基础上,通过阴外动脉灌注LPS直观的研究LPS对泌乳奶牛脂类代谢的影响,以期为今后的试验提供了一定的理论依据。
1 材料与方法
1.1 试验动物与试验日粮
选用6头经产的荷斯坦奶牛(BW=(576.33±36.67)kg,DIM=(185.67±30.11)d),随机分成2组。以玉米、豆粕、麦麸、青贮、苜蓿干草及羊草为主要原料配制基础日粮,日粮养分组成满足中国农业行业标准推荐(NY/t 34,2004)的营养需求。试验日粮的组成及营养成分如表1所示。

注:1.含有 (干物质基础) Contains(DM),Fe 5 500 mg·kg-1,Cu 4 080 mg·kg-1,Zn 17 500 mg·kg-1,Mn 4 980 mg·kg-1,Se 110 mg·kg-1,I 180 mg·kg-1,Co 88.5 mg·kg-1,VA>2 000 IU·g-1of vitamin A,600 IU·g-1of vitamin D3,10.8 mg·g-1of vitamin E.2.净能值 (Mcal·kg-1)参照农业行业标准(China NY/t 34,2004)计算。Calculated net energy value according to the feeding standard of dairy cattle(China NY/t 34,2004).
1.2 试验设计与饲养管理
试验采用交叉试验设计,分两期进行,每期试验7 d,间隔期14 d。第一期试验前7 d(-7 d)为预饲期,奶牛接受一次阴外动脉生理盐水(Saline)灌注,使动物机体适应灌注条件,减轻灌注对动物机体的应激。正式期3头奶牛灌注LPS(Escherichia coli O111:B4,0.01μg·kg-1体重),另外3头奶牛灌注Saline。在第二期试验时,2组奶牛进行交叉。每期试验都于试验日7:00正式开始。
LPS用无致热源的灭菌生理盐水配制成0.5 mg·mL-1储备溶液,然后用无致热源的灭菌生理盐水按照每kg牛体重0.01 μg LPS配制终体积10 mL溶液,对照组为10 mL无致热源的灭菌生理盐水。配制好的溶液经预热达到37℃时,经右侧阴外动脉一次性灌注,灌注时要尽量保持试验动物安静,必要时给实验动物套上“防踢棒”,灌注缓慢而均匀进行,在5 min内灌注完毕,随后再用10 mL无致热源的灭菌生理盐水冲洗灌注管道,以保证灌注液全部进入试验动物动脉血管中。
试验动物采用栓系式饲养,日饲喂2次(7:00和19:00),自由饮水,挤奶采用利拉伐手推式挤奶机进行。试验期间,每天记录采食量和产奶量,并观测试验动物的精神状态。
1.3 样品的采集与测定方法
血浆样品的采集:于试验正式开始时(0 h)、灌注后6、12、24 h分别利用真空采血管(血浆管)采集尾动脉和腹部静脉血样,血浆管4℃静置过夜后,3 000 g、4℃离心15 min分离血浆。分离后的血浆于-20℃保存。
血浆中脂肪酸组成测定方法如下:利用正己烷与异丙醇的混合液提取牛奶上清液中的脂肪,然后对溶有脂肪的正己烷液体进行酸碱甲酯化,其具体分析方法参见文献[9]。乳腺对动脉血浆中碳链长度大于16的脂肪酸摄取率计算方法参见文献[10]。
血浆中总胆固醇(Cholesterol total,CHOL)、极低密度脂蛋白胆固醇(LDLD)和极高密度脂蛋白胆固醇(High-density lipoprotein cholesterol,HDLD)的测定采用Beckman Synchron CX5PRO分析系统,试剂盒购自英国RANDOX公司。
1.4 数据处理
所有数据以SAS(8.2)软件MIXED模块进行统计学检验。统计模型中包含试验牛的随机因素和试验期、试验处理、试验时间以及试验处理与试验时间的交互效应等的固定因素。变量的统计结果均以最小二乘均数形式列表,显著水平为P<0.05,极显著水平为P<0.01。
2 结果与分析
2.1 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中脂肪酸组成的影响
由表2、图1、图2和图3结果可知,阴外动脉灌注LPS未显著影响动脉血浆中脂肪酸组成(P>0.05),但有增加动脉血浆中TFA量和SFA含量,降低血浆中MUFA、PUFA、TUFA含量的趋势。与对照组相比,动脉血浆中SLFA含量(P>0.05)和CLFA含量(P>0.05)有不同程度的提高,随着灌注后时间的持续呈先升高后降低的趋势;MLFA含量(P>0.05)呈先降低后升高趋势。
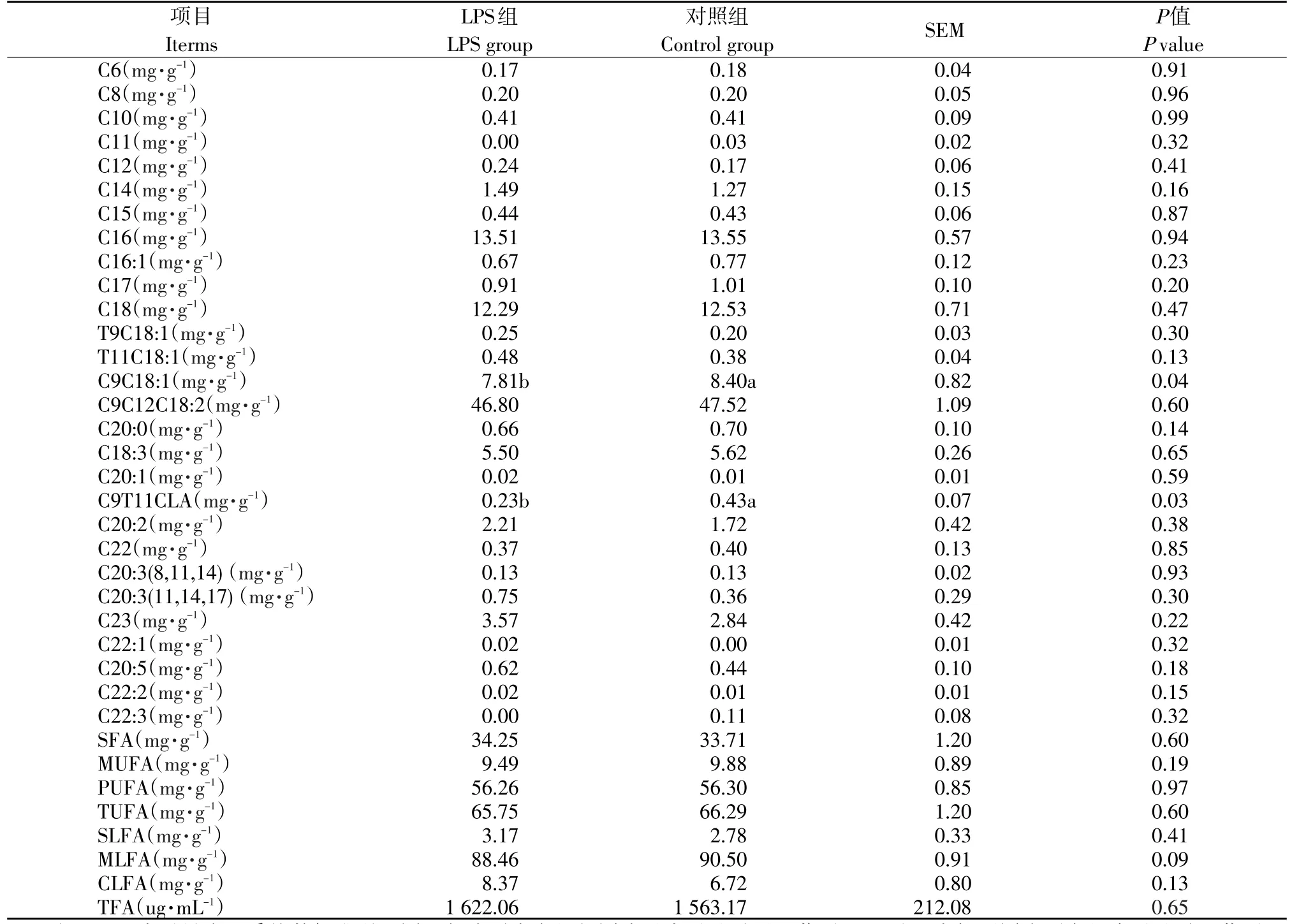
表2 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中脂肪酸组成和脂肪酸含量的影响Table 2 Effect of intra-external pudic arterial administrated LPS on the milk fatty acids profile of artery plasma in dairy cows

图1 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中SLFA的影响Fig.1 Effect of intra-external pudic arterial administrated LPS on the content of SLFA of artery plasma on dairy cows
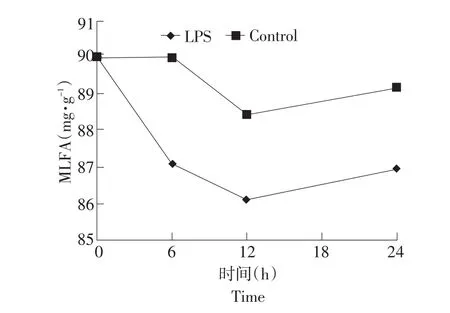
图2 阴外动脉灌注脂多糖对动脉血浆中MLFA的影响Fig.2 Effect of intra-external pudic arterial administrated LPS on the content of MLFA of artery plasma on dairy cows
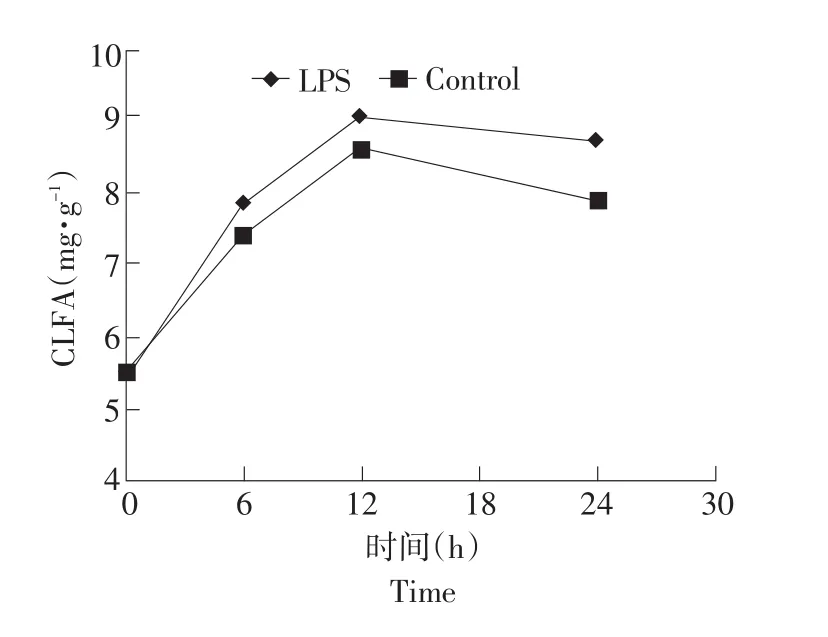
图3 阴外动脉灌注脂多糖对动脉血浆中CLFA的影响Fig.3 Effect of intra-external pudic arterial administrated LPS on the content of CLFA of artery plasma on dairy cows
2.2 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中碳链长度大于16的脂肪酸摄取率的影响
由表3结果表明,与对照组相比,阴外动脉灌注LPS提高了乳腺对动脉血液中碳链长度大于16的脂肪酸摄取率(P>0.05),除C20的摄取率达到极显著差异水平(P<0.01)外,其他组间差异不显著(P>0.05)。
2.3 阴外动脉灌注脂多糖对泌乳奶牛血液中脂质指标的影响
由表4结果可知,与对照组相比,阴外动脉灌注LPS显著提高了血浆中CHOL含量(P<0.05),有提高血浆中HDLD含量和LDLD含量的趋势,但影响差异不显著(P>0.05)。
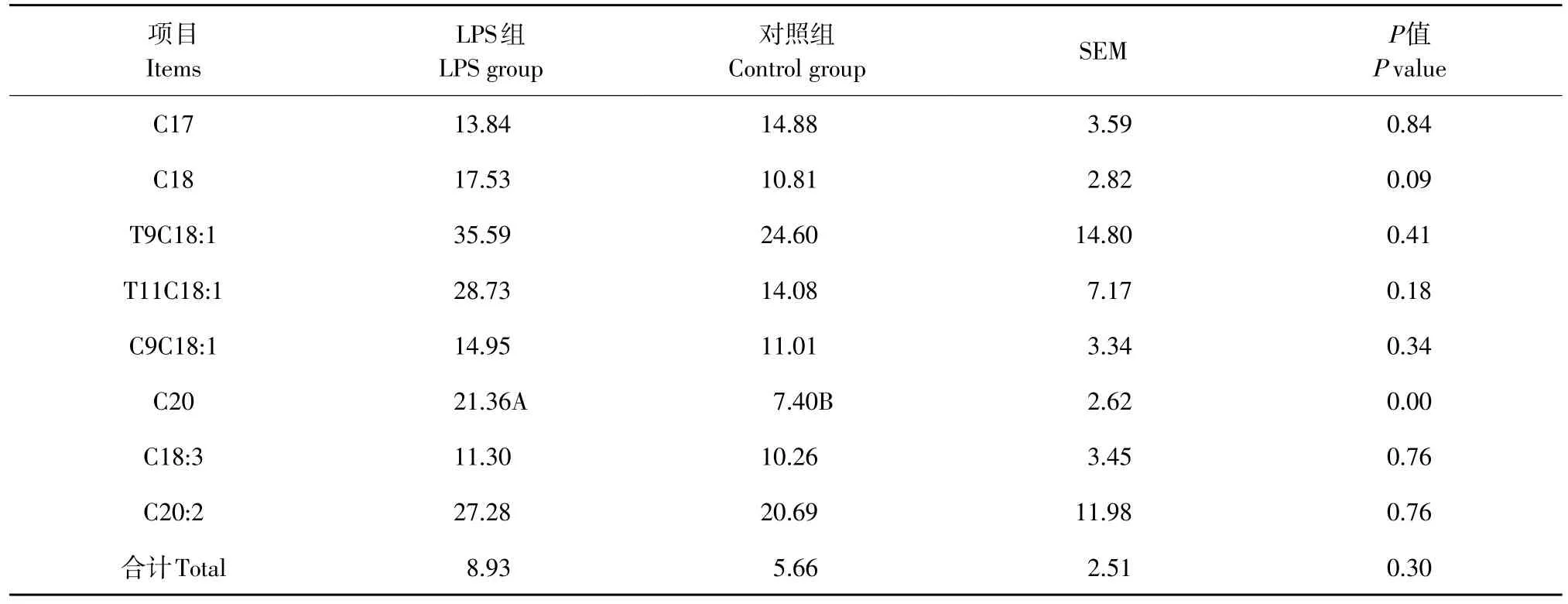
表3 阴外动脉灌注脂多糖对泌乳奶牛乳腺摄取脂肪酸的影响Table 3 Effect of intra-external pudic arterial administrated LPS on the milk fatty acids profile of artery plasma in dairy cows(%)

表4 阴外动脉灌注LPS对泌乳奶牛血液中脂质指标的影响Table 4 Effect of intra-external pudic arterial administrated LPS on the lipid indexes of artery plasma in dairy cows
3 讨论与结论
3.1 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中脂肪酸组成的影响
Feingold等在鼠上研究表明,尾静脉注射LPS提高了血液中总脂肪酸的含量(P>0.05)[11]。本试验结果与之相似,本试验结果表明,与对照组相比,LPS组提高了血液中TFA量(P>0.05)、SLFA含量(P>0.05)和CLFA含量(P>0.05),这可能是由于LPS降低了机体组织的脂蛋白酯酶的活力,降低了清除循环血液中甘油三酯乳糜微粒和极低密度脂蛋白(LDLD)效率[11-12],同时提高了脂解作用所致[13-15]。
LPS在引起机体炎症反应的同时,还导致机体产生氧化损伤[16-17]。不饱和脂肪酸由于含有烯烃键,具有抗氧化的机能,因此,可能是导致本试验血液中MUFA含量(P>0.05)、PUFA含量(P>0.05)和TUFA含量(P>0.05)等不饱和脂肪酸含量降低的原因,但具体机制待进一步研究。
3.2 阴外动脉灌注脂多糖对泌乳奶牛动脉血浆中碳链长度大于16的脂肪酸摄取率的影响
乳汁中C4至C15以及50%的C16是乳腺内源合成的脂肪酸,乳汁中50%的C16以及C16以上的脂肪酸是乳腺直接从血浆中摄取转运[18]。因此,本试验计算的乳腺对脂肪酸的摄取率主要针对碳链长度大于16的脂肪酸。Ling和Alcorn研究结果表明,LPS影响脂肪酸结合蛋白和脂肪酸转运蛋白mRNA的表达,泌乳鼠注射LPS下调脂肪酸结合蛋白(Fabp3)和脂肪酸转运蛋白(Fatp4)mRNA的表达水平,但上调脂肪酸转运蛋白(Fatp1)mRNA的表达水平[19]。本试验结果表明,LPS不同程度的提高了乳腺中碳链长度大于16的脂肪酸的吸收,对碳链长度大于16的总脂肪酸摄取率提高了57.77%。
3.3 阴外动脉灌注脂多糖对泌乳奶牛血液中脂质指标的影响
研究表明,内毒素应激诱导机体高脂血症[11],产生非特异性免疫反应,引发机体重新分配营养素抵抗内毒素的毒性[20]。但在不同动物上,LPS对动物机体的脂类代谢影响不尽相同。在锯齿类动物上,LPS提高血液中总胆固醇水平[20]和LDHD水平[11];在灵长类动物上,LPS降低或未影响血液中总胆固醇水平和LDHD水平[20]。本试验结果表明,阴外动脉灌注LPS提高了血液中总胆固醇、LDHD和HDHD水平,动员了机体的脂类代谢,这与血液中脂肪酸含量的提高相一致;同时,在我们的前期试验中,LPS诱导机体发生炎症反应(未发表),而机体脂类代谢的动员,正是机体产生非特异性免疫抵抗炎症反应的一种机制[4,6]。
因此,当动物机体遭受LPS应激时,机体动员脂类代谢,以抵抗LPS对动物机体诱发的炎症反应。
[1] Guidry A J,Ost M,Mather I H,et al.Sequential response of milk leukocytes,albumin,immunoglobulins,monovalent ions,citrate,and lactose in cows given infusions of Escherichia coli endotoxin into the mammary gland[J].Am J Vet Res,1983,44(12):2262-2267.
[2] Carroll J A,Arthington J D,Chase C C,Jr.Early weaning alters the acute-phase reaction to an endotoxin challenge in beef calves[J].J Anim Sci,2009,87(12):4167-4172.
[3] Zebeli Q,Ametaj B N.Relationships between rumen lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J].J Dairy Sci,2009,92(8):3800-3809.
[4] Grunfeld C,Feingold K R.Regulation of lipid metabolism bycytokines during host defense[J].Nutrition,1996,12(1,Supplement 1):24-26.
[5] Grunfeld C,Marshall M,Shigenaga J K,et al.Tobias P,Feingold KR:Lipoproteins inhibit macrophage activation by lipoteichoicacid[J].Journal of Lipid Research,1999,40(2):245-252.
[6] Khovidhunkit W,Kim M S,Memon R A,et al.Thematic review series:the pathogenesis of atherosclerosis.Effects of infection and inflammation on lipid and lipoprotein metabolism mechanisms and consequences to the host[J].Journal of Lipid Research,2004,45(7):1169-1196.
[7] Feingold K,Staprans I,Memon R,et al.Endotoxin rapidly induces changes in lipid metabolism that produce hypertriglyceridemia:low doses stimulate hepatic triglyceride production while high doses inhibit clearance[J].J Lipid Res,1992,33(12):1765-1776.
[8] Khafipour E,Krause D O,Plaizier J C.A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].J Dairy Sci,2009,92(3):1060-1070.
[9] 卜登攀,王加启,Dhiman T,等.植物油来源亚油酸和亚麻酸对乳脂CLA合成的影响[J].畜牧兽医学报,2007(7):663-671.
[10] Yang G,Wang J Q,Bu D P,et al.Duodenal infusion of α-linolenic acid affect fatty acids metabolism in mammary gland of lactating dairy cows[J].J Anim Sci,2010,93:777.
[11] Feingold K R,Staprans I,Memon R A,et al.Endotoxin rapidly induces changes in lipid metabolism that produce hypertriglyceridemia:low doses stimulate hepatic triglyceride production while high doses inhibit clearance[J].J Lipid Res,1992,33(12):1765-1776.
[12] Bagby G J,Spitzer J A.Lipoprotein lipase activity in rat heart and adipose tissue during endotoxic shock[J].American Journal of Physiology-Heartand CirculatoryPhysiology,1980,238(3):H325-H330.
[13] Kaufmann R L,Matson C F,Beisel W R.Hypertriglyceridemia produced by endotoxin:role of impaired triglyceride disposal mechanisms[J].Journal of Infectious Diseases,1976,133(5):548-555.
[14] Hikawyj-Yevich I,Spitzer J A.Endotoxin influence on lipolysis in isolated human and primate adipocytes[J].Journal of Surgical Research,1977,23(2):106-113.
[15] Zu L,He J,Jiang H,et al.Bacterial endotoxin stimulates adipose lipolysis via toll-like receptor 4 and extracellular signalregulated kinase pathway[J].Journal of Biological Chemistry,2009,284(9):5915-5926.
[16] Memon R A,Staprans I,Noor M,et al.Infection and inflammation induce LDL oxidation in vivo[J].Arterioscler Thromb Vasc Biol,2000,20(6):1536-1542.
[17] Zhang C,Walker L M,Mayeux P R.Role of nitric oxide in lipopolysaccharide-induced oxidant stress in the rat kidney[J].Biochemical Pharmacology,2000,59(2):203-209.
[18] 哈斯额尔敦.十二指肠灌注游离十八碳脂肪酸对泌乳奶牛生产性能和乳脂肪酸组成的影响[D].北京:中国农业科学院,2010.
[19] Ling B,Alcorn J.LPS-induced inflammation downregulates mammary gland glucose,fatty acid,and l-carnitine transporter expression at different lactation stages[J].Research in Veterinary Science,2010,89(2):200-202.
[20] Hardardóttir I,Grunfeld C,Feingold K.Effects of endotoxin on lipid metabolism[J].Biochem Soc Trans,1995,23(4):1013-1018.

