低黏度包埋剂在肾活检电镜标本制备中的应用
朱小东 曾彩虹 陈惠萍
肾活检病理诊断由光镜、免疫荧光、电镜三部分组成,电镜技术对肾脏病的诊断及分类具有极其重要的作用。环氧树脂Epon 812是目前肾活检常规电镜检查中应用最广泛的包埋树脂,但聚合硬化时间长以致电镜标本制作周期较长,影响临床及时获取电镜观察结果。有报道Eponate 12作为一种黏度低、渗透作用快、聚合时间短的电镜包埋剂已应用于快速电镜技术,本文拟探讨低黏度包埋剂Eponate 12在肾活检电镜中的应用,旨在更好地提供肾活检患者超微结构改变特点以满足临床诊断的需要。
材料与方法
标本来源 选取40例南京军区南京总医院全军肾脏病研究所常规肾活检电镜标本,分为实验组和对照组各20例,每组包括IgA肾病(IgAN)5例、膜性肾病(MN)5例、狼疮性肾炎(LN)5例、局灶节段性肾小球硬化(FSGS)5例。
试剂及配制 Eponate 12 Resin Kit With DMP-30(Product No.18010 TED PELLA.ICN,USA),Epon 812、甲基内次甲基二甲酸酐(NMA)、十二烷基琥珀酸酐(DDSA)、25%戊二醛、2%四氧化锇、醋酸铀及柠檬酸铅(均购置SPI.USA)。混合包埋剂配制方法(以配制50 ml左右为例,单位ml),Eponate 12包埋剂采用“HARD”配方,即 Eponate 12∶DDSA∶NMA∶DMP-30比例为 25.7∶9.3∶16.5∶0.8;Epon 812 包埋剂采用夏季配方,即Epon 812∶DDSA∶NMA∶DMP-30 比例为 25∶6.2∶18.9∶0.8。
实验方法
取材与固定 两组标本取材与固定处理程序相同。具体步骤:(1)取材、前固定,锋利刀片切取1 mm3的组织块,用专用镊子轻夹放入4℃预冷的3.75%戊二醛电镜固定液中,放置4℃冰箱固定4h;(2)漂洗,0.1M PBS缓冲液漂洗15 min×3次;(3)后固定、漂洗,1%锇酸4℃固定1h;双蒸水漂洗5 min×3次。
脱水、浸透与包埋、聚合
实验组 梯度乙醇脱水:50%乙醇10 min×1次,70%乙醇10 min×1次,90%乙醇10 min×1次,100%乙醇10 min×3次;浸透、包埋:环氧丙烷10 min×3次;Eponate 12混合包埋剂∶环氧丙烷比例为1∶1浸透1h,Eponate 12混合包埋剂浸透3h。
对照组 梯度丙酮脱水:30%丙酮15 min×1次,50%丙酮15 min×1次,70%丙酮15 min×1次,90%丙酮15 min×1次,100%丙酮10 min×3次;浸透、包埋:丙酮:Epon 812混合包埋剂比例为1∶1浸透1h,Epon 812混合包埋剂浸透3h。
聚合 肾组织标本转移至胶囊后放置烤箱内,两种处理方法见表1。
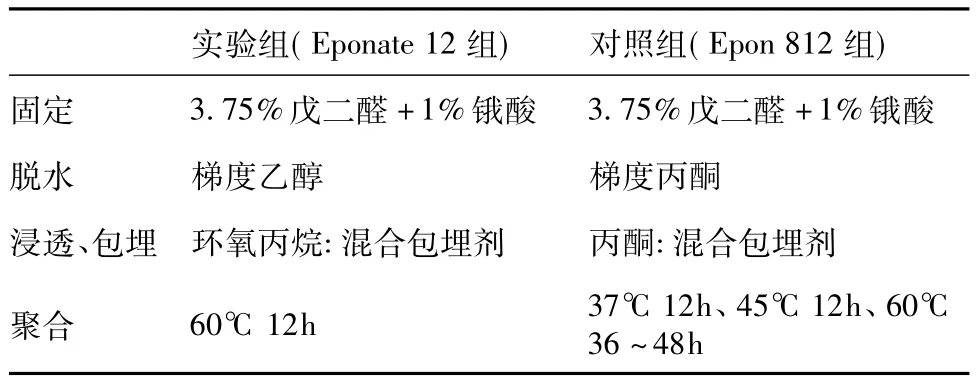
表1 采用不同包埋剂处理肾活检电镜组织的比较
切片及染色 Leica EM超薄切片机1 μm半薄切片,1%甲苯胺蓝染色1 min,光镜定位肾小球及肾小管。超薄切片银白色厚约60~70 nm,选择干净且覆膜完好的铜网捞片,观察捞片有无褶皱、裂痕,待切片干燥后进行醋酸铀、柠檬酸铅常规双染色,分别为20 mim和15 min,切片完全干燥后日立H7500型透射电子显微镜下观察。
电镜下观察 电镜观察的内容包括切片是否均匀完整,有无皱褶、震颤、变形;超薄切片的染色性能和图像反差是否良好;组织、细胞超微结构是否保存良好,超微结构的完整性和清晰度,有无物质抽提和聚集。
结 果
肾活检电镜标本处理时间 实验组肾活检电镜标本从脱水到完全聚合耗时约17.5h,与对照组Epon 812包埋方法相比时间缩短约48~60h,从而缩短整个肾活检标本制样周期(表2)。
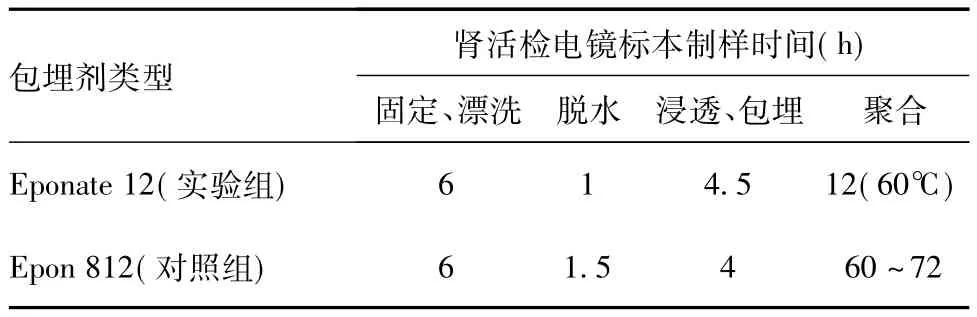
表2 Eponate 12与Epon 812标本制样耗时比较
超薄切片质量 实验组Eponate 12包埋剂在60℃温箱中12h达到完全聚合,对照组约60h完全聚合,实验组包埋块手工修块时硬度和韧性较强,半薄切片平整、无挤压,容易切出大面积半薄切片;超薄连续切片厚度均匀,切片完整,无空洞、无震颤;切片能经受较长时间的电子束照射,不易被电子束轰击损坏。
超微结构 实验组和对照组肾组织超薄切片经醋酸铀、柠檬酸铅常规双染色后图像反差良好,实验组肾组织、细胞微细结构显示清晰,亚细胞结构保存良好,肾小管微绒毛结构清晰。与对照组相比,实验组超微结构图像对比清晰,染色效果良好,细胞内精细结构保存良好,膜性细胞器如线粒体、内质网、高尔基体质膜保持完整,细胞核膜、线粒体双层膜及嵴结构显示清晰(图1)。
电子致密物反差 我们观察了LN、MN、IgAN患者的电子致密物沉积情况,实验组LN-IV型肾小球内皮下大量高密度的电子致密物显示高反差,对照组电子致密物反差低于实验组;实验组MN肾小球基膜上皮侧内的电子致密物沉积部位以及与周边的界限显示清楚,密度不均一的电子透亮区较好地显示电子致密物的吸收程度(图2A、B),IgAN系膜区密度增高的电子致密物沉积显示清晰(图2C、D)。实验组电子致密物对比反差较强,显示效果优于对照组,较好地反映出LN、MN、IgAN电镜下组织学特点。

图1 Eponate 12包埋的肾组织超微结构(EM)
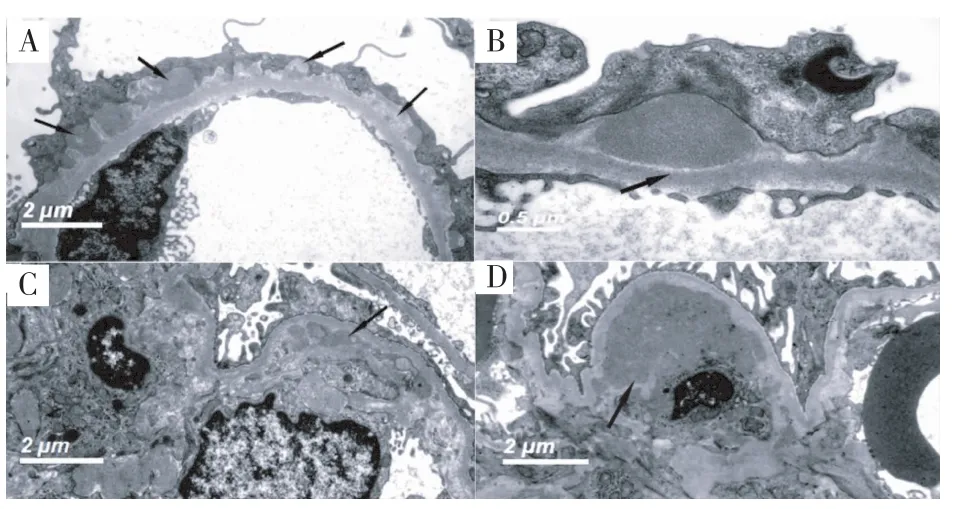
图2 Eponate 12包埋的肾小球电子致密物(EM)
讨 论
完整的肾活检病理诊断包括光镜、免疫荧光及电镜诊断,然而,由于肾活检组织电镜需经过固定、漂洗、脱水、浸透、包埋、切片、染色,整个标本处理过程细致、复杂,耗时冗长往往不能满足临床需要。
目前国内较常使用的Epon 812包埋剂聚合时间长,组织从处理到染色整个过程大约需要5~7d,整个制片周期耗时较长,造成电镜报告远滞后于光镜及免疫荧光,一些肾脏疾病诊断必须依赖电镜如薄基膜肾病、Alport综合征、Fabry病、致密物沉积病等,因此电镜观察滞后往往影响肾脏疾病的诊断和治疗。
Eponate 12作为一种黏度低、渗透快、聚合时间短的电镜包埋剂,在肾活检电镜样品制备应用中,标本上午取材固定,下午完成脱水浸透,利用晚上12~16h的时间完成聚合,最快次日即可切片染色至镜下观察,制片过程缩短至2~3d内完成,电镜报告甚至可以和光镜、免疫荧光报告同步发出,临床医师在患者出院前即可获得电镜病理诊断报告,这对肾脏疾病的诊断和治疗具有重大意义。
Epon 812是电镜技术上使用最广泛的环氧树脂类包埋剂,25℃时其黏度150~200 cPa,完全聚合时间需要 60h[2-6],Eponate 12 作为 Epon 812 的替代包埋剂,其黏度为15~21 cPa[7],我们的研究也发现其黏度低,配成混合包埋剂后,渗透组织中速度更快,包埋剂聚合时间短,包埋块的切割性能、切片的染色反差及超微结构的保存与Epon 812几乎相同,在电子致密物显示方面更清晰,图像反差更好,在膜性结构、电子致密物的观察方面更具优势。
随着电镜技术的不断发展,低黏度包埋剂在快速电镜制样技术中应用越来越广,Em Bed 812、Polar Bed 812、Polv Bed 812、spurr、ponate 12 等都属于低黏度包埋剂,其浸透好,经得住电子束照射,整个包埋过程可在一天内完成[8],在其他种类众多的环氧树脂类包埋剂中,spurr树脂(ERL 4206)黏度最低,仅为7.18cPa,混合后的包埋剂黏度也只有60cPa,聚合时间更短,70℃烤箱中8h完全聚合,因而在快速电镜制样技术应用较广,但缺点是毒性大并具有致癌性[9],限制了其在临床上广泛应用。Eponate 12的黏度介于Epon 812和spurr之间,在组织各成分中的浸透速度适中,较少出现因包埋块聚合不均而造成染色不佳的问题,使其成为低黏度包埋剂中一种较好的选择。同其他包埋剂一样,Eponate 12配方有多种,固化剂NMA与DDSA的比例决定聚合块的硬度,其比例可参照经典的Luft公式计算[10]。聚合块太硬或太软均不利于修块和切片,如配方不适合应及时调整,在实际工作时 Luft配方中“HARD”配制的包埋块硬度和韧性适中,容易获得银白色的超薄切片,切片染色效果满意,加速剂DMP-30的浓度应控制在1.5% ~2%之间,其用量会直接影响聚合时间,浓度增加虽然可以加快单体间的聚合反应,但混合后的包埋剂黏度增加不利于充分浸透,包埋块在切片时表面容易出现空洞和颤痕,严重影响制片质量。在实际工作中肾组织包埋块在纯包埋剂浸透3h后直接放置60℃烤箱聚合过夜(12~16h),硬度完全达到半薄和超薄切片的要求。此外商品化的Eponate 12试剂与Epon 812价格相差不大,并不增加标本前期处理成本,具有很好的经济性。
Eponate 12包埋剂在肾活检电镜样品制备过程中取得较满意的效果,特别是显著缩短肾活检病理电镜标本制作时间,切片超微结构好和电子致密物反差明显在电镜的快速诊断方面,具有很大的实用价值。在肾活检电镜技术中,Eponate 12不失为Epon 812的理想替代包埋剂,能够更好适应临床诊断对电镜技术的要求。
1 黎磊石,曾彩虹,刘志红.肾活检组织标本的制作.黎磊石,刘志红.中国肾脏病学.北京:人民军医出版社,2008,P157-169.
2 宋田斌,汤 莹,陆月良,等.电子显微镜生物样品制备技术.杨勇骥.实用生物医学电子显微镜技术.上海:第二军医大学出版社,2003,P85-86.
3 Finck H.Epoxy resins in electron microscopy.J Biophys Biochem Cytol,1960,7:27-30.
4 刘旭明,王 萍,唐新萍,等.快速电镜制样技术在诊断电镜中的应用.临床与实验病理学杂志,1999,15(1):89.
5 Wyffels JT.Principles and Techniques of Electron Microscopy:Biological Applications,Fourth Edition,by M.A.Hayat.Microsc microanal,2001,7(1):66.
6 彭 玲,郑 容,郑妹颖,等.一种临床实用的快速电镜标本制备方法.电子显微学报,2006,25(增刊):277-278.
7 Mascorro JA,Kirby GS.Designing multi-viscosity embedding media utilizing novel resin/anhydride/catalyst combinations.Microsc Res Tech,1992,20(1):105-106.
8 Dykstra MJ.Classes and characteristics of reigns.//Dykstra MJ,Reuss LE,eds.Biological electron microscopy:theory,techniques,and troubleshooting.2nd edition.Unite states of America,2003:P31-105.
9 Spehner D,Drillien R,Proamer F,et al.Embedding in Spurr's resin is a good choice for immunolabelling after freeze drying as shown with chemically unfixed dendritic cells.J Microsc,2002,207(Pt 1):1-4.
10 Luft JH.Improvements in epoxy resin embedding methods.J Biophys Biochem Cytol,1961,9:409-414.

