小鼠IL-1β、TNF-αTaqMan荧光定量RT-PCR检测方法的建立及脑心肌炎病毒感染小鼠的检测
陈宏备,施开创,李向涛,郑 敏,郑喜邦*,李 军
(1.广西大学动物科学技术学院,广西南宁530005;2.广西动物疫病预防控制中心,广西南宁530001)
脑心肌炎病毒(Encephalomyocarditis virus,EMCV)能够引起人畜共患疾病,EMCV感染主要引起仔猪的脑炎、心肌炎以及母猪的繁殖障碍。我国于2005年首次从病死仔猪和流产胎儿分离到EMCV[1],血清学调查表明我国规模化猪场感染EMCV现象普遍存在[2]。小鼠对EMCV极为易感,主要表现为急性脑炎、心肌炎、糖尿病、睾丸炎、眼结膜炎等[3],因此一般利用小鼠作为动物模型研究EMCV的致病机理。已有研究报道EMCV感染小鼠后心肌中IL-1β、TNF-α的上调水平与心肌炎的严重程度呈正相关[4],感染致心肌炎型EMCV或致糖尿病型EMCV的小鼠经用抗IL-1β或TNF-α的单克隆抗体(MAb)处理后心肌炎或糖尿病的发病率显著下降[5-7],表明促炎细胞因子IL-1β、TNF-α在EMCV的致病机制中发挥重要作用。本研究建立了小鼠IL-1β、TNF-α的TaqMan real-time PCR检测方法,为定量检测促炎细胞因子mRNA转录水平、探讨EMCV的致病机制提供有效的技术平台。
1 材料和方法
1.1 病毒及实验动物 EMCV GXLC株(FJ897755)由广西动物疫病预防控制中心分离鉴定和保存[8],在BHK-21细胞系中传至第3代,病毒效价为108.2TCID50/mL。4周龄SPF级BALB/c雄性小鼠购自广西医科大学实验动物中心,经RT-PCR及中和抗体试验检测EMCV均为阴性。
1.2 主要试剂及仪器TaqDNA聚合酶、M-MLV反转录酶、HindⅢ和EcoRⅠ限制酶、pMD18-T载体和胶回收试剂盒均购自宝生物工程(大连)有限公司;质粒DNA小量提取试剂盒购自杭州博日科技有限公司;E.coliDH5α株感受态细胞、2×TaqPCR MasterMix试剂和总RNA提取试剂盒均购自天根生化科技(北京)有限公司;ROX参比染料购自天津天浩源科技有限公司。ABI Stepone plus型实时定量PCR仪为Applied Biosystems公司产品。
1.3 引物及探针的设计与合成 根据GenBank中登录的小鼠IL-1β、TNF-α基因及管家基因β-actin的序列,利用Primer Express 3.0软件包设计特异性扩增引物和TaqMan探针(表1),由宝生物工程(大连)有限公司合成。
1.4 重组质粒标准品的制备 采取健康小鼠脾脏,应用总RNA提取试剂盒抽提总RNA,反转录获得cDNA,以此为模板,应用特异性引物进行PCR,扩增β-actin、IL-1β及TNF-α基因片段。用胶回收试剂盒回收PCR产物后,连入pMD18-T载体中,转化到DH5α感受态细胞。挑取阳性菌落进行增菌培养,用质粒抽提试剂盒提取质粒,进行PCR、酶切及测序鉴定。经鉴定正确的阳性质粒作为标准品,分别命名为 p-β-actin、p-IL-1β 和 p-TNF-α,放置-80℃备用。
1.5 Real-time PCR标准曲线的制作 测定质粒的OD值,OD260nm/OD280nm比值在1.8~2.0的质粒方可用于制作标准曲线。根据OD260nm值计算质粒浓度,并换算成拷贝数[9],以双蒸水10倍系列稀释成7个梯度(p-β-actin 为 3.46×109~3.46×103copies/μL,p-IL-1β 为 1.94×109~1.94×103copies/μL,p-TNF-α为 2.50×109~2.50×103copies/μL)。以此为模板,根据优化的反应条件扩增,得到标准曲线。
1.6 敏感性试验 将p-β-actin、p-IL-1β及p-TNF-α质粒标准品10倍系列稀释成为含有1×100~1×106copies/μL的7个梯度,以此作为模板进行real-time PCR,确定检出下限。
1.7 特异性试验 应用设计的特异性引物,分别以健康小鼠的脑、心、脾等组织抽提总RNA反转录所获得的cDNA为模板,进行real-time PCR以分析其特异性。设立的对照包括质粒标准品为模板、总RNA为模板、cDNA为模板但不加引物、cDNA为模板但不加探针、双蒸水为模板等5种对照。
1.8 重复性试验 将每种质粒标准品稀释成3个浓度梯度(p-β-actin 为 3.46×109、3.46×107、3.46×105copies/μL, p-IL-1β 为 1.94 ×109、 1.94 ×107、1.94 ×105copies/μL,p-TNF-α 为 2.50×109、 2.50×107、2.50×105copies/μL),进行组内及组间重复性试验。
1.9 Real-time PCR的应用 将28只4周龄BALB/c雄性小鼠随机分为2组,试验组18只、对照组10只。试验组经腹腔接种0.2 mL 100 LD50EMCV细胞毒,对照组经腹腔接种0.2 mL DMEM营养液。每日观察临床症状;对死亡或濒死小鼠及时迫杀,观察组织病变,并采集脑、心、脾等组织,用于检测病毒含量及IL-1β、TNF-α的mRNA转录水平。
分别称取脑、心、脾等组织,应用总RNA提取试剂盒抽提总RNA,采用M-MLV反转录酶和Oligo(dT)18反转录获得cDNA。取总cDNA作为模板,分别采用特异性引物,根据优化的反应条件进行realtime PCR,检测样本中 β-actin、IL-1β 及 TNF-α的拷贝数。

表1 扩增β-actin、IL-1β及TNF-α部分基因片段的引物、探针和PCR条件Table 1 Conditions of PCR,primers and probes to amplify partial gene of β-actin,IL-1β and TNF-α
应用广西动物疫病预防控制中心建立的EMCVTaqMan荧光定量RT-PCR检测方法(待发表),以上述获得的cDNA为模板,进行real-time PCR,检测样本中EMCV的拷贝数。
迫杀同群、未接种EMCV的6只4周龄BALB/c雄性小鼠,取脑、心、脾等组织,应用建立的荧光定量RT-PCR测定EMCV含量以及β-actin、IL-1β和TNF-α基因的mRNA转录水平,作为感染前(第0 d)的对照数据。
以含有β-actin 10 000个拷贝的组织中所含有的IL-1β、TNF-α拷贝数来表示相应促炎细胞因子的mRNA转录水平。EMCV含量以每克组织中所含的拷贝数来表示。采用t检验对试验数据进行统计学分析,p<0.05为差异显著。
2 结 果
2.1 重组质粒标准品的制备 由小鼠脾脏提取的总RNA经反转录为cDNA后,应用特异性引物进行PCR,扩增管家基因β-actin以及IL-1β、TNF-α基因,得到了与目的片段大小相符的扩增产物(图1)。产物经回收、克隆,获得阳性菌。提取的质粒经PCR、EcoRⅠ和HindⅢ酶切以及测序鉴定,证实构建了重组质粒标准品。
2.2 Real-time PCR反应条件的优化 经优化,real-time PCR 25 μL 反应体系为:Realtime 2×TaqPCR MasterMix 12.5 μL,上、下游引物(20 pmol/μL)各 0.5 μL,ROX 参比染料 0.5 μL,荧光探针(20 pmol/μL)0.6 μL, cDNA 模 板 2.0 μL, ddH2O 8.4 μL。最佳反应条件为:95℃10 min;95℃15 s,55℃~60℃30 s,40个循环。

2.3 Real-time PCR标准曲线的制作 以10倍系列稀释的质粒标准品为模板进行real-time PCR,得到检测β-actin、IL-1β以及TNF-α的标准曲线(图2)。标准品起始模板浓度与Ct值呈现良好的线性关系,相关系数r2均达到0.998以上。

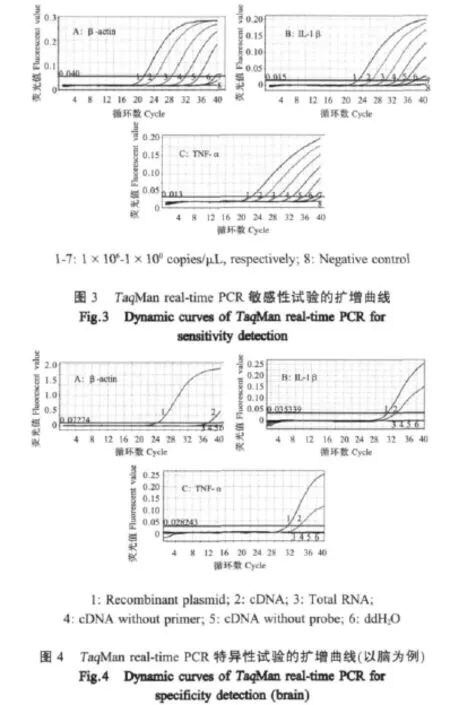
2.4 敏感性分析 经试验结果分析,p-β-actin、p-IL-1β及p-TNF-α的检出下限均为1×101copies/μL(图 3)。
2.5 特异性分析 以cDNA或以质粒标准品为模板、并加齐real-time PCR所需各组分时,β-actin、IL-1β及TNF-α获得特异性的扩增曲线,其它各种对照均为阴性。以脑的特异性反应结果为例见图4。
2.6 重复性分析 对p-β-actin、p-IL-1β及p-TNF-α质粒标准品的3个浓度梯度进行重复性试验,结果显示Ct值组内及组间的变异系数(CV)均小于2%(表 2)。
2.7 Real-time PCR的应用 4周龄BALB/c雄性小鼠经腹腔接种EMCV后第2 d开始出现临床症状,主要表现为被毛粗乱、精神沉郁、反应迟钝、蜷缩、流泪、呼吸急促,出现震颤、转圈、侧颈、后肢麻痹等明显的神经症状,接毒的18只小鼠分别于感染后第3 d死亡1只、第4 d死亡7只、第5 d死亡6只、第6 d死亡4只,表明BALB/c小鼠对猪源EMCV GXLC株高度易感。未接种病毒的10只对照小鼠观察到第8 d未出现异常现象(图5)。

表2 TaqMan real-time PCR的重复性分析Table 2 Reproducibility assay of theTaqMan real-time PCR

应用TaqMan real-time PCR对EMCV感染死亡小鼠脑、心、脾中的病毒含量进行检测,结果感染第3 d之后均可在脑、心、脾中检测到大量病毒,并且病毒含量脑中显著高于心、脾中(p<0.05),而心、脾中的病毒含量差异不显著(p>0.05)(图6)。
应用TaqMan real-time PCR,检测EMCV感染后不同时间死亡小鼠的脑、心、脾中IL-1β、TNF-α mRNA的转录水平。结果发现脑、心、脾中IL-1β mRNA的转录水平在感染后第3 d即显著上调,第4 d达到高峰,此后有所下降,但均显著高于对照小鼠的转录水平(图7)。脑、心、脾中TNF-α mRNA的转录水平在感染后第3 d即显著上调,其中脑、心在第4 d达到高峰,而脾在第6 d达到高峰,并且脑、脾中的转录水平在所有时间点均显著上调,而心中的转录水平则在第3 d和第4 d显著上调(图 8)。

3 讨 论

为了从分子水平研究EMCV的致病机制,本研究针对小鼠管家基因β-actin以及促炎细胞因子IL-1β、TNF-α基因,构建了重组质粒标准品,并优化反应条件,建立了检测 β-actin、IL-1β 及TNF-α基因的real-time PCR检测方法。结果表明,TaqMan real-time PCR的线性关系很好,直线回归方程的相关系数r2均达到0.998以上;检出下限均达到1×101拷贝/μL;特异性强,仅以总RNA反转录成的cDNA为模板,并加入特异性引物和探针的反应才能够检测到荧光信号;重复性好,各种浓度质粒模板的Ct值相对固定,组内及组间变异系数均小于2%。本研究应用所建立的TaqMan real-time PCR方法,对EMCV接种后不同时间死亡小鼠的脑、心、脾中IL-1β、TNF-α mRNA转录水平进行检测,进一步证实了其可靠性。
促炎细胞因子是由细胞分泌、能够调节免疫应答、具有促进和调节炎症反应作用的小分子多肽,其中IL-1和TNF-α是其主要成员[10]。IL-1作为内源性热质,引起发热;促进肝细胞合成急性期蛋白(APP);刺激免疫和炎性应答的各种效应细胞,参与募集白细胞到炎症位点的过程。TNF-α作为内源性热质,引起发热;能够上调白细胞迁移所需的内皮细胞黏附分子,并进一步激活中性粒细胞和巨噬细胞以增强其趋化性、吞噬作用、脱粒以及超氧化物的快速产生。有文献报道,患有急性心肌炎的病人血清中的IL-1β、TNF-α含量显著升高[11];对心肌具有亲嗜性的柯萨奇B3病毒(CB3)感染小鼠后,心肌中过量表达的IL-1β、TNF-α严重影响心肌的收缩功能[12-13];致心肌炎型EMCV-M株感染小鼠后,心肌中IL-1β、TNF-α的上调水平与心肌炎的严重程度呈正相关[4,14]。该结果提示,IL-1β、TNF-α在心肌炎的发生过程中起到重要作用。Tetsuo Shioi等以及Huang等的研究均表明,EMCV-M株感染小鼠后,心肌中IL-1β、TNF-α表达水平在感染后第3 d迅速提高,第7 d达到高峰,此后逐渐下降[4,14]。本研究中猪源EMCV GXLC株感染死亡的小鼠,其脑、心、脾中IL-1β、TNF-α mRNA的转录水平在感染后第4 d达到峰值(除脾中TNF-α mRNA的转录水平在第6 d达到峰值外),而此时感染小鼠的临床症状最明显、死亡率也达到高峰,提示组织中IL-1β、TNF-α的过量表达与感染动物的发病和死亡密切相关。与Shioi等和Huang等的报道有所差异,这可能与使用不同的病毒株、接种病毒剂量、小鼠品系有关[4,14]。
目前,实验室常用TaqMan探针法和SYBR GreenⅠ染料法real-time PCR定量检测细胞因子mRNA的转录水平[8]。由于SYBR GreenⅠ可以非特异性地与所有双股DNA结合,反应体系中的引物二聚体、污染的基因组DNA以及其他非特异性扩增产物均会导致假阳性的出现,因而SYBR GreenⅠreal-time PCR有其局限性。TaqMan real-time PCR则利用上、下游引物及探针使反应的特异性具有双重保证,从而确保检测结果的可靠性。本研究利用TaqMan探针法的优势,建立了小鼠IL-1β、TNF-α的Taq-Man real-time PCR检测方法,为利用小鼠作为动物模型,研究EMCV的致病机制提供了必要的技术平台。
[1]盖新娜,杨汉春,郭鑫,等.猪脑心肌炎病毒的分离与鉴定[J].畜牧兽医学报,2007,38(1):59-65.
[2]Ge Xin-na,Zhao Dong-sheng,Liu Chong-min,et al.Seroprevalence of encephalomyocarditis virus in intensive pig farms in China[J].Vet Rec,2010,166(5):145-146.
[3]Cerutis D R,Bruner R H,Thomas D C,et al.Tropism and histopathology of the D,B,K and MM variants of encephalomyocarditis virus[J].J Med Virol,1989,29(1):63-69.
[4]Shioi T,Masumori A,Sasayama S.Persistent expression of cytokine in the chronic stage of viral myocarditis in mice[J].Circulation,1996,94(11):2930-2937.
[5]Yamada T,Matsumori A,Saasyama S.Therapeutic effect of anti-tumor necrosis factor-alpha antibody on the murine model of viral myocarditis induced by encephalomyocarditis virus[J].Circulation,1994,89(2):846-851.
[6]Lee Y S,Li Na,Shin S,et al.Role of nitric oxide in the pathogenesis of encephalomyocarditis virus-induced diabetes in mice[J].J Virol,2009,83(16):8004-8011.
[7]Hirasawa K,Jun H S,Maeda K,et al.Possible role of macrophage-derived soluble mediators in the pathogenesis of encephalomyocarditis virus-induced diabetes in mice[J].J Virol,1997,71(5):4024-4031.
[8]Kubista M,Andrade J M,Bengtsson M,et al.The real-time polymerase chain reaction[J].Mol Aspects Med,2006,27(2-3):95-125.
[9]施开创,屈素洁,陈进喜,等.猪源脑心肌炎病毒GXLC株全基因组序列测定与分析[J].病毒学报,2010,26(2):134-142.
[10]Raymond C R,Wilkie B N.Th-1/Th-2 type cytokine profiles of pig T-cells cultured with antigen-treated monocyte-derived dendritic cells[J].Vaccine,2004,22(8):1016-1023.
[11]Matsumori A,Yamada T,Suzuki H,et al.Increased circulating cytokines in patients with myocarditis and cardiomyopathy[J].Br Heart J,1994,72(6):561-566.
[12]Freeman G L,Colston J T,Zabalqoitia M,et al.Contractile depression and expression of proinflammatory cytokines and iNOS in viral myocarditis[J].Am J Physiol,1998,274(1 Pt 2):H249-258.
[13]Neumann D A,Lane J R,Allen G S,et al.Viral myocarditis leading to cardiomyopathy:do cytokines contribute to pathogenesis[J].Clin Immunol Immunopathol,1993,68(2):181-190.
[14]Huang Chien-hua,Vallejo J G,Kollias G,et al.Role of the innate immune system in acute viral myocarditis[J].Basic Res Cardiol,2009,104(3):228-237.

