H5N1亚型禽流感病毒低剂量感染小鼠发病模型的建立
李旭勇,郭 晶,施建忠,李雁冰,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150001)
H5N1亚型禽流感病毒(Avian influenza virus,AIV)自2003年以来已在60多个国家和地区的家禽和野鸟中引起禽流感暴发,并在15个国家导致500多人感染,人的病死率近60%。
近年在H5N1亚型AIV进化、致病力分子机制及水平传播分子机制等方面取得了一系列的进展[1-3]。但有关病毒-宿主相互作用的致病机制仍未得到充分阐明。小鼠感染模型被广泛应用于季节性流感病毒发病机制的研究[4-5]。能够感染并致死人类的禽源H5N1高致病性流感病毒株往往对小鼠也表现为高度致死性[6]。目前的研究一般采用较大的病毒剂量感染小鼠,导致病毒在肺、脑等关键器官因病毒滴度快速升高,迅速致死动物[7-9]。然而,哺乳动物特别是人类自然感染时,一般只有微量病毒进入体内,病毒在体内复制及病理损伤进程往往持续2周~3周,最后才导致临床死亡[10-11]。为此,我们采用对哺乳动物和小鼠均具有高度致病力和致死性的候鸟分离病毒株A/bar-headed goose/Qinghai/3/05(BHG/3/05)[12],通过低剂量接种方式,建立了体内病毒复制动态、组织分布、病理损伤进程更加接近人类自然感染H5N1高致病性AIV发病进程的小鼠感染模型,为探讨人类感染H5N1高致病性AIV的病理发生机制提供了具有价值的动物感染模型。
1 材料和方法
1.1 病毒株 H5N1亚型AIV A/bar-headed goose/Qinghai/3/05(BHG/3/05)分离自野鸟斑头雁,是引起2005年我国青海湖野鸟禽流感暴发的H5N1亚型AIV之一[12]。病毒接种9日龄~10日龄鸡胚,37℃温箱中孵育24 h~36 h,收取尿囊液,按OIE推荐方法测定血凝价为8.0 log2~9.0 log2鸡胚半数感染量(EID50),分装保存于-70℃冰箱中备用。所有涉及H5N1高致病性AIV的操作均在生物安全3级实验室中进行。
1.2 动物实验 6周龄雌性BALB/c小鼠(购自北京维通利华公司)40只,随机分为两组,第一组5只,第二组35只。所有小鼠分别经CO2轻度麻醉后,通过鼻腔接种100.4EID50的病毒液。第一组感染病毒后每天称量计算平均体质量并观察发病与存活情况。第二组分别于感染后第3 d、5 d、7 d、10 d、14 d,随机抽取3只存活小鼠,经CO2麻醉后剖杀,采集脑、鼻甲、脾脏、肾脏、肺脏等器官,按照文献[6]方法分别进行病毒含量的滴定;同时分别于感染后的第3 d、7 d、10 d,随机选取3只小鼠剖杀,采集肺、脑和脾脏,进行组织病理学检查。
1.3 病理组织学检查 小鼠脑、脾脏、肺脏分别经10%中性福尔马林溶液固定后,按常规包埋,制备石蜡切片,HE染色后镜检。同时利用A型流感病毒NP单克隆抗体,采用免疫组化试剂盒,按照说明书进行组织切片的免疫组化染色,检测脑、脾脏、肺脏组织细胞中的病毒抗原。
2 结 果
2.1 小鼠的发病和死亡情况 小鼠在接种100.4EID50剂量的BHG/3/05 2 d后,体质量出现下降趋势(图1A);一周后小鼠开始出现严重的临床症状,主要表现为食欲下降、呼吸急促、共济失调、颤抖、运动迟缓等症状。有40%的小鼠在持续2周的观察期内死亡,耐过的小鼠大多表现出轻微的神经症状(图1B)。结果表明,即使极小剂量的BHG/3/05病毒感染后仍可导致一部分的小鼠死亡,这与以前的研究报告中BHG/3/05对小鼠的半数致死量(MLD50)小于100.5EID50一致[12]。

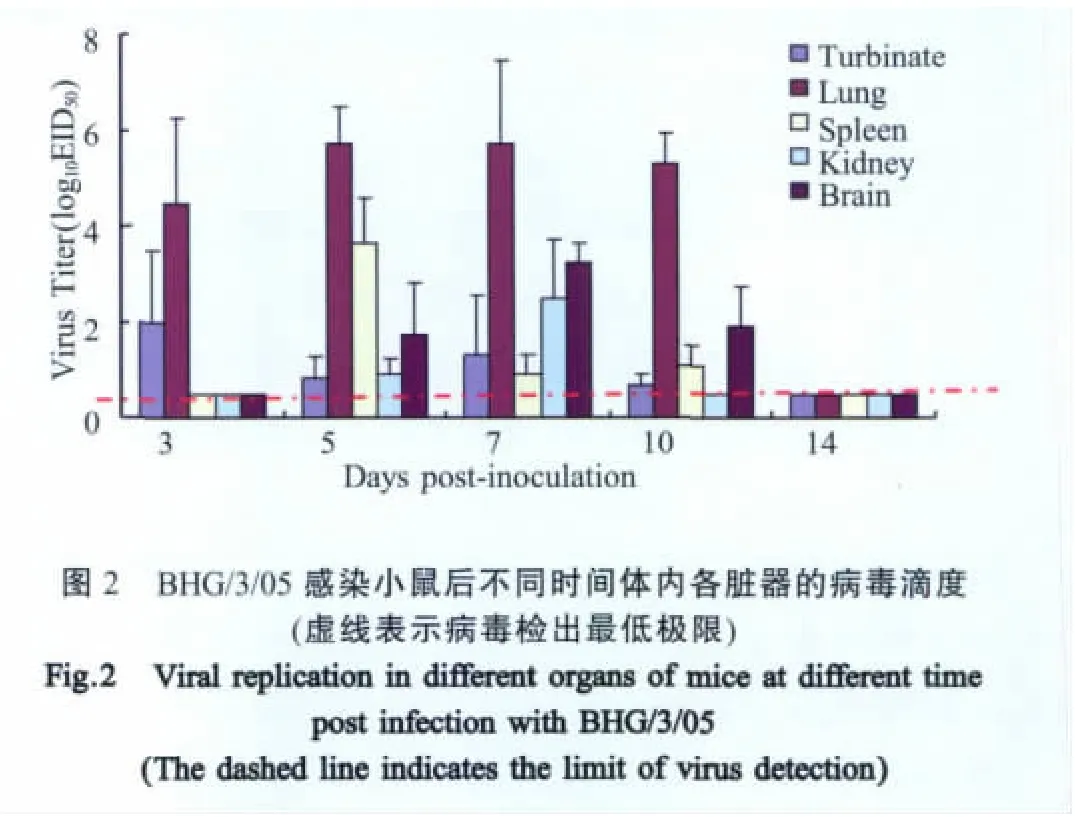
2.2 病毒在体内的复制与扩散 病毒感染后第3 d、5 d、7 d、10 d及14 d,分别迫杀3只小鼠,取其鼻甲、肺脏、脾脏、肾脏和脑等器官进行病毒滴定。结果显示感染后第3 d,除鼻甲和肺脏,其他脏器中均未检测到病毒。感染后第5 d、7 d和第10 d,所有被检的脏器中都检测到了病毒。鼻甲中的病毒滴度以第3 d为最高;肺脏中的病毒在感染后第5 d、7 d、10 d均维持在一个较高水平;脾脏中的病毒滴度以感染后第5 d为最高;脑和肾脏中的病毒滴度分别在第7 d达到最高。感染后第14 d,所有被检器官中均未检测到病毒(图2)。
2.3 组织病理学变化 组织病理学检查显示,感染后第3 d的肺脏以充血、渗出为主,至第10 d发展为典型的间质性肺炎;感染后第5 d和第10 d。脾脏变化主要表现为滤泡中淋巴细胞的大量丢失,脑组织中的病理变化主要表现为非化脓性脑炎(图3)。同时,免疫组化染色分别在感染后第7 d,剖杀小鼠的肺、脾和脑组织中检测到流感病毒抗原(图4)。

3 讨 论
BALB/c小鼠是流感病毒研究中使用最为广泛的哺乳动物模型,一般的季节性流感病毒接种小鼠后,病毒复制多局限于呼吸道,5 d~7 d后被免疫系统清除[13-14]。而H5N1亚型高致病性AIV感染后可能导致全身感染,并迅速致死。研究发现2005年引起青海湖野鸟禽流感暴发的H5N1亚型病毒对小鼠的致病力呈多样性,其中BHG/3/05株中对小鼠呈高致病力(小鼠半数致死量小于100.5EID50)。采用高剂量(106EID50)的BHG/3/05接种小鼠后,第3 d可在多个器官中检测到该病毒[12],接种后第6 d~8 d所有小鼠死于感染。当用低剂量(100.4EID50)感染小鼠后,第3 d仅在鼻腔和肺脏中检测到该病毒。但病毒并未被局限在呼吸系统或被清除,而是随时间推移逐渐侵入多个脏器;接种后第7 d,脑和肾脏中的病毒滴度达到峰值;感染后小鼠的体质量持续下降,病症逐渐加重,至第9 d开始死亡。结果表明,低剂量感染条件下,病毒在小鼠体内复制、发病进程及小鼠死亡时间均显著推迟。与高剂量感染快速致死模型相比,这种低剂量感染的病毒复制与发病进程显然更加接近人的自然感染与发病状态,为研究探讨H5N1高致病性AIV感染人类的发病机制提供了较为理想的研究模型。
本研究结果同时提示,即使低剂量病毒感染后,H5N1高致病性AIV仍有可能突破宿主天然免疫屏障,在多器官复制并产生致死性后果。这也部分解释了为什么许多人的H5N1禽流感感染病例只有活禽市场暴露经历而无直接病原接触史,但仍然引起严重的临床症状和病理损伤,最终导致死亡,从而进一步揭示了H5N1亚型AIV对哺乳动物的高致病力,以及其对公共卫生所具有的潜在危险性。
[1]Chen Hua-lan,Deng Guo-hua,Li Ze-jun,et al.The evolution of H5N1 influenza viruses in ducks in southern China[J].PNAS,2004,101(28):10452-10456.
[2]Gao Yu-wei,Zhang Ying,Kyoko S,et al.Identification of amino acids in HA and PB2 critical for the transmission of H5N1 avian influenza viruses in a mammalian host[J].PLoS Pathog,2009,5(12):e1000709.
[3]Li Ze-jun,Chen Hua-lan,Jiao Pei-rong,et al.Molecular basis of replication of duck H5N1 influenza viruses in a mammalian mouse model[J].J Virol,2005,79(18):12058-12061.
[4]Maines T R,Jayaraman A,Belser J A,et al.Transmission and pathogenesis of swine-origin 2009 A(H1N1)influenza viruses in ferrets and mice[J].Science,2009,325(5939):484-490.
[5]Scholtissek C,Rohde W,Hoyningen V V,et al.On the origin of the human influenza virus subtypes H2N2 and H3N2[J].Virology,1978,87(1):13-20.
[6]Li Yan-bing,Shi Jian-zhong,Zhong Gong-xun,et al.Continued evolution of H5N1 influenza viruses in wild birds,domestic poultry,and humans in China from 2004 to 2009[J].J Virol,2010,84(17):8389-8393.
[7]Chan P K S.Outbreak of avian influenza A(H5N1)virus infection in Hong Kong in 1997[J].Clin Infect Dis,2002,34(Supplement 2):58-63.
[8]Lipatov A,Kwon Y,Mary J,et al.Pathogenesis of H5N1 influenza virus infections in mice and ferret models differ between respiratory and digestive system exposure[J].J Infect Dis,2009,199:717-725.
[9]Zhou Ji-yong,Shen Hui-gang,Chen Hong-xun,et al.Characterization of a highly pathogenic H5N1 influenza virus derived from bar-headed geese in China[J].J gen virol,2006,87(7):1823-1828.
[10]Zhu Qing-yu,Wang Wei,Yu Jun,et al.Fatal infection with influenza A(H5N1)virus in China[J].N Engl J Med,2006,354(25):2731-2732.
[11]Subbarao K,Klimov A,Katz J,et al.Characterization of an avian influenza A(H5N1)virus isolated from a child with a fatal respiratory illness[J].Science,1998,279(5349):393-397.
[12]Chen Hua-lan,Li Yan-bing,Li Ze-jun,et al.Properties and dissemination of H5N1 viruses isolated during an influenza outbreak in migratory waterfowl in western China[J].J virol,2006,80(12):5976.
[13]Maines T R,Jayaraman A.Transmission and pathogenesis of swine-origin 2009 A(H1N1)influenza viruses in ferrets and mice[J].Science,2009,325(5939):484-489.
[14]Svitek N,Rudd P A,Obojes K,et al.Severe seasonal influenza in ferrets correlates with reduced interferon and increased IL-6 induction[J].Virology,2008,376(1):53-59.

