卡泊芬净对生物膜态白色念珠菌体外抑菌作用的试验研究Δ
阳隽,张天托,朱家馨(1.广州医学院第二附属医院呼吸内科,广州市51060;.中山大学第三附属医院呼吸内科,广州市 510630)
近年来随着临床上广谱抗菌药物的大量使用及侵入性治疗的开展,念珠菌感染呈增多趋势。白色念珠菌可在黏膜及各类导管支架的表面形成生物膜,生物膜是一种由融合的基底芽生孢子层、菌丝成分和细胞外多聚基质3部分组成的结构群体,可以逃避宿主免疫作用,具有极强的耐药性。生物膜态白色念珠菌相关感染是临床治疗上的难点。卡泊芬净是一种新型的棘白菌素类抗真菌药物,作用机制为抑制β-(1,3)-D-葡聚糖的合成,体外研究[1~4]显示卡泊芬净对生物膜态白色念珠菌有抑制作用,但对于卡泊芬净的有效浓度各实验室报道不一。因此,本研究选取了10株已证实的可黏附生长形成生物膜态白色念珠菌的临床分离株,分别检测卡泊芬净对生物膜态白色念珠菌的抑菌作用,以探讨临床治疗生物膜态白色念珠菌相关感染的最适治疗剂量。
1 仪器与材料
1.1 仪器
TE2000U倒置显微镜(日本Nikon公司);ELX800全自动酶标仪(美国BioTek公司);EVO 50电子显微镜(德国Zeiss公司)。
1.2 药品
注射用醋酸卡泊芬净(以下简称卡泊芬净,美国默克公司,批号:J6253,规格:每支50 mg)。
1.3 菌株
白色念珠菌临床分离株均分离自中山大学第三附属医院呼吸实验室收集的临床痰液标本,试验共收集了54株,并筛选出10株黏附生长明显、能形成典型生物膜态白色念珠菌的菌株进行药敏试验,菌株编号为 13860、13874、13879、14215、14813、15086、15346、15538、16308、16335。质控菌株:白色念珠菌(ATCC90 028、ATCC64 550)由中山大学第三附属医院呼吸实验室保存。
1.4 培养基
科玛嘉念珠菌显色培养基(法国CHROMagar公司产品,批号:100517)、沙堡氏葡萄糖琼脂培养基(SDA,批号:100608)均由广东江门凯林贸易有限公司提供;RPMI1640培养基(美国Gibco公司,批号:785914)。
2 方法
2.1 贮备液的制备
取卡泊芬净适量,用灭菌水溶解,并稀释成浓度10 mg·mL-1贮备液,于-20℃分装保存,备用。
2.2 菌株的鉴定与保存
取临床分离株经科玛嘉念珠菌显色培养基及芽管实验鉴定为白色念珠菌,将鉴定分纯的白色念珠菌单个菌落接种于酵母浸出粉胨葡萄糖培养基(YPD,组成:1%酵母浸出粉、2%蛋白胨、2%葡萄糖),振荡培养过夜,取菌液800µL与灭菌甘油200µL充分混匀,放置于-70℃冰箱保存,备用。
2.3 生物膜态白色念珠菌的形成
取出冻存的白色念珠菌接种于SDA平板,置于CO2恒温培养箱中,37℃培养24 h,挑取平板上生长的白色念珠菌单个菌落接种于YPD中,30℃振荡培养24 h,离心收集菌体,0.1 mol·L-1磷酸盐缓冲液(PBS)漂洗2次,加入RPMI1640培养基调节菌液浓度为1×106个/L,接种于放置有20 mm×20 mm聚乙烯细胞爬片的6孔细胞培养板中,于CO2恒温培养箱中37℃培养24 h,PBS漂洗2次,洗去未黏附菌细胞,置于倒置显微镜下观察生物膜态白色念珠菌的结构。另将PBS漂洗后的细胞爬片于2%戊二醛中固定3 h,PBS漂洗3次,每次15 min,再用50%、70%、80%、90%、95%乙醇逐级脱水,各15 min,然后换叔丁醇脱水15 min,经临界点干燥镀膜处理后于电子显微镜下观察生物膜态白色念珠菌的结构。
2.4 游离态白色念珠菌药敏试验
选用美国国家临床实验室标准化委员会(NCCLS)M27-A方案的微量液体稀释法,采用倍比稀释法稀释药液,取卡泊芬净贮备液用RPMI1640培养基稀释至浓度为0.063~32 mg·L-1作为试验孔,并设立不含药物的阳性对照和无菌培养基空白对照。加入白色念珠菌(即游离态白色念珠菌)或质控菌株35℃培养48 h后,于酶标仪520 nm波长处测定各孔吸光度(A),并计算Y值=(各试验孔A值-空白对照A值)/阳性对照A值,Y值越大,白色念珠菌的增殖活性越强。当Y值<0.5时的最低卡泊芬净浓度即为半数抑菌浓度(MIC50),试验设3个复孔。
2.5 生物膜态白色念珠菌药敏试验
[5]报道的方法进行,将白色念珠菌接种于96孔细胞培养板上黏附生长24 h,PBS漂洗3次,去除未黏附菌细胞。加入用RPMI1640培养基倍比稀释的卡泊芬净,浓度为0.25~256 mg·L-1[4]作为试验孔,并设立不含药物的阳性对照。35℃培养48 h,采用四唑盐(XTT)减低法检测菌细胞增殖活性,于酶标仪490 nm波长处测定各孔吸光度,每株菌取4个复孔检测,取其平均值,并计算Y值=各试验孔A值/阳性对照A值,Y值越大,白色念珠菌的增殖活性越强。当Y值<0.5时的最低卡泊芬净浓度为MIC50。
3 结果
3.1 生物膜态白色念珠菌的结构
白色念珠菌分离株可在聚乙烯细胞爬片上黏附生长形成生物膜。倒置显微镜下可见生物膜态白色念珠菌主要由菌丝细胞构成,间有孢子,具体见图1;电子显微镜下可见生物膜态白色念珠菌具有菌丝交错的三维立体空间结构,具体见图2。
3.2 游离态白色念珠菌药敏试验结果

图1 倒置显微镜下生物膜态白色念珠菌结构图(20×10)Fig 1 Inverted microscope image of Candida albicans biofilm(20×10)

图2 电镜下生物膜态白色念珠菌结构图(×3 000)Fig 2 SEM image of Candida albicans biofilm(×3 000)
卡泊芬净对10株游离态白色念珠菌及质控菌株的MIC50为0.125~0.5 mg·L-1,MIC50中位数为0.25 mg·L-1。当卡泊芬净浓度高于游离态白色念珠菌MIC50时,10株游离态白色念珠菌的增殖活性几乎完全受到抑制。卡泊芬净对10株游离态白色念珠菌的MIC50值详见表1。不同浓度卡泊芬净作用下游离态白色念珠菌的增殖活性比较见图3。
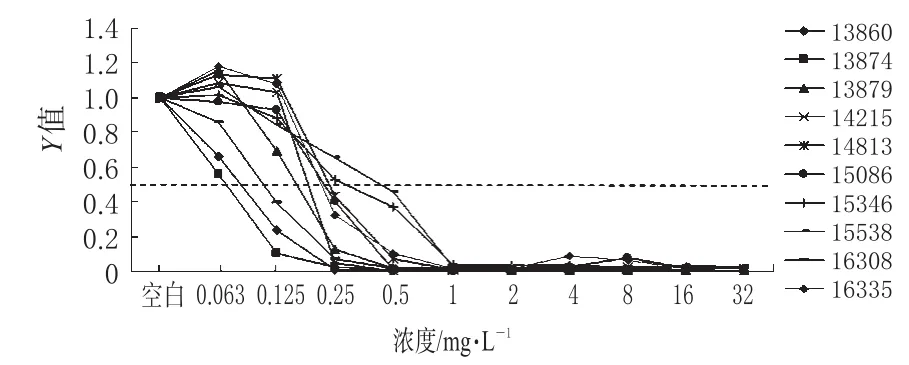
图3 不同浓度卡泊芬净作用下游离态白色念珠菌的增殖活性比较Fig 3 Metabolic activity of planktonic cells of C.albicans at different concentrations of caspofungin
3.3 生物膜态白色念珠菌药敏试验结果
结果表明,卡泊芬净对10株生物膜态白色念珠菌的MIC50为 0.25~256 mg·L-1,其中有 8株生物膜态白色念珠菌MIC50≤2 mg·L-1,MIC50中位数为1 mg·L-1。当卡泊芬净浓度高于生物膜态白色念珠菌MIC50时,有7株生物膜态白色念珠菌(编号13860、13879、14813、15086、15538、16308、16335)的增殖活性再次增强,且大于阳性对照的50%。卡泊芬净对10株生物膜态白色念珠菌的MIC50值详见表1。不同浓度卡泊芬净作用下生物膜态白色念珠菌的增殖活性比较见图4。

表1 卡泊芬净对游离态及生物膜态白色念珠菌的MIC50值Tab 1 MIC50of caspofungin against planktonic cells and biofilm-associated adherent cells of Candida albicans
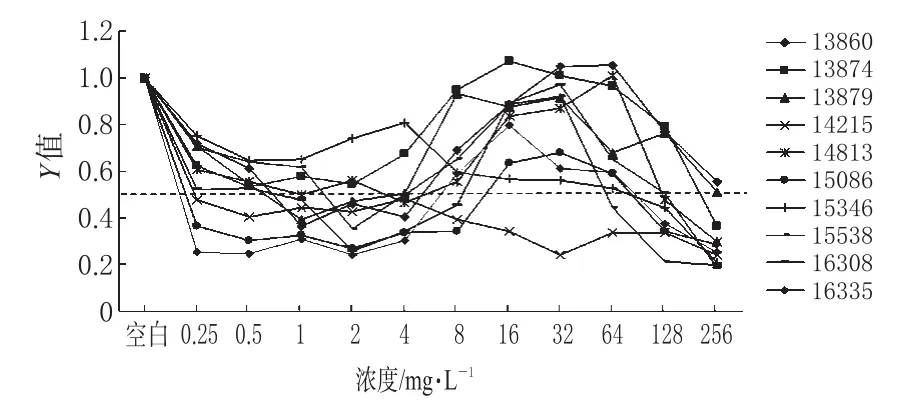
图4 不同浓度卡泊芬净作用下生物膜态白色念珠菌的增殖活性比较Fig 4 Metabolic activity of biofiom cells of C.albicans at different concentrations of caspofungin
4 讨论
本研究结果显示,10株游离态白色念珠菌对卡泊芬净敏感,MIC50为0.125~0.5 mg·L-1,而治疗剂量的卡泊芬净静脉滴注,平均血药浓度为12.4 mg·L-1,24 h后为1.42 mg·L-1[6],提示体内卡泊芬净对游离态白色念珠菌具有良好的抗菌作用。
卡泊芬净对10株生物膜态白色念珠菌的MIC50为0.25~256 mg·L-1,其中8株≤2 mg·L-1,表明临床治疗剂量的卡泊芬净对大部分生物膜态白色念珠菌有抑菌作用。但有研究[1~4]报道卡泊芬净对生物膜态白色念珠菌的有效浓度差异较大,考虑可能与所用菌株不同相关。本研究结果显示,当卡泊芬净浓度高于生物膜态白色念珠菌MIC50时,有7株生物膜态白色念珠菌的增殖活性再次增强,而更高浓度的卡泊芬净(256 mg·L-1)对生物膜态白色念珠菌的抑菌作用有再次增高趋势,与国外文献报道基本一致[7,8],但其可能机制目前尚不明确。
综上所述,临床治疗剂量的卡泊芬净对游离态白色念珠菌有良好的抑菌作用,对生物膜态白色念珠菌也有抑菌作用,但不呈浓度依赖性,当其浓度高于MIC50时抑菌作用出现下降现象,此现象对临床治疗的影响目前尚不清楚。在将其用于治疗生物膜态白色念珠菌相关感染时,最适治疗剂量有待临床研究验证。
参考文献
[1] Bachmann SP,VandeWalle K,Ramage G,et al.In vitro activity of caspofungin againstCandida albicansbiofilms[J].Antimicrob Agents Chemother,2002,46(11):3 591.
[2] Cocuaud C,Rodier MH,Daniault G,et al.Anti-metabolic activity of caspofungin againstCandida albicansand Candida parapsilosis biofilms[J].J Antimicrob Chemother,2005,56(3):507.
[3] Cateau E,Rodier MH,Imbert C.In vitro efficacies of caspofungin or micafungin catheter lock solutions onCandida albicansbiofilm growth[J].J Antimicrob Chemother,2008,62(1):153.
[4] Tobudic S,Lassnigg A,Kratzer C,et al.Antifungal activity of amphotericin B,caspofungin and posaconazole onCandida albicansbiofilms in intermediate and mature development phases[J].Mycoses,2010,53(3):208.
[5] Ramage G,VandeWalle K,Wickes BL,et al.Standardized method for in vitro antifungal susceptibility testing ofCandida albicansbiofilms[J].Antimicrob Agents Chemother,2001,45(9):2 475.
[6] 陈轶坚,吴菊芳.抗真菌新药-卡泊芬净[J].中国抗感染化疗杂志,2004,4(5):313.
[7] Stevens DA,Espiritu M,Parmar R.Paradoxical effect of caspofungin:reduced activity againstCandida albicansat high drug concentrations[J].Antimicrob Agents Chemother,2004,48(9):3 407.
[8]Melo AS,Colombo AL,Arthington-Skaggs BA.Paradoxical growth effect of caspofungin observed on biofilms and planktonic cells of five differentCandidaspecies[J].Antimicrob Agents Chemother,2007,51(9):3 081.

