结缔组织生长因子特异性小分子干扰RNA的筛选及其在抗肝纤维化中的作用
毛小荣,岳 伟,袁 宏,陈 红,薛 苗
(兰州大学第一医院传染科,甘肃兰州730000)
HSC(hepatic stellate cell,HSC)的活化、转化及增殖是肝纤维化发生发展中的中心环节,已经有大量研究显示,TGF-β和CTGF因子是介导HSC活化的关键细胞因子,所以是否能抑制是RNAi治疗肝纤维化的关键,且是较理想的靶位,尤其以 CTGF因子为最佳[1-2]。CTGF是近几年来发现的一种重要的致器官组织纤维化的细胞因子,它不但可以特异性的介导TGF-β的促纤维化效应,而且也不影响其抑制细胞的增殖和免疫反应的作用,还可以介导由机械应力、肾素-血管紧张素及肿瘤坏死因子-α等诱导的肝纤维化[3-4]。本研究旨在设计合成三段RNA干扰候选片段,并筛选出高效的干扰片段,运用RNA干扰技术,探讨其通过尾静脉注射是否具有抗大鼠肝纤维化作用,为今后寻找更有效的抗肝纤维化治疗方法提供新策略。
1 材料和方法
1.1 实验材料 人胎肝细胞株(L-02)来源于本实验室冻存细胞,设计好的脱氧核苷酸序列由上海吉玛公司合成,脂质体2000(Lipofectamine 2000)为美国Invitrogen公司产品,Opti-MEM培养基(Opti-MEM I Reduced Serum Medium)为美国Invitrogen公司产品,ECL试剂盒为美国Pierce公司产品,兔抗人 CTGF抗体为美国PEPRO TECH公司产品,小鼠β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔二抗及羊抗小鼠二抗购于武汉博士德生物有限公司。SD大鼠由甘肃省中医学院SPF级动物实验中心提供。Trizol及两步法 RT-PCR试剂盒为Takara公司产品,肝纤维化指标放免试剂盒购自北京北方生物制品研究所,CTGF及β-actin引物由Takara公司设计及合成,CCl4为长江化工厂产品,其它为分析纯试剂。
1.2 实验方法
1.2.1 基因干扰靶点的选择及高效CTGFsiRNA干扰片段的筛选 从Genbank中获取大鼠CTGF基因cDNA序列(NM-022266),根据在线 Genscript siRNA Target Finder设计软件确定靶序列。根据设计原则,结合所设计的寡核苷酸链在CTGFmRNA序列中的分布等因素选择序列。
根据设计原则,结合所设计的寡核苷酸链在CTGFmRNA序列中的分布等因素,选择以下3条序列并将设计好的脱氧核苷酸序列送于上海吉玛公司合成。
siCTGF-1
正义链:5'-pGCA CCA GUG UGA AGA CCU AdTdT-3'
反义链:5'-pUAG GUC UUC ACA CUG GUG CdTdT-3'
siCTGF-2
正义链:5'-pCCG CAA GAU UGG CGU GUG CdTdT-3'
反义链:5'-pGCA CAC GCC AAU CUU GCG GdTdT-3'
siCTGF-3
正义链:5'-pGAG UGG AGC GCC UGU UCU AdTdT-3'
反义链:5'-pUAG AAC AGG CGC UCC ACU CdTdT-3'
NC(Negative control)
正义链:5'-pUUC UCC GAA CGU GUC ACG UdTdT-3'
反义链:5'-pACG UGA CAC GUU CGG AGA AdTdT-3'
Negative control序列经Blast确认与大鼠CTGFmRNA无同源性。
CTGF siRNA转染L-02:将siCTGF Oligo和lipofectamine2000稀释物混和,室温孵育 20 min。滴入待转染细胞孔,提取蛋白。加全蛋白裂解液裂解30 min,12 000 r/min离心5 min收集上清液。总蛋白样品和4X SDS上样缓冲液混匀后,100℃沸水煮5min。电泳分离,5%脱脂奶粉/TBST室温,封闭60min;一抗4℃孵育过夜;TBS-T漂洗3次,每次10 min;二抗室温孵育120 min;TBS-T漂洗3次,每次10 min。ECL(electrochemiluminescence)作用后胶片曝光,经显影、定影处理后观察结果。结果以培清凝胶成像仪器成像,SensiAnsys凝胶图像分析系统拍照分析。
1.2.2 动物实验
1.2.2.1 肝纤维化大鼠模型的建立 30只雄性SD大鼠,随机分成5组,每组6只。模型组腹腔注射40%CCl4(CCl4与橄榄油按2∶3比例混合,3 ml/kg)及尾静脉注射生理盐水(与siRNA溶液等量),1次/3 d,连续8周,CCl4首剂加倍。预防组腹腔注射40%CCl4(3 ml/kg)及尾静脉注射抗CTGF siRNA(0.1 mg/kg,溶于300 μl Opti-MEM1),1 次/3 d,连续 8 周。2 周治疗组腹腔注射40%CCl4(3 ml/kg)2周,后给予抗CTGF siRNA及CCl46周。4周治疗组腹腔注射40%CCl4(3 ml/kg)4周,后给予抗CTGF siRNA及CCl44周。空白对照组尾静脉注射生理盐水8周。以上各实验组所用试剂计量及时间均参考国内外文献[5]。于最后一次CCl4注射3天后所有动物经股动脉取血及肝组织标本。
1.2.2.2 肝纤维化(透明质酸 HA、人Ⅲ型前胶原hpcIII及Ⅳ型胶原 Ⅳ.C)指标测定 按照放射免疫试剂盒说明书由兰州大学第一医院核医学科操作。
1.2.2.3 组织学检查 肝组织标本以4%多聚甲醛固定,石蜡包埋。肝组织切片用于Masson染色,光镜下观察肝细胞变性、坏死、炎症细胞浸润及肝纤维化情况并拍照。参照慢性肝炎分级分期标准对大鼠肝纤维化程度进行病理分级。
1.2.2.4 RNA抽提及RT-PCR分析 提取肝组织总RNA,取总RNA溶于10μl反应体系行逆转录合成cDNA,在Rotor Gene-3000荧光定量PCR上进行PCR反应。PCR引物:CTGF sense:5'-CAC CCG GGT TAC CAA TGA CAA-3';Anti-sense:5'-AGC CCG GTA GGT CTT CAC ACT G-3';β-actin sense:5'-GAC TCA TCG TAC TGC TTG CT-3';Anti-sense:5'-GGA GAT TAC TGC CCT GGC TCC TA-3'。反应条件如下:第一步是预变性,95℃预变性30 s,共1个循环;第二步是 PCR反应,95℃变性5 s,60℃退火30 s,共40个循环。整个过程中收集荧光,反应结束后,使用Rotor-Gene Real-Time Analysis Software 6.1软件分析PCR过程各检测样本的Ct值。
1.2.2.5 蛋白质抽提及Western印迹分析取大鼠肝脏组织,裂解充分研磨,凝胶电泳分离,5%脱脂奶粉/TBST室温封闭60 min;一抗4℃ 孵育过夜;TBST(Tween-20 500 μl,10XTBS 50 ml,ddH2O 450 ml)漂洗3 次,每次 10 min;二抗室温孵育 120 min,TBST漂洗3次,每次10 min。ECL作用后胶片曝光,经显影、定影处理后观察结果。结果以培清凝胶成像仪器成像,SensiAnsys凝胶图像分析系统拍照分析。
2 结果
2.1 通过细胞转染筛选高效的CTGF siRNA
2.1.1 3条CTGFsiRNA分别转染L-02细胞CTGF蛋白表达的干扰效果 Western Blot结果经计算机灰度扫描并与内参(β-actin)比较分析显示。L-02细胞转染 siCTGF-1、siCTGF-2、siCTGF-3干扰后,CTGF蛋白表达分别为55.09±2.34、6.18 ±0.32、18.66 ±1.09,与对照相比,转染siRNA的L-02细胞CTGF蛋白表达明显下调(P<0.05)。见图1。
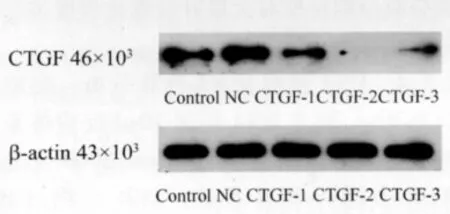
图1 L-02细胞CTGF蛋白表达Fig.1 L-02 CTGF cell protein expression
2.1.2 筛选高效的CTGFsiRNA序列 将control(空白对照)组比值数据看做100%,分别得到 siCTGF-1、siCTGF-2、siCTGF-3各片段,干扰率为44.91%、93.99%、81.34%,其中以siCTGF-2干扰率最高,效果最明显。转染非特异性siRNA的L-02细胞CTGF蛋白表达无明显变化(P<0.05)。见图2。
2.2 CTGF siRNA对大鼠肝纤维化的影响
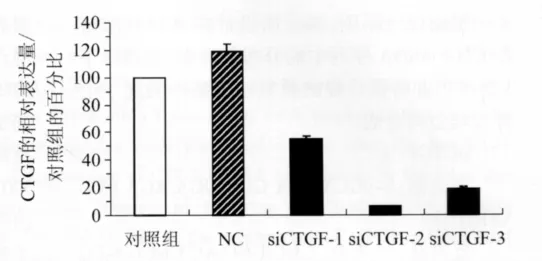
图2 各siRNA片段对L-02细胞CTGF蛋白表达的影响Fig.2 SiRNA on to L-02 CTGF cell protein expression effect
2.2.1 显著减轻肝细胞变性、坏死及炎症细胞浸润及肝纤维化程度 Masson染色所见,纤维沉积基本为胶原纤维,显色为绿色。正常组(图3a)肝小叶结构正常。模型组(图3b)肝小叶结构失常,肝细胞重度坏死,嗜酸性变,细胞间质纤维组织增生,大量炎性细胞浸润;根据评分标准炎症活动度(G)为4级,肝纤维化程度(S)为3级。而预防组(图3c)G为0~1级,S为0~1级,治疗组(图3d)G为1级,S为1级,均肝细胞变性、坏死及炎症细胞浸润明显减轻。晚期治疗组(图3e)肝小叶结构存在,肝细胞轻度变性坏死,伴桥接坏死,汇管区少量纤维组织增生,少量淋巴细胞浸润,根据评分标准G为1~2级,S为2级。
2.2.2 CTGF siRNA对肝组织纤维化的影响显著减少血清中HA、hpcⅢ及Ⅳ.C含量(见表1)。
2.2.3 CTGF siRNA对肝组织CTGF基因表达的影响
2.2.3.1 显著抑制CTGF mRNA表达 见表2。分别扩增 CTGF和 β-actin,每样本重复3次,得到 Ct 平均值。△Ct干预组=Ct干预组CTGFCt干预组β-actin,△Ct空白组= Ct空白组CTGF-Ct空白组β-actin,△△Ct= △Ct干预组—△Ct空白组,CTGFmRNA 表达差别倍数以 2-△△Ct表示。
2.2.3.2 显著抑制CTGF蛋白表达(见图4)
Western印迹结果与内参照(β-actin)比较分析显示,CTGF/β-actin灰度比在预防组(0.105±0.003)、治疗组(0.190 ±0.006)、晚期治疗组(0.334±0.006)较模型组(0.544±0.019)明显减低(P <0.05),对照组为0.027±0.003,表明静脉注射抗CTGF siRNA在蛋白质水平可显著抑制CCl4诱导的大鼠肝CTGF基因表达。
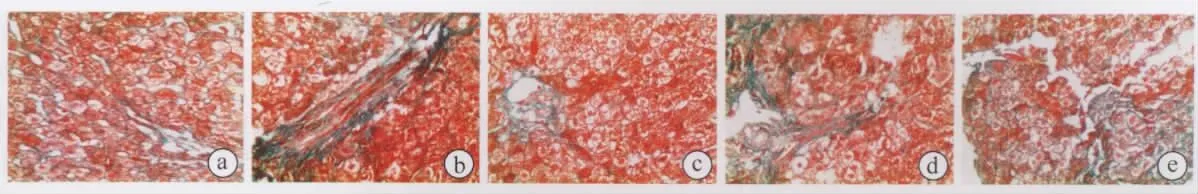
图3 大鼠肝细胞切片图(×200)Fig.3 Rat liver cells slice figure(×200)
表1 抗CTGF siRNA对大鼠肝纤维化各项指标的影响(±s)Table 1 CTGF siRNA in rat liver fibrosis the effect of the indicators
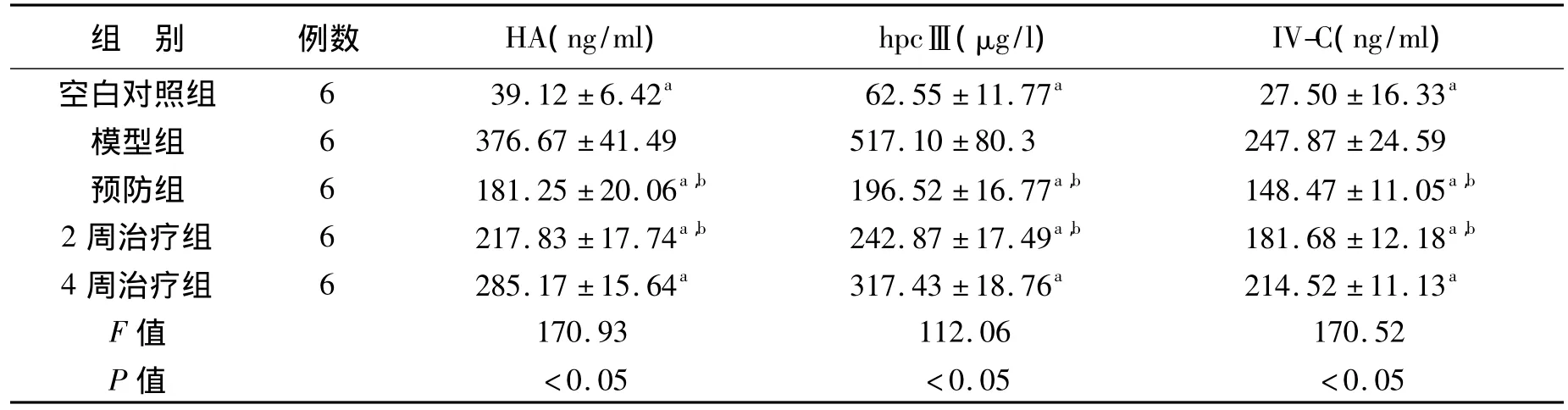
表1 抗CTGF siRNA对大鼠肝纤维化各项指标的影响(±s)Table 1 CTGF siRNA in rat liver fibrosis the effect of the indicators
a与模型组比较有统计学意义(P<0.05);b与4周治疗组比较有统计学意义(P<0.05)
组 别 例数 HA(ng/ml) hpcⅢ(μg/l) IV-C(ng/ml)空白对照组 6 39.12±6.42a 62.55±11.77a 27.50±16.33a模型组 6 376.67±41.49 517.10±80.3 247.87±24.59预防组 6 181.25 ±20.06a,b 196.52 ±16.77a,b 148.47 ±11.05a,b 2 周治疗组 6 217.83 ±17.74a,b 242.87 ±17.49a,b 181.68 ±12.18a,b 4周治疗组 6 285.17±15.64a 317.43±18.76a 214.52±11.13a F值 170.93 112.06 170.52 P值 <0.05 <0.05 <0.05
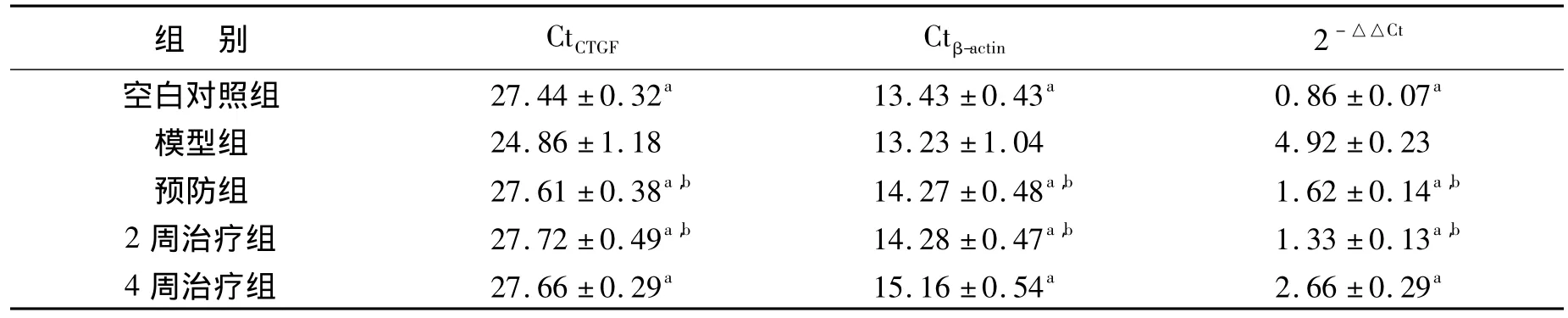
表2 各组大鼠肝脏组织CTGF基因表达相对值比较Table 2 Each rat liver tissue CTGF gene expression compared the relative value
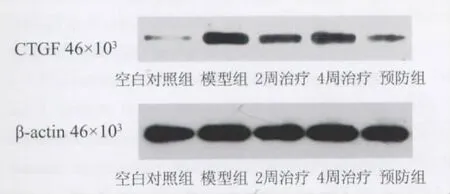
图4 肝组织CTGF蛋白表达Fig.4 CTGF liver tissue protein expression
3 讨论
肝纤维化是所有慢性肝病进展为肝硬化必然的中间过程,是肝脏对各种慢性损伤刺激的一种修复反应,主要与HSC及各种促纤维化细胞因子有关,目前尚无有效的防治方法[6-7],故积极探索肝纤维化的发病机制及寻找有效的抗肝纤维化的方法是减少慢性肝炎患者死亡率的关键,已成为人们研究的热点。CTGF是近年来新发现的一种在肝纤维化过程中起关键作用的细胞因子,与肝纤维化的发生、发展密切相关,被认为是RNAi治疗肝纤维化较理想的靶位,倍受关注[8]。
本实验设计的三段CTGFsiRNA片段对靶基因表达均有明显的抑制作用,但抑制效率并不完全相同,以siCTGF-2抑制效率最高,且达90%以上,可以高效抑制靶基因表达,成功筛选出高效CTGFsiRNA。各种病因所致的肝脏慢性的炎症、缺血及坏死,可以通过刺激局部肝细胞、HSC、内皮细胞及炎症浸润细胞释放出各种细胞因子,而这些细胞因子则参与肝纤维化发生、发展的过程。近年来许多文献报道,抑制CTGF的表达能够明显减轻大鼠肝细胞变性、坏死及炎症细胞的浸润,使胶原增生明显减少,肝纤维化明显减轻,正如本实验研究中肝组织病理改变所见,提示CTGF可能具有促进炎症或化学趋化的作用。抑制CTGF能够保护肝脏细胞免受细胞毒的刺激损伤的机制目前尚不清楚,有待更进一步的研究。
通过大鼠尾静脉注射CTGFsiRNA进一步证实,干预大鼠肝脏CTGF基因表达,可显著抑制CCl4诱导的肝纤维化的发生发展,表现为肝细胞外基质合成及分泌减少,Ⅰ、Ⅲ型胶原及层黏连蛋白是ECM的主要组份,但透明质酸(HA)及Ⅲ型前胶原(hpcⅢ)是反映肝纤维化发生发展动态变化最灵敏的两种ECM成分[9]。本实验研究结果显示,沉默CTGF表达对CCl4介导的肝纤维大鼠外周血HA及Ⅲ型前胶原的含量有明显减少,而空白对照组大鼠上述参数无明显差异。
肝内的CTGF主要是由活化的HSC和(或)增殖的胆管上皮细胞产生,siRNA的沉默时间将因为细胞的增殖分裂而缩短。因此,要在体内持久(4~6周)沉默肝脏内CTGF的表达,则必须反复给药,这对于经门静脉注射siRNA来说将难以操作,因为反复经门静脉给药会将感染的几率加大[5]。本研究结果显示:经尾静脉注射siRNA不仅可以有效的抑制靶基因表达,而且可以反复给药,最终达到持续抑制的效果。
但是,体外合成的siRNA转染细胞后干扰效能只能维持短短几天,因此,我们将在后续实验中利用质粒构建所筛选出的高效的siCTGF-2特异性载体,以延长其干扰作用的持续时间。此外,如何选择准确的方法使合成siRNA更加省时且经济有效;如何有效输送siRNA到达靶位及确保siRNA在体内长期稳定表达等问题,都有待于人们研究解决。近年来这些疑惑正被逐步探索。我们相信在不久的将来,RNAi技术在有效抗肝纤维化治疗中将发挥其巨大作用,造福于人类健康。
[1]BLOM I E,GOLDSCHMEDING R,LEASK A.Gene regulation of connective tissue growth factor:new targets for antifibrotic therapy [J]?Matrix Biol,2002,21(6):473-482.
[2]RACHFAL A W,BRIGSTOCK D,R.Connective tissue growth factor(CTGF/CCN2)in hepatic fibrosis[J].Hepatol Res,2003,26(1):1-9.
[3]PHANISH M K,WINN S K,DOCKRELL M E.Connective tissue growth factor-(CTGF,CCN2)--a marker,mediator and therapeutic target for renal fibrosis[J].Nephron Exp Nephrol,2010,114(3):83-92.
[4]LEASK A.Thrombin-induced CCN2 expression as a target for anti-fibrotic therapy in scleroderma[J].J Cell Commun Signal,2010,4(2):111-112.
[5]LEWIS D L,HAGSTROM J E,LOOMIS A G,et al.Efficient delivery of siRNA for inhibition of gene expression in postnalice [J].Nat Genet,2002,32:107-108.
[6]SHEK F W,BENYON R C.How can transforming growth factor beta be targeted usefully to combat liver fibrosis[J]?Eur J Gastroenterol Hepatol,2004,16(2):123-126.
[7]LI Guang-ming,XIE Qing,SHI Yi,et al(李光明,谢 青,史 毅,等).Inhibition of connective tissue growth factor by siRNA prevents liver fibrosis in rats[J].Chinese Journal of Digestion(中华消化杂志),2005,25(6):336-339.(in Chinese)
[8]HIGASHIYAMA H,YOSHIMOTO D,KAISE T,et al.Inhibition of activin receptor-like kinase 5 ttenuates bleomycin-induced pulmonary fibrosis[J].Exp Mol Pathol,2007,83(1):39-46.
[9]FRIEDMAN S L.Liver fibrosis-bench to bedside[J].J Hepatol,2003,38(Suppl 1):S38-53.

